
- •Белки. Уровни структурной организации белковой молекулы. Связь структуры и функций.
- •2.Белки. Физико-химические свойства белков (денатурация, растворимость, электрофоретическая подвижность). Методы исследования структуры белков.
- •Методы разделения (фракционирования) белков
- •3.Белки. Четвертичная структура. Гемоглобин. Миоглобин. Строение. Особенности функционирования. Гемоглобинопатии. Характеристика сложных белков
- •Хромопротеины
- •4.Ферменты – биокатализаторы. Активный центр ферментов. Его формирование у ферментов с различной структурой. Активаторы и ингибиторы.
- •5.Ферменты. Регуляция действия ферментов: аллостерические механизмы, протеолиз. Регуляция активности ферментов
- •Номенклатура ферментов
- •7.Строение ферментов. Формирование активного центра у простых и сложных ферментов. Механизм действия. Роль витаминов в функционировании ферментов.
- •Строение коферментов
- •8.Современные представления о механизме тканевого дыхания. Пиридинзависимые дегидрогеназы. Их коферменты. Строение и роль в биологическом окислении.
- •III. Биологическое окисление.
- •Дыхательная цепь (дц) (или Цепь Переноса Электронов – цпэ, или Электрон-Транспортная Цепь – этц)
- •Функционирование дц
- •Окислительное фосфорилирование
- •Альтернативные варианты биологического окисления
- •9.Флавиновые ферменты. Их простетические группы. Роль в биологическом окислении.
- •10. Терминальные стадии биологического окисления. Цитохромы. Роль цитохромоксидазы в окислительно-восстановительных реакциях.
- •11.Структура и роль атф. Субстратное и окислительное фосфорилирование.
- •Субстратное фосфорилирование
- •Функционирование дц
- •Окислительное фосфорилирование
- •13. Роль тканевого дыхания в обеспечении организма энергией. Взаимосвязь биологического окисления с цтк и бета-окислением.
- •14.Микросомальное окисление. Локализация и значение процесса в обмене веществ. Роль цитохрома р450.
- •Микросомальное окисление
- •16 Анаэробный процесс распада углеводов для мышц.
- •19. Метаболизм гликогена.Мобилизация гликогена (гликогенолиз)
- •20 Глюконеогенез (схема процесса), его регуляция. Цикл Кори.
- •Патогенез
- •Строение и функции липидов. Метаболизм липидов и его регуляция
- •24. Липиды. Классификация. Строение. Биологическая роль. Нейтральные жиры, фосфолипиды, гликолипиды, холестерин, простагландины.
- •25.Переваривание нейтральных жиров в жкт. Всасывание продуктов переваривания. Ресинтез жиров в кишечнике. Транспортные формы липидов в крови. Липопротеины, их характеристика.
- •26. Жиры как источник энергии. Обмен жирных кислот в тканях. Бета-окисление. Последовательность реакций. Связь обмена жирных кислот с цитратным циклом и тканевым дыханием.
- •27. Синтез высших жирных кислот и нейтральных жиров в организме. Особенности. Пути образования жиров из углеводов и аминокислот. Роль пентозофосфатного цикла в обеспечении синтеза жиров.
- •28. Холестерин. Структура и биологическое значение. Биосинтез. Значение определения холестерина в сыворотке крови для диагностики заболеваний.
- •29.Кетоновые тела, синтез, строение. Концентрация кетоновых тел в норме и при патологии(сахарный диабет), при голодании.
- •31.Реакции трансаминирования и синтеза заменимых аминокислот в организме. . Роль витамина в6в этом процессе. Диагностическое значение определения трансаминаз.
- •32.Декарбоксилирование аминокислот. Образование биогенных аминов: гистамина, серотонина, гамк. Роль биогенных аминов.
- •33. Дезаминирование аминокислот и образование аммиака в организме. Пути его обезвреживания. Количественное определение мочевины в сыворотке крови. Диагностическое значение.
- •34. Обмен фенилаланина, тирозина. Использование тирозина для синтеза катехоламинов, тироксина, меланина. Нарушение обмена фенилаланина.
- •35. Обмен серосодержащих аминокислот; серина; триптофана.
- •36. Диаминокарбоновые и моноаминодикарбоновые кислоты (аргинин, лизин, гистидин, аспарагиновая и глутаминовая кислоты). Строение. Превращение, участие в обмене.
- •37. Нуклеопротеины. Нуклеиновые кислоты: днк, рнк. Строение. Функции. Представление об укладке днк в хроматине
- •38. Типы рнк. Особенности структуры. Функции. Биосинтез рнк (транскрипция). Особенности синтеза м-рнк у эукариот и прокариот. Рибосомы. Строение, биологическая роль.
- •39.Генетический код. Биохимические основы хранения наследственных признаков и механизм их передачи. Виды мутаций.
- •40. Биосинтез белка. Трансляция. Этапы биосинтеза на рибосомах. Постсинтетическая модификация белка.
- •Биохимия крови
- •44.Белки крови. Особенности строения и функции иммуноглобулинов.
- •45. Катаболизм гемоглобина. Виды билирубина. Желтухи.
- •Биохимия тканей
- •46. Белки соединительной ткани – коллаген, эластин, протеогликаны. Особенности структуры и функции. Роль витамина с в функционировании соединительной ткани.
- •48. Биохимия нервной ткани. Особенности метаболизма мозга. Образование и роль производных аминокислот: серотонина, гамк, гистамина, других биогенных аминов. Обезвреживание аммиака в нервной ткани.
- •49. Биохимия костной ткани. Роль органических и минеральных компонентов в функционировании костной ткани. Роль витаминов с и d в формировании костной ткани.
- •Гормоны. Структура и биологическая роль
- •50. Гормоны передней доли гипофиза. Соматотропин. Химическая природа, биологическая роль.
- •51. Гормоны задней доли гипофиза: окситоцин, вазопрессин. Химическая природа. Биологическая роль.
- •53. Гормоны мозгового слоя надпочечников: адреналин, норадреналин. Строение. Синтез. Биологическая роль. Механизм действия.
- •55.Гормоны щитовидной железы. Биосинтез. Влияние на метаболизм. Механизм действия. Гипо- и гипертиреозы.
- •56. Гормоны стероидной природы. Классификация. Кортикостероиды: глюкокортикоиды и минералокортикоиды. Строение. Биологическая роль. Механизм действия.
- •57. Гормоны половых желез. Строение. Влияние на обмен веществ. Механизм действия.
- •Андрогены
- •Эстрогены
- •58. Взаимосвязь обмена углеводов, липидов, аминокислот (схема). Гормональная регуляция. Роль инсулина, глюкагона, адреналина.
- •59. Общаяя характеристика витаминов. Классификация. Участие в обмене. Связь с ферментами.
- •Классификация витаминов
- •Участие витаминов в обмене веществ
- •60. ВитаминВ1. Структура. Роль в обменевеществ. Гиповитаминоз
- •Витамин в1
- •Роль витамина в1 в обмене веществ
- •61. Витамин в2. Строение, участие в обмене. Связь с ферментами. Гиповитаминоз Витамин в2
- •62. Витамин рр. Строение, участие в обмене. Взаимосвязь с ферментами. Гиповитаминоз Витамин рр
- •Роль витамина рр в обмене веществ
- •63.Витамин в6. Строение. Участие в обмене. Гиповитаминоз Витамин в6
- •Роль витамина в6 в обмене веществ
- •64.Антианемическиевитамины (в12, в9). Особенностиструктуры, роль в метаболизме, гиповитаминозы. Витамин в9 (фолиевая кислота)
- •Роль фолиевой кислоты в обмене веществ
- •Витамин в12
- •Роль кобаламина в обмене веществ
- •65. Витамин с. Структура, роль в обмене. Участие в Реминеральзации и образовании зуба. Авитаминоз. Витамин с
- •Роль витамина с в обмене веществ
- •66. Жирорастворимыевитамины. Общая характеристика группы. Витамин а.Провитамин. Строение.Биологическая роль. Участие в образованииродопсина. Авитаминоз.
- •Свойства жирорастворимых витаминов
- •Жирорастворимые витамины и их функции
- •Витамин а
- •67. Жирорастворимыевитамины. Витамингруппы д. Провитамины. Строение, роль в обменекальция и фосфора в обменекостнойткани зуба. Симптомынедостаточности
- •68. Жирорастворимыевитамины е и к. Их биологическая функція Витамин е
- •Роль витамина е в обмене веществ
- •Витамин к
- •Роль витамина к в обмене веществ
- •69. Роль витаминов а,с,д в процессе минерализации зуба
- •Биохимия печени
- •70.Функции печени. Роль печени в обезвреживании токсических веществ. Роль цитохрома р450.
- •71.Функции печени. Участие в обмене углеводов. Цикл Кори. Аланиновый цикл.
- •72.Роль печени в обмене липидов. Транспортные формы липидов.
- •73.Роль печени в обмене белков и аминокислот. Обезвреживание аммиака в орнитиновом цикле.
- •Биохимия почек
- •74.Роль водно-солевого обмена в функционировании организма. Регуляция водно-солевого обмена (ренин-ангиотензиновая система, роль альдостерона и вазопрессина).
- •75.Особенности биохимического состава дентина. Изменение при патологии
- •76.Особенности биохимического состава и биохимическая роль пульпы.
- •77.Биохимия ротовой жидкости. Белки слюны. Их характеристика. Роль кальций-связывающего белка.
- •78.Биохимия ротовой жидкости. Ферменты слюны: амилаза, лизоцим, пероксидаза. Их биологическая роль. Определение активности амилазы слюны.
- •79.Особенности биохимического состава слюны. Факторы, влияющие на состав слюны. РН слюны. Патология, вызываемая изменением рН.
- •80.Биохимический состав зуба. Характеристика биохимических компонентов: белков, липидов, углеводов.
- •84.Фторапатиты, флюороз, профилактика, лечение.
- •85.Биохимические изменения в тканях зуба при патологии.
7.Строение ферментов. Формирование активного центра у простых и сложных ферментов. Механизм действия. Роль витаминов в функционировании ферментов.
Строение ферментов. В пространственной структуре фермента условно выделяют ряд участков, которые выполняют соответствующие им функции. Активный центр (АЦ) – участок в молекуле фермента, где происходит связывание и химическое превращение субстрата (S). Субстрат – вещество, подвергающееся химическому превращению (например, для фермента лактатдегидрогеназы (ЛДГ) субстратом будет молочная кислота). В активном центре выделяется контактный участок и каталитический участок. Контактный участок – это место активного центра, в котором происходит связывание фермента с субстратом по принципу комплементарности, т.е. именно контактный участок обеспечивает специфическое сродство субстрата ферменту. Образовавшийся комплекс носит название фермент-субстратный комплекс. Каталитический участок (центр) – это место в активном центре фермента, где происходит химическое превращение субстрата [рис. изображён фермент-субстратный комплекс, а именно контактный участок, каталитический участок, активный центр и субстрат].
Если фермент – сложный белок, то обычно простетическая часть находится тоже в активном центре и участвует в формировании активного центра. Активный центр занимает небольшую часть молекулы фермента, обычно располагается в углублении, и в его образовании участвует небольшое число аминокислотных остатков (до 20). Аминокислотные остатки могут быть удалены друг от друга, но при формировании пространственной структуры фермента они располагаются в области активного центра.
В формировании активного центра могут участвовать остатки, несущие следующие функциональные группы: NH2 (ЛИЗ, АРГ), COOH (ГЛУ, АСП), OH (СЕР, ТРЕ), SH (ЦИС), имидазольное кольцо (ГИС). В качестве единиц, участвующих в формировании активного центра, могут выступать кофакторы - ионы металлов (Cu2+, Fe2+ и т.д.), а также коферменты. В сложном ферменте АК-остатки активного центра создают условия для правильной его конформации и помогают кофакторам в связывании, ориентации, а, следовательно, и в превращении субстрата.
Боковые группы остальных аминокислот не участвуют в образовании активного центра, но обеспечивают правильную пространственную конформацию активного центра и влияют на его реакционную способность.
Ряд ферментов могут содержать аллостерический центр. [рис. фермента с аллостерическим и активным центрами] Эти ферменты относят к аллостерическим ферментам. К аллостерическому центру присоединяются различные вещества, отличные по строению от субстрата. Эти вещества могут изменять конформацию активного центра, т.е. влиять на связывание и превращение субстрата, они называются аллостерическими эффекторами. Все аллостерические эффекторы делятся на положительные – активаторы, и отрицательные – ингибиторы.
Строение коферментов
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
- ковалентными связями;
- ионными связями;
- гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы – производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
- тиаминмонофосфат (ТМФ);
- тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
- тиаминтрифосфат (ТТФ).
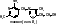
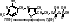
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, -кетоглутаровая кислота. Этот фермент катализирует отщепление СО.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
- флавинмононуклеотид (ФМН);
- флавинадениндинуклеотид (ФАД).
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
[рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ]
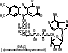
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
![]()
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР - никотинамида:

Представители:
- никотинамидадениндинуклеотид (НАД);
- никотинамидадениндинуклеотидфосфат (НАДФ).
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.

Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н+]
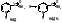
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]

- пиридоксин;
- пиридоксаль;
- пиридоксамин.
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ - амилазы, Mg2+ - АТФ-азы (например, миозиновой АТФ-азы).
Могут участвовать в:
-присоединении субстратного комплекса фермента;
-в катализе;
-стабилизация оптимальной конформации активного центра фермента;
-стабилизация четвертичной структуры.
