
- •Белки. Уровни структурной организации белковой молекулы. Связь структуры и функций.
- •2.Белки. Физико-химические свойства белков (денатурация, растворимость, электрофоретическая подвижность). Методы исследования структуры белков.
- •Методы разделения (фракционирования) белков
- •3.Белки. Четвертичная структура. Гемоглобин. Миоглобин. Строение. Особенности функционирования. Гемоглобинопатии. Характеристика сложных белков
- •Хромопротеины
- •4.Ферменты – биокатализаторы. Активный центр ферментов. Его формирование у ферментов с различной структурой. Активаторы и ингибиторы.
- •5.Ферменты. Регуляция действия ферментов: аллостерические механизмы, протеолиз. Регуляция активности ферментов
- •Номенклатура ферментов
- •7.Строение ферментов. Формирование активного центра у простых и сложных ферментов. Механизм действия. Роль витаминов в функционировании ферментов.
- •Строение коферментов
- •8.Современные представления о механизме тканевого дыхания. Пиридинзависимые дегидрогеназы. Их коферменты. Строение и роль в биологическом окислении.
- •III. Биологическое окисление.
- •Дыхательная цепь (дц) (или Цепь Переноса Электронов – цпэ, или Электрон-Транспортная Цепь – этц)
- •Функционирование дц
- •Окислительное фосфорилирование
- •Альтернативные варианты биологического окисления
- •9.Флавиновые ферменты. Их простетические группы. Роль в биологическом окислении.
- •10. Терминальные стадии биологического окисления. Цитохромы. Роль цитохромоксидазы в окислительно-восстановительных реакциях.
- •11.Структура и роль атф. Субстратное и окислительное фосфорилирование.
- •Субстратное фосфорилирование
- •Функционирование дц
- •Окислительное фосфорилирование
- •13. Роль тканевого дыхания в обеспечении организма энергией. Взаимосвязь биологического окисления с цтк и бета-окислением.
- •14.Микросомальное окисление. Локализация и значение процесса в обмене веществ. Роль цитохрома р450.
- •Микросомальное окисление
- •16 Анаэробный процесс распада углеводов для мышц.
- •19. Метаболизм гликогена.Мобилизация гликогена (гликогенолиз)
- •20 Глюконеогенез (схема процесса), его регуляция. Цикл Кори.
- •Патогенез
- •Строение и функции липидов. Метаболизм липидов и его регуляция
- •24. Липиды. Классификация. Строение. Биологическая роль. Нейтральные жиры, фосфолипиды, гликолипиды, холестерин, простагландины.
- •25.Переваривание нейтральных жиров в жкт. Всасывание продуктов переваривания. Ресинтез жиров в кишечнике. Транспортные формы липидов в крови. Липопротеины, их характеристика.
- •26. Жиры как источник энергии. Обмен жирных кислот в тканях. Бета-окисление. Последовательность реакций. Связь обмена жирных кислот с цитратным циклом и тканевым дыханием.
- •27. Синтез высших жирных кислот и нейтральных жиров в организме. Особенности. Пути образования жиров из углеводов и аминокислот. Роль пентозофосфатного цикла в обеспечении синтеза жиров.
- •28. Холестерин. Структура и биологическое значение. Биосинтез. Значение определения холестерина в сыворотке крови для диагностики заболеваний.
- •29.Кетоновые тела, синтез, строение. Концентрация кетоновых тел в норме и при патологии(сахарный диабет), при голодании.
- •31.Реакции трансаминирования и синтеза заменимых аминокислот в организме. . Роль витамина в6в этом процессе. Диагностическое значение определения трансаминаз.
- •32.Декарбоксилирование аминокислот. Образование биогенных аминов: гистамина, серотонина, гамк. Роль биогенных аминов.
- •33. Дезаминирование аминокислот и образование аммиака в организме. Пути его обезвреживания. Количественное определение мочевины в сыворотке крови. Диагностическое значение.
- •34. Обмен фенилаланина, тирозина. Использование тирозина для синтеза катехоламинов, тироксина, меланина. Нарушение обмена фенилаланина.
- •35. Обмен серосодержащих аминокислот; серина; триптофана.
- •36. Диаминокарбоновые и моноаминодикарбоновые кислоты (аргинин, лизин, гистидин, аспарагиновая и глутаминовая кислоты). Строение. Превращение, участие в обмене.
- •37. Нуклеопротеины. Нуклеиновые кислоты: днк, рнк. Строение. Функции. Представление об укладке днк в хроматине
- •38. Типы рнк. Особенности структуры. Функции. Биосинтез рнк (транскрипция). Особенности синтеза м-рнк у эукариот и прокариот. Рибосомы. Строение, биологическая роль.
- •39.Генетический код. Биохимические основы хранения наследственных признаков и механизм их передачи. Виды мутаций.
- •40. Биосинтез белка. Трансляция. Этапы биосинтеза на рибосомах. Постсинтетическая модификация белка.
- •Биохимия крови
- •44.Белки крови. Особенности строения и функции иммуноглобулинов.
- •45. Катаболизм гемоглобина. Виды билирубина. Желтухи.
- •Биохимия тканей
- •46. Белки соединительной ткани – коллаген, эластин, протеогликаны. Особенности структуры и функции. Роль витамина с в функционировании соединительной ткани.
- •48. Биохимия нервной ткани. Особенности метаболизма мозга. Образование и роль производных аминокислот: серотонина, гамк, гистамина, других биогенных аминов. Обезвреживание аммиака в нервной ткани.
- •49. Биохимия костной ткани. Роль органических и минеральных компонентов в функционировании костной ткани. Роль витаминов с и d в формировании костной ткани.
- •Гормоны. Структура и биологическая роль
- •50. Гормоны передней доли гипофиза. Соматотропин. Химическая природа, биологическая роль.
- •51. Гормоны задней доли гипофиза: окситоцин, вазопрессин. Химическая природа. Биологическая роль.
- •53. Гормоны мозгового слоя надпочечников: адреналин, норадреналин. Строение. Синтез. Биологическая роль. Механизм действия.
- •55.Гормоны щитовидной железы. Биосинтез. Влияние на метаболизм. Механизм действия. Гипо- и гипертиреозы.
- •56. Гормоны стероидной природы. Классификация. Кортикостероиды: глюкокортикоиды и минералокортикоиды. Строение. Биологическая роль. Механизм действия.
- •57. Гормоны половых желез. Строение. Влияние на обмен веществ. Механизм действия.
- •Андрогены
- •Эстрогены
- •58. Взаимосвязь обмена углеводов, липидов, аминокислот (схема). Гормональная регуляция. Роль инсулина, глюкагона, адреналина.
- •59. Общаяя характеристика витаминов. Классификация. Участие в обмене. Связь с ферментами.
- •Классификация витаминов
- •Участие витаминов в обмене веществ
- •60. ВитаминВ1. Структура. Роль в обменевеществ. Гиповитаминоз
- •Витамин в1
- •Роль витамина в1 в обмене веществ
- •61. Витамин в2. Строение, участие в обмене. Связь с ферментами. Гиповитаминоз Витамин в2
- •62. Витамин рр. Строение, участие в обмене. Взаимосвязь с ферментами. Гиповитаминоз Витамин рр
- •Роль витамина рр в обмене веществ
- •63.Витамин в6. Строение. Участие в обмене. Гиповитаминоз Витамин в6
- •Роль витамина в6 в обмене веществ
- •64.Антианемическиевитамины (в12, в9). Особенностиструктуры, роль в метаболизме, гиповитаминозы. Витамин в9 (фолиевая кислота)
- •Роль фолиевой кислоты в обмене веществ
- •Витамин в12
- •Роль кобаламина в обмене веществ
- •65. Витамин с. Структура, роль в обмене. Участие в Реминеральзации и образовании зуба. Авитаминоз. Витамин с
- •Роль витамина с в обмене веществ
- •66. Жирорастворимыевитамины. Общая характеристика группы. Витамин а.Провитамин. Строение.Биологическая роль. Участие в образованииродопсина. Авитаминоз.
- •Свойства жирорастворимых витаминов
- •Жирорастворимые витамины и их функции
- •Витамин а
- •67. Жирорастворимыевитамины. Витамингруппы д. Провитамины. Строение, роль в обменекальция и фосфора в обменекостнойткани зуба. Симптомынедостаточности
- •68. Жирорастворимыевитамины е и к. Их биологическая функція Витамин е
- •Роль витамина е в обмене веществ
- •Витамин к
- •Роль витамина к в обмене веществ
- •69. Роль витаминов а,с,д в процессе минерализации зуба
- •Биохимия печени
- •70.Функции печени. Роль печени в обезвреживании токсических веществ. Роль цитохрома р450.
- •71.Функции печени. Участие в обмене углеводов. Цикл Кори. Аланиновый цикл.
- •72.Роль печени в обмене липидов. Транспортные формы липидов.
- •73.Роль печени в обмене белков и аминокислот. Обезвреживание аммиака в орнитиновом цикле.
- •Биохимия почек
- •74.Роль водно-солевого обмена в функционировании организма. Регуляция водно-солевого обмена (ренин-ангиотензиновая система, роль альдостерона и вазопрессина).
- •75.Особенности биохимического состава дентина. Изменение при патологии
- •76.Особенности биохимического состава и биохимическая роль пульпы.
- •77.Биохимия ротовой жидкости. Белки слюны. Их характеристика. Роль кальций-связывающего белка.
- •78.Биохимия ротовой жидкости. Ферменты слюны: амилаза, лизоцим, пероксидаза. Их биологическая роль. Определение активности амилазы слюны.
- •79.Особенности биохимического состава слюны. Факторы, влияющие на состав слюны. РН слюны. Патология, вызываемая изменением рН.
- •80.Биохимический состав зуба. Характеристика биохимических компонентов: белков, липидов, углеводов.
- •84.Фторапатиты, флюороз, профилактика, лечение.
- •85.Биохимические изменения в тканях зуба при патологии.
Методы разделения (фракционирования) белков
1. Высаливание – разделение на основе различной растворимости альбуминов и глобулинов. Осаждение белков обычно производят сульфатом аммония (NH4)2SO4. В насыщенном растворе этого реактива осаждаются альбумины, а в полунасыщенном – глобулины.
2. Электрофорез – разделение белков при движении в электрическом поле за счет разности их заряда.
Основные белки сыворотки крови делятся на несколько фракций. Быстрее всех движутся к аноду альбумины – это гомогенная фракция. Глобулины делятся на 4 фракции: 1, 2, , [рис. альбуминов и 4-х глобулинов и как они движутся к аноду].
В крови определяется общий белок. Нормальное общее содержание белка, но изменено соотношение его фракций – диспротенемия. При инфекционных заболеваниях увеличивается содержание gg-глобулиновой фракции. При заболеваниях почек снижается содержание альбуминовой фракции, но увеличивается содержание aa2 и bb глобулинов. Также наблюдается парапротеинемия – появление патологических белков, например при некоторых онкологических заболеваниях.
3.Белки. Четвертичная структура. Гемоглобин. Миоглобин. Строение. Особенности функционирования. Гемоглобинопатии. Характеристика сложных белков
Они имеют белковую и небелковую (простетическую) части. Белковую часть составляет полипептид, построенный из АК-остатков. В состав небелковой части может входить: гем, металл, остаток фосфорной кислоты, углеводы, липиды и т.д.
Хромопротеины
Для них простетическая часть окрашена (chromos – краска). К хромопротеинам относятся гемоглобин, миоглобин, каталаза, пероксидаза, ряд флавинсодержащих ферментов (сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза), цитохромы (гемсодержащие белки) и т.д. Велика биологическая роль этих белков – участвуют в физиологических процессах: дыхание клетки, транспорте кислорода и углекислого газа, окислительно-восстановительных процессах.
Гемоглобин. Его белковая часть представлена глобином, небелковая – гемом. Это олигомерный белок, т.е. имеет четвертичную структуру, состоящую из 4 субъединиц.
цепи построены из 141 АК-остатка.
цепи из 146 АК-остатков [рис. 4-х субъединиц, в каждой нарисована точка - гем].
Каждая из субъединиц связана с гемом:
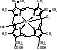 [гем]
[гем]
Основная функция гемоглобина – транспортная (кислород, углекислый газ). Также он представляет собой основную буферную систему крови (75% от всей буферной емкости крови).
Различают:
- HbO2 – оксигемоглобин (связан с молекулой O2);
- HbCO – карбоксигемоглобин;
- HbCO2 – карбгемоглобин;
- HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород).
Типы гемоглобина. Всего известно более 100 типов, но их все делят на 2 группы:
1) Физиологические гемоглобины;
2) Патологические (аномальные).
К физиологическим гемоглобинам относятся:
- Hb P – примитивный гемоглобин, имеет место быть у 1-2 недельного эмбриона;
- Hb F – фетальный или гемоглобин плода, к моменту рождения составляет около 70% всего гемоглобина в крови;
- Hb A, Hb A2, Hb A3 – это гемоглобины взрослого организма. На Hb A приходится около 90-96%.
Физиологические типы гемоглобинов отличаются глобулиновой частью (АК-составом). Например Hb A содержит 2 и 2bb субъединицы, а Hb F – 2 и 2 субъединицы.
К аномальным (возникающих при наследственных заболеваниях) гемоглобинам относятся:
- HbS – гемоглобин, сопутствующий серповидно-клеточной анемии. Отличается от нормального тем, что с N-конца в 6 положении bb–цепи глутамин заменен на валин.
Миоглобин по сравнению с гемоглобином имеет третичную структуру, одну полипептидную цепь, один гем и может связывать одну молекулу кислорода. Гемоглобин и миоглобин функционируют вместе. Гемоглобин доставляет кислород из легких к тканям, а миоглобин перераспределяет его внутри клетки (доставляет к митохондриям).
Оба белка – гемопротеины, т.е. гемсодержащие белки.
ГЕМОГЛОБИНОПАТИЯ (от гемоглобин и ...патия) (гемоглобиноз) -группа наследственных заболеваний, обусловленных присутствием в эритроцитах дефектных гемоглобинов.Основное проявление - гемолиз. См. Серповидноклеточная анемия, Талассемия.
