
- •МЫШЕЧНАЯ ТКАНЬ
- •Мышечная ткань
- •Функции мышечной ткани
- •Классификация
- •Морфологическая
- •Поперечно-полосатые мышечные ткани
- •Происхождение мышечных тканей
- •Гистогенетическая
- •Общая морфофункциональная характеристика мышечных тканей
- •Общая морфофункциональная характеристика мышечных тканей
- •Общие свойства мышечных тканей
- •Скелетная мышечная ткань
- •Скелетная поперечнополосатая мышечная ткань
- •Скелетная мышечная ткань
- •Скелетная поперечнополосатая мышечная ткань
- •Скелетная мышечная ткань
- •Сократительные структуры
- •Скелетная мышечная ткань
- •Миофибриллы
- •Поперечная исчерченность
- •Поперечная исчерченность
- •Диск А (темный)
- •Толстые миофиламенты
- •Толстые миофиламенты
- •I-диск (светлый)
- •Тонкие миофиламенты
- •Тонкие миофиламенты
- •Саркомер
- •Телофрагма
- •Саркомер
- •Саркомер
- •Саркомер
- •Саркомер
- •Опорные структуры саркомера
- •Опорные структуры саркомера
- •Специальные структуры мышечной ткани
- •Т-трубочки (1) и L-канальцы (2)
- •Механизм сокращения
- •Механизм сокращения
- •Механизм сокращения
- •Механизм сокращения
- •Трупное окоченение
- •Образование мышечных волокон
- •Миосателлиты
- •Типы мышечных волокон
- •Красные и белые волокна
- •Типы мышечных волокон
- •Красные мышечные волокна
- •Красные волокна
- •Красные волокна
- •Белые мышечные волокна
- •Белые волокна
- •Белые волокна
- •Регенерация мышечной ткани
- •Регенерация
- •Регенерация
- •Мышца как орган
- •Мышца как орган
- •Сердечная мышечная ткань
- •Сердечная мышечная ткань
- •Вставочные диски
- •Вставочные диски
- •Регенерация
- •Разновидности кардиомиоцитов
- •Сердечная мышечная ткань
- •Т-трубочки и L-система
- •Сердечная мышечная ткань
- •Сердечная мышечная ткань
- •Сравнение скелетной и сердечной
- •Сравнение скелетной и сердечной
- •Сравнение скелетной и сердечной мышечной ткани
- •Гладкая мышечная ткань
- •Гладкая мышечная ткань
- •Гладкая мышечная ткань
- •Гладкая мышечная ткань
- •Гладкая мышечная ткань
- •Гладкая мышечная ткань
- •Гладкая мышечная ткань
- •Регенерация и обновление
- •Регенерация и обновление
- •Строение гладкого миоцита
- •Строение гладкого миоцита
- •Строение гладкого миоцита
- •Строение гладкого миоцита
- •Строение гладкого миоцита
- •Строение гладкого миоцита
- •Строение гладкого миоцита
- •Механизм сокращения гмт
- •Механизм сокращения гмт
- •Механизм сокращения гмт
- •СПАСИБО ЗА ВНИМАНИЕ!!!

Саркомер

Саркомер
Всего в саркомере – около 1400 толстых миофиламентов, что в 4 раза меньше количества тонких миофиламентов.
В области перекрывания толстые и тонкие миофиламенты расположены гексагональным образом, т.е. вокруг каждого толстого миофиламента находятся 6 тонких, а вокруг каждого тонкого - 3 толстые

Саркомер

Опорные структуры саркомера
Таким образом, упорядоченность расположения миофиламентов в миофибрилле и миофибрилл в миосимпласте поддерживается с помощью
ряда опорных структур:
телофрагмы,мезофрагмы,нитей титина,
промежуточных филаментов
костамеров.

Опорные структуры саркомера
Промежуточные филаменты образованы в миосимпластах белком десмином, которые связывают соседние телофрагмы миофибриллы и
миофибриллы с мембранными структурами
симпласта.
Костамеры - это кольца из белка винкулина, которые расположены под плазмолеммой и прикрепляют к ней I-диски подлежащих миофибрилл.

Специальные структуры мышечной ткани
Для передачи возбуждения от плазмолеммы к миофибриллам в миосимпластах существуют специальные мембранные структуры:
Т-трубочки – это глубокие каналообразные впячивания плазмолеммы, которые идут в поперечном направлении вокруг миофибрилл.
L-канальцы – это компонент гладкой ЭПС, которые имеют вид петель, окружающие каждую миофибриллу и ориентированы вдоль её длинной оси.
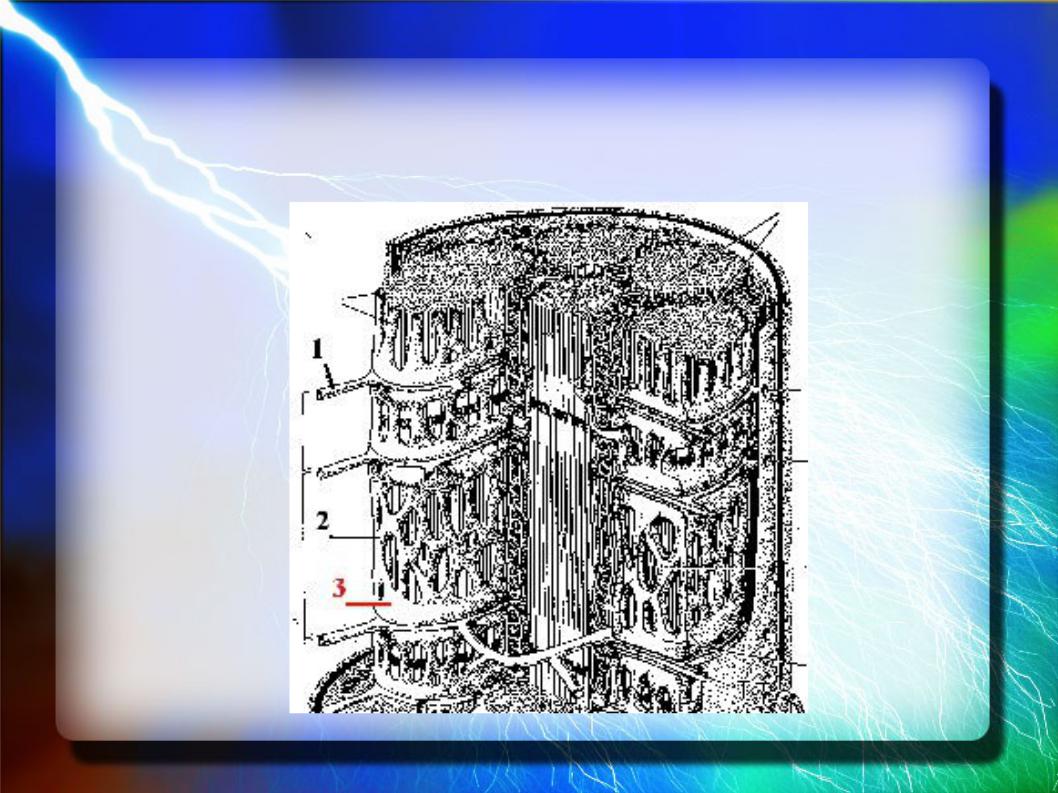
Т-трубочки (1) и L-канальцы (2)

Аккумуляция ионов Са2+ в цистернах
С помощью Са2+-насосов и Са2+-каналов:
Са2+-насос закачивает внутрь цистерн аЭПС ионы Са2+, поэтому в состоянии покоя вне цистерн, в саркоплазме – очень низкая
концентрация ионов Са2+, а внутри цистерн –
высокая концентрация ионов Са2+.
Са2+-каналы - в покоящемся мышечном волокне закрыты, а при возбуждении открываются.

Механизм сокращения
При возбуждении мышечного волокна в
сарколемме возрастает содержание ионов Са2+ , т.к. открываются Са2+-каналы
В тонких миофиламентах меняется конфигурация комплексов тропонин-тропомиозин, в результате освобождаются центры актина.
C освободившимися центрами актина
связываются миозиновые головки – образуются мостики между толстыми и тонкими
миофиламентами.

Механизм сокращения
АДФ и фосфат вытесняются актином из связи с миозиновыми головками.
Hапряжённая конформация миозиновых головок создаёт силу, тянущую тонкие и толстые
миофиламенты навстречу друг другуПроисходит их взаимное перемещение на
некоторое расстояние – тонкие МФ вдвигаются ещё глубже между толстыми МФ.
В итоге миозиновые головки переходят в менее напряжённое состояние.
