
- •1. Основные положения молекулярно-кинетической теории и их опытное обоснование. Число Авогадро. Масса и размеры молекул.
- •Билет 2.1
- •1. Тепловое равновесие. Температура и её физический смысл. Абсолютная температурная шкала. Шкала температур Цельсия.
- •Билет 3.1
- •1. Идеальный газ. Вывод уравнения состояния. Изопроцессы в идеальных газах.
- •Билет 4.1
- •1. Внутренняя энергия. Работа и количество теплоты. Первый закон термодинамики.
- •Билет 5.1
- •1. Виды теплообмена. Теплоёмкость. Калориметр. Уравнение теплового баланса.
- •Билет 6.1
- •1. Теплоёмкость идеального газа в изохорическом и изобарическом процессах. Применение первого закона термодинамики к изопроцессам.
- •Билет 7.1
- •1. Насыщенный пар. Изотермическое сжатие пара. Пересыщенный пар.
- •Билет 8.1
- •1. Испарение, кипение, конденсация. Удельная теплота перехода. Перегретая жидкость.
- •Билет 9.1
- •1. Плавление, кристаллизация. Удельная теплота перехода.
- •Билет 10.1
- •1. Зависимость давления насыщенных паров от температуры. Влажность воздуха. Точка росы.
- •Билет 11.1
- •1. Тепловое расширение твёрдых и жидких тел. Законы линейного и объёмного расширения.
- •Билет 12.1
- •1. Поверхностное натяжение. Разность давлений в двухфазной системе, разделённой сферической поверхностью. Капиллярные явления.
- •Билет 13.1
- •Билет 14.1
- •Билет 15.1
- •Билет 16.1
- •Билет 17.1
- •Билет 18.1
- •Билет 19.1
- •Билет 20.1
- •Билет 1.2
- •2. Электрическое поле. Напряжённость электрического поля. Принцип суперпозиции полей. Силовые линии.
- •Билет 2.2
- •2. Электрический заряд. Закон сохранения заряда. Закон Кулона.
- •Билет 3.2
- •2. Электрическое поле, создаваемое равномерно заряженной бесконечной плоскостью, длинным цилиндром и сферой.
- •Билет 4.2
- •2. Поток вектора напряжённости электрического поля. Теорема Гаусса.
- •2. Проводники в электрическом поле.
- •Билет 6.2
- •2. Изотропный диэлектрик в однородном постоянном электрическом поле. Диэлектрическая проницаемость.
- •Билет 7.2
- •2. Электроёмкость. Конденсатор. Энергия электрического поля.
- •Билет 8.2
- •2. Электрический ток. Плотность тока. Сила тока. Закон Ома. Сопротивление.
- •Билет 9.2
- •2. Электродвижущая сила. Гальванические элементы. Закон Ома для замкнутой цепи.
- •Билет 10.2
- •2. Работа электрического поля на участке цепи. Мощность, потребляемая резистором.
- •Билет 11.2
- •2. Закон Джоуля-Ленца. Зависимость сопротивления от температуры.
- •Билет 12.2
- •Билет 13.2
- •Билет 14.2
- •Билет 15.2
Билет 9.1
1. Плавление, кристаллизация. Удельная теплота перехода.
Удельная теплота плавления — количество теплоты, которое необходимо сообщить одной единице массы кристаллического вещества в равновесном изобарно-изотермическом процессе, чтобы перевести его из твёрдого (кристаллического) состояния в жидкое.
![]()
Термодинамическая фаза – термодинамически однородная по составу и свойствам часть ТДС, отделенная от других фаз поверхностями раздела, на которых скачком изменяются некоторые свойства системы.
Агрегатное состояние – совокупность фаз с приблизительно равной энергией.
Агрегатное состояние зависит от соотношения кинетической и потенциальной энергий частиц.
Билет 10.1
1. Зависимость давления насыщенных паров от температуры. Влажность воздуха. Точка росы.
Давление насыщенного пара должно увеличиваться линейно с ростом температуры, как это имеет место у идеальных газов при изохорных процессах. Однако, как показали измерения, давление насыщенного пара растёт с температурой гораздо быстрее, чем давление идеального газа. Происходит это из-за того, что с ростом температуры, а значит, и средней кинетической энергии, всё больше и больше молекул жидкости покидают её, увеличивая концентрацию, n пара над ней. А т.к.давление пропорционально n, то это увеличение концентрации пара и объясняет более быстрый рост давления насыщенного пара с температурой, по сравнению с идеальным газом. Рост давления насыщенных паров с температурой объясняет известный всем факт – при нагревании жидкости испаряются быстрее. Отметим, что, как только рост температуры приведёт к полному испарению жидкости, пар станет ненасыщенным, а зависимость его давления от температуры превратится в прямую, пересекающую ось абсцисс при T = 0 оС.
Влажность воздуха
Температура точки росы газа — это значение температуры газа, при котором водяной пар, содержащийся в газе, охлаждаемом изобарически, становится насыщенным над плоской поверхностью воды.
Абсолютная влажность воздуха - отношение массы пара к объему воздуха.
Относительная влажность воздуха - отношения парциального давления пара к давлению насыщенного пара при той же температуре.
Парциальное давление – давление отдельного газа в смеси. По закону Дальтона, сумма парциальных давлений всех газов в смеси равна давлению смеси.
Билет 11.1
1. Тепловое расширение твёрдых и жидких тел. Законы линейного и объёмного расширения.
При повышении температуры потенциальная энергия молекул увеличивается. Рассмотрим потенциал Ленарда-Джонса. Потенциальная энергия увеличилась. Теперь молекулы колеблются, амплитуда колебание ограничена на графике. Равновесное значение амплитуды смещается в сторон расширения из-за ассимметрии функции.
Линейное расширение твердых тел.
l2=l1(1+a∆T)
Объемное расширение твердых тел.
V2=V1(1+b∆T)
3a=b
Билет 12.1
1. Поверхностное натяжение. Разность давлений в двухфазной системе, разделённой сферической поверхностью. Капиллярные явления.
Поверхностное натяжение — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Поверхностное натяжение – искривление поверхности раздела двух жидких и/или газообразных сред за счет взаимодействия молекул на границе раздела (нескомпенсированного взаимодействия). Свободная поверхность – граница(поверхность) раздела между жидкостью и газом.
Поверхностная энергия – работа, которую совершают силы поверхностного натяжения, чтобы привести свободную поверхность жидкости в равновесие.
Поверхностная энергия – избыток потенциальной энергии на поверхности жидкости.
Сила поверхностного натяжения – сила, которая возникает на границе раздела и удерживает свободную поверхность жидкости в равновесии, вдоль поверхности жидкости, перпендикулярно линии, которая ограничивает жидкость и стремится сократить линию до минимума.
Коэффициент
поверхностного натяжения
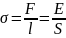
Краевой
угол
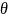
Формула Лапласа
Капиллярные явления – уровень жидкост разный в сосуде и тонкой трубке.
