
- •2. Бейорг-қ қосылыстардың негізгі кластары: қышқылдар, негіздер, тұздар, оксидтер.
- •3. Менделеевтің периодтық заңы мен элементтердің периодтық жүйесі,оның құрылымы.
- •4. Атом құрылысының квант-механикалық моделі.
- •6. Орбитальдарды элетрондармен толтыру реті. Энергияның кішірею принципі. Паули принципі. Хунд ережесі. Клечковский ережесі.
- •7. Энергетикалық денгейлермен денгейшелердін сиымдылығы. Атомдардын электрон қауыздарынын құрлысы. Периодтық жүйенің атом құрлысымен байланысы.
- •8. Периодтық жүйе бойынша элементтердің өзгеретін және өзгермейтін қасиеттері.
- •9. Иондану энергиясы, электронға тартқыштық, электртерістілік. Иондану потенциалы.
- •10. Химиялық байланыстың табиғаты. Валенттілік теориясы. Тотығу дәрежесі туралы түсінік.
- •11. Коваленттік байланыс.
- •12. П және σ байланыстар. Бай/с ұзындығы мен энергиясы
- •13. Коваленттік байланыс түзілуінің донорлы-акцепоторлы механизмі.
- •14. Иондық байланыс.
- •15. Металдық байланыс.
- •16. Сутектік байланыс. Оның түзілу механизмі.
- •17.Химиялық термодинамика.
- •24. Әр түрлі топтар мен периодтар элемент атомдарының валенттік мүмкіндіктері.
- •28. Су. Судың иондық күші, сутекті көрсеткіш.
- •30. Тұздар гидролизі. Гидролиздену дәрежесімен тұрақысы
- •40. Метал құймалары,қатты ерітінділер және интерметалдық қосылыстар.
28. Су. Судың иондық күші, сутекті көрсеткіш.
Су ─ жердегі ең көп таралған қосылыс.Қалыпты жағдайдағы таза су ─ түссіз,дәмсіз,иіссіз,мөлдір сұйық зат.Бұл табиғи жағдайда үш агрегаттық күйде бола алатын жалғыз сұйықтық.Су көптеген химиялық реакцияларда еріткіш,әрекеттесуші реагент н/е өнім ретінде қатынасады.Сұйық су үшін өздігінен иондану н/е авторотолиз(иондарға ыдырау)тән.Судық иондануын қысқартып жазады: H2O → H+ + OH-
Иондану кезінде бір сәтте Н+ және ОН- иондары түзіледі,яғни судың амфотерлік қасиеті болады.
Судың гидратерлеуші қасиет: CaCl2 + 6Н2О = CaCl2 * 6Н2О
Су электрохимиялық кернеу қатарындағы қалайыға дейінгі орналасқан металдарды тотықтырады. 2K + H2O = 2KOH + H2
Температура
1000ºС
жоғары болғанда бу сутек пен оттекке
ыдырайды,яғни молекула ішіндегі тотығу
тотықсыздану реакциясы жүреді: 2H2O
2H2 +O2. Ерітіндінің
иондық күші (µ)
– Ерітіндідегі барлық иондардың
концентрацияларын есепке алынатын
ерітіндінің сипаттамасы. Ерітіндінің
иондық күші (µ) мен fa арасындағы
математикалық байланыс Дебай –
Гюккельдің теңдеулерімен өрнектеледі
Сэ= 0,01-0,05 моль/л ерітінділер үшін lgfa=
-0.5 · z2 ·
Ерітіндінің
иондық күші (µ) мен fa арасындағы
математикалық байланыс Дебай –
Гюккельдің теңдеулерімен өрнектеледі
Сэ= 0,01-0,05 моль/л ерітінділер үшін lgfa=
-0.5 · z2 ·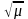 .
Cэ = 0,1 - 0,5 моль/л ерітінділер үшін lgfa
= -0.5 · z2 ·
.
Cэ = 0,1 - 0,5 моль/л ерітінділер үшін lgfa
= -0.5 · z2 ·
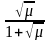 25ºC – де судың 1 литрінде иондарға судың
10-7 молі ыдырайды.Кез келген сулы
ерітіндінің ортасын сутек иондарының
конц.-сымен [Н+] н/е гидроксид – иондарының
концсымен [ОН-] сип.т болады:
25ºC – де судың 1 литрінде иондарға судың
10-7 молі ыдырайды.Кез келген сулы
ерітіндінің ортасын сутек иондарының
конц.-сымен [Н+] н/е гидроксид – иондарының
концсымен [ОН-] сип.т болады:
а) [Н+]=[ОН-]=10-7 моль/л б/са,онда бейтарапты.:
б) [Н+]>[ОН-],) [Н+]>10-7 моль/л б/о орта қышқылды.
В) [Н+]<[ОН-],) [Н+]<10-7 моль/л б/о орта cілтілі.
Әртүрлі қышқылдықта болатын еріт-дегі сутек иондарының конц. Коп реттілікке өзгере алады. Сондықтан ыңғайлы болу үшін сутегі иондарының конц.ң теріс ондық логарифмн пайдаланады,оны сутектік көрсеткіш рН деп а/ды. рН=-lg[Н+] pOH=-lg[ОН-] Қыш.еріт/де рН<7, бейтарапта рН=7,сілтілікте рН>7.
29. Акивілік акивтілік коэффицені. Ерітінділердің иондық күші. Активтілік коэффицент пен ерітіндінің иондық күшінің арасындағы байланыс. Активвтілік деп заттың эффективті,яғни барынша тиімді болатын концентрациясынайтады.1907ж Люис активтілік түсінігін енгізді.Күшті электролит ерітінділердегі иондардың күшін бағалауда активтілік шамасын пайдаланып- ол химиялық реакциядағы ионның эффективтік концентрациясы a=f*c Мұндағы f- активтілік коэффициент, ерітіндінің иондық күшіне тәуелді шама.Ерітіндінің иондық күші –ерітіндідегі барлық иондық концентрацияларын есепке алып отыратын ерітіндінің сипаттамасы.Ерітіндінің иондық күші ( ) мен f арасындағы математикалық байланыс Дебай-Гюккельдің теңдеулерімен өрнектеледі. Сэ=0,11-0,05 моль/л ерітінділері үшін Сэ=0,1-0,5 моль/л ерітінділер үшін
30. Тұздар гидролизі. Гидролиздену дәрежесімен тұрақысы
Тұздардың гидролизі- тұздар сумен алмасу реакциясына түскенде, әлсіз электролит түзіліп реакция ортасы өзгертетін процесс ( «гидро»-су, «лизис»-ыдырау). Гидролизге келесі тұздар ұшырайды: әлсіз қышқыл мен күшті негізден түзілген ( NaCO, KCLO, CHCOONa, NaCN, NaS, KSiO) күшті қышқыл мен әлсіз негізден түзілген (ZnCl, Cu(NO), NHBr, AlCl) және әлсіз қышқыл мен әлсіз негіздер түзілген (CHCOONH (NH)CO AlS CrS)
I сатысы ZnCl + HOH = ZnOHCL + HCI
II сатысы Zn+ + HOH = ZnOH+ H+ - гидролиз катион бойынша жүреді, рН 7
Zn + 2Cl + HOH = ZnOH + Cl + H + Cl
ZnOHCl + HOH = Zn(OH) + HCl
ZnOH + CL + HOH = Zn(OH) + H pH 7
Гидролиз тұрақтысы (К) – гидролизге ұшырайтын катион немесе анионның табиғатымен анықталатын шама. Гидролиз тұрақтысы мәні неғұрым жоғары болса, соғұрым тұз қатты гидролизденеді. Әлсіз қышқыл мен күшті негізден немесе күшті қышқыл мен әлсіз негізден түзілген тұздардың гидролиздену тұрақтысы мына формула бойынша есептелді К = K / K. Әлсіз қышқыл мен әлсіз негізден түзілген тұздың К= K /K * K Гидролиз дәрежесі- гидролизденген тұз молекуласы санының еріген молекуланың жалпы санына қатынасы.
31. Электрохимиялық процестердің анықтамалары мен жіктелуі.Электродтық потенциалдар туралы түсінік.Стандартты электродтық потенциалдар.Металл электродының потенциалын есептейтін Нернст теңдеуі.Химиялық және электрлік түрдегі энергияның өзара бірінің- біріне айналуымен шұғылданатын ғылым саласын электрохимия,ал процестің өзін–электрохимиялық процесс д.а. Электрохимиялық процестердің түрлері: гальваникалық элемент және электролиз.Гальваникалық элемент дегеніміз – химиялық энергияны электр энергиясына айналдыратын қондырғы.Гальваникалық элемент өз тұздарының ерітіндісіне батырылған екі электродтан тұрады.Электролиттің ерітіндісі немесе балқымасы арқылы тұрақты ток өткенде электродтарда жүретін тотығу- тотықсыздану реакцияларын электролиз деп атайды.Электродтық потенциал дегеніміз—қос электрлі қабаттағы потенциалдар айырымын айтамыз.Металдың химиялық белсенділігін сипаттайтын шама – стандартты электродтық потенциал деп атайды.
Нернст теңдеуі :
32.Гальваникалық элемент. Гальваникалық элементтің электр қозғаушы күші.Концентрациялық элемент. Гальваникалық элемент дегеніміз–химиялық энергияны электр энергиясына айналдыратын қондырғы.Гальваникалық элемент өз тұздарының ерітіндісіне батырылған екі электродтан тұрады. Гальваникалық элемент жұмыс істегенде электрод потенциалдарының ең максимальды айырмасы элементтің электр қозғаушы күші (Е) деп аталады.Концентрациялық элемент деп әртүрлі концентрациялардағы тұздардың ерітінділеріне батырылған екі бірдей электродтан тұратын жүйені айтады.
33. Газ электродтары. Сутектік және оттектік электрод/ң потенциал/н есептеу. Сутек электрондарының стандарты потенциалы ол 298К температурадағы сутек қысымы 1 атмосфера ж\е ерітіндідегі сутек иондарының белсенділігі бірге тең кездегі потенциалы.Иондану энергия/ң мәні үлкен болған/н асыл метал/р Au, Pt және т.б. ион/ры ерітін/ге беру арқылы потен/р айырма/н түзбейді.Ерітін/де бұл метал/ң иондарының болмауы асыл метал ерітінді шекара/да потенц/р айырмасы түзілуіне маңызды қызметті молекулалар ,атомдар және ортадағы иондарды іріктеп (таңдап) жұту арқылы жүргізіледі: стандартты сутектік электрод дег/з сутегі иондары/ң ( Н ) активтік концен/сы (1 моль/л-ге) тең күкірт қышқылына батырылған беті электролитттік жолмен кеуек платинамен қапталған платина электроды.Платина пластикасы (электроды ) арқылы атмосфералық қысыммен сутегі газы жіберіледі, сутегі молекулалары кеуек платинада адсорбцияланады ж/е онда жақсы ериді.Плати/ң катализ/ры ретінде әсер етуінің нәтиж/де сут/і молек/ры аздап атомды/ға ыдыратады.
34.
Тотығу-тотығсыздану потенциалдары
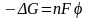 мұндағы n-электрондар саны.F-Фарадей
тұрақтысы. Электроттық потенциалдың
пайда болу мәні :егер металл жолағын
Me сол метал ионы бар ертіндіге енгізсе
онда келесі құбылыс жүреді де
мұндағы n-электрондар саны.F-Фарадей
тұрақтысы. Электроттық потенциалдың
пайда болу мәні :егер металл жолағын
Me сол метал ионы бар ертіндіге енгізсе
онда келесі құбылыс жүреді де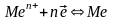 металл
мен ертінді арасында потенцалдар
айырымы пайда болады,оны электроттық
потенциалдар деп атайды.Бұл айырма
металл табиғатына және ертіндідегі
иондардың концентратциасына ,сол сиақты
температураға тәуелді.Стандартты
жағдайда жүретін реакциалар үшін,Гиббс
энергиасы мен электодық потенциалы
арасындағы байланыс
металл
мен ертінді арасында потенцалдар
айырымы пайда болады,оны электроттық
потенциалдар деп атайды.Бұл айырма
металл табиғатына және ертіндідегі
иондардың концентратциасына ,сол сиақты
температураға тәуелді.Стандартты
жағдайда жүретін реакциалар үшін,Гиббс
энергиасы мен электодық потенциалы
арасындағы байланыс
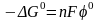 теңдеуімен өрнектеледі: Мұндағы
теңдеуімен өрнектеледі: Мұндағы
 шамасын
стандартты электродтық(тотығу-тотықсыздану)потенциалы
деп атайды.Яғыни заттың тотыққан және
тотықсызданған формалары бар ертіндіге
инертті электрод батырылғанда пайда
болатын потенциалды тотығу-тотықсыздану
потенциалы деп атайды.Потенциалын
есептейтін Нернст теңдеуі:
шамасын
стандартты электродтық(тотығу-тотықсыздану)потенциалы
деп атайды.Яғыни заттың тотыққан және
тотықсызданған формалары бар ертіндіге
инертті электрод батырылғанда пайда
болатын потенциалды тотығу-тотықсыздану
потенциалы деп атайды.Потенциалын
есептейтін Нернст теңдеуі:
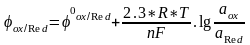
35.
Электро/қ процес/ң/ң кинетикасы.Электрод
потенциалы өзгереді-бұл құбылысыты
поляризация д/ді.
 поляр.
Дейді.
поляр.
Дейді. тепе-теңдік
потенциалы.Поляризация құбылысы анодта
да, катодта да, байқалуы мүмкін, сонд/н
поляризац/ны анодтыққа
тепе-теңдік
потенциалы.Поляризация құбылысы анодта
да, катодта да, байқалуы мүмкін, сонд/н
поляризац/ны анодтыққа
 ж/е
потенциалдыққа
ж/е
потенциалдыққа
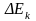 бөледі.Сондай-ақ ток өткендегі
потенциалдық өзгеруін аса кернеулік
д/а.Ток тығыздығына потенциал/ң графикалық
тәуелдігі поляризаци-қ қисық д/ді.
бөледі.Сондай-ақ ток өткендегі
потенциалдық өзгеруін аса кернеулік
д/а.Ток тығыздығына потенциал/ң графикалық
тәуелдігі поляризаци-қ қисық д/ді.
 i-ток
тығыздығы, S-электрод/қ беттік аудан
алаңы.а)Электрохимиялық поляризация(аса
кернеулік) ол реакциан/ң электрохимиялық
кезеңі баяулауымен байланысты потенциал/ң
өзгеруі мұны, яғни баяулатылған разряд
теориасын ұсынған орыс ғалымы
А.Н.Фрумкин.Электрохимиялық аса
кернеулікпен
i-ток
тығыздығы, S-электрод/қ беттік аудан
алаңы.а)Электрохимиялық поляризация(аса
кернеулік) ол реакциан/ң электрохимиялық
кезеңі баяулауымен байланысты потенциал/ң
өзгеруі мұны, яғни баяулатылған разряд
теориасын ұсынған орыс ғалымы
А.Н.Фрумкин.Электрохимиялық аса
кернеулікпен
 ж/е ток тығыздығы арасындағы байланысты
Тафель теңдеуімен өрнектейді:
ж/е ток тығыздығы арасындағы байланысты
Тафель теңдеуімен өрнектейді: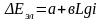 а,в-тұрақты б) концентрациалық
поляризация-электрод айналасындағы
қабатта ток өткенде байланысты
электродтың потенциалының өзгеруі:
а,в-тұрақты б) концентрациалық
поляризация-электрод айналасындағы
қабатта ток өткенде байланысты
электродтың потенциалының өзгеруі:
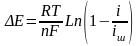 i-ток тығыздыға,
i-ток тығыздыға,
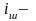 шекті
ток
шекті
ток
 Ертінді
көлеміндегі реагент/ң конц, D-диффузия
коэфиценті.
Ертінді
көлеміндегі реагент/ң конц, D-диффузия
коэфиценті.
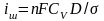
 диффузия
қабат қалыңдығы Сұйықтықты алмастырмаған
кезде ондағы молекулалар тек қана
диффузиның арқасында қозғалып, электрод
бетінің жанында жұқа қабатты түзеді.
Бұл жұқа қабат диффузиялық қабат д.а.
диффузия
қабат қалыңдығы Сұйықтықты алмастырмаған
кезде ондағы молекулалар тек қана
диффузиның арқасында қозғалып, электрод
бетінің жанында жұқа қабатты түзеді.
Бұл жұқа қабат диффузиялық қабат д.а.
36.
Электрод/ң ертіндісі н/е балқымасы
арқылы тұрақты ток өткен кезде
электродтарда жүретін тотығу-тотықсыздану
реакциаларын электрлиз
д.а. Тотықсыздану
реакциасы жүретін электрод(катд) токтың
сыртқы тізбегінің теріс полюсына, ал
тотығу реакциасы жүретін электрод
(анод)-оң полюсына қосылады.Натрий
хлориді балқымасын электролиздегенде
электродтарда өтетін реакциаларды
қарастыр/қ.а) теріс заряд/н катодта
натрий иондары металдық натрийге дейін
тотықсызданады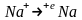 б) оң зарядталған анодта хлорид-иондары
газды хлорға дейін тотығады
б) оң зарядталған анодта хлорид-иондары
газды хлорға дейін тотығады
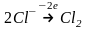 Электролиз
процесінің жалпы теңдеуі:
Электролиз
процесінің жалпы теңдеуі:
Электролиз өзінен-өзі жүрмейтін реакция, өйткені электрлік ток түріндегі энергияны жұмсауды талап етеді.Электролит/ң сулы ертінді/ң электролизі күрделі сипатта өтеді, өйткені онда су диссоцияға ж/е электролизге түседі.Токтың қаншалықты пайдалы жұмсалғанын сандық мөлшер тұрғысынан сипаттау ток бойынша шығым д.а.
Ағылшын
ғалымы М.Фарадей 1833 ж ұсынылған электролиз
заңдары:1) электродтарда электрохим/қ
түрленуге түскен заттың мөлшері: өткен
электр тогының мөлшеріне тура пропорционал
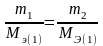 Фарадей
заңдарын біріктіру мынадай теңдеуге
әкеледі:
Фарадей
заңдарын біріктіру мынадай теңдеуге
әкеледі:
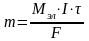 F-Фарадей
тұрақ/сы F-96500 2)электр тоғының мөлшері
тұрақты болған кезде электродтағы
әрекеттескен заттардың массасы
бір-біріне олардың эквиваленттерінің
молярлық массасы ретінде
қатысады.Электрохимиялық процестер
таза металл алуда,металды қабатпен
қаптауда,қалдықтан тазартуда қолданылады.
F-Фарадей
тұрақ/сы F-96500 2)электр тоғының мөлшері
тұрақты болған кезде электродтағы
әрекеттескен заттардың массасы
бір-біріне олардың эквиваленттерінің
молярлық массасы ретінде
қатысады.Электрохимиялық процестер
таза металл алуда,металды қабатпен
қаптауда,қалдықтан тазартуда қолданылады.
37.Қоршаған ортаның әсерінен металдың жаңа химиялық қосылыс түзе күйреуін – коррозия дейміз. Коррозияның күнде кездесетін мысалы- темірдің таттануы-темір ауадағы оттекпен тотығып, беті таттанады. Коррозия–металдарды қоршаушы ортаның әсерінен, өздігінен тотығу процесі. Коррозияның бір түрі –химиялық коррозия, ол қышқыл, сілті, тұздардың ерітінділерінің және түрлі газдардың (СО2, НСl т.б. ) тікелей әрекеті. Электрохимиялық коррозия- ол болу үшін электрохимиялық процесс өту керек, ондай процесс үшін екі электрод және элекродттар батырылған электролиттер болуы керек. Металл таза болса коррозияға ұшырамайды. Көптеген металдардың бетін азот қышқылы тәрізді тотықтырғышпен өңдегенде коррозия күрт баяулайды. Мұндай металл бетіндеқорғаушы қабат түзіп тоттануды азайтатын заттарды ПАССИВАТОРЛАР(ингибаторлар) дейді. Керісінше тездететін заттрады АКТИВАТОРЛАР дейді. Коррозиямен күрес – металл бұйымдарын бояу,оксидирлеу(металл бетіне осы металлдың оксидінің тыығыз қабатын алу),анодтау, электролиз арқылы металлмен қаптау, ол катодтық (белсенділігі төмендеу металл қабығы) және анодтық (белсенділеу металл қабығы) болады.,протекторлық қорғау,фосфаттандыру,Ингибаторларды қолдану, олар металл бетіне адсобцияланып оның потенциялын оңды етеді, осы арқылы жемірілу процесін баяулатады. ,электрмен қорғау
38. Коррозияның термодинамикасы мен кинетикасы.Химиялық коррозияның термодинамикасы Сұйық бейэлектролиттерде немесе жоғары температорада тотықтырғыш газдар(O2 галогиндер) ортада металдың өздігінен бүлінуінен химиялық коррозия жүреді. Коррозияда біден металдың электрондары тотықтырғышқа көшеді.Газдағы коррозияны қарастырайық.Металдың оттегімен тотығу реакция теңдеуін жазамыз nMe + m/2 * O2=MenOm.. Бұл реакйия химиялық термодинамика заңы бойынша, жүйенің Гиббс энегиясының мәні азайса ғана жүреді (∆G<0) Ереже бойынша жай заттардың түзілуі Гиббс энергиясының мәні 0 ге тең болады.Металдардың тотығуы Гиббс энергиясының мәндері окситердің түзілуі Гиббс энергиясынң мәніне тең болады.Металдың тотығу реакциясының Гиббс энергиясын теңдеумен есептеуге болады. ∆G=∆G0-(mRT/2) LnPO2 Мұнда ∆G0-реакцияның стандарты Гиббс энергиясы; PO2-оттегінің салыстырмалы парциялдық қысымы (P=101.3); Көп металдырдың тотығу реакцияларының стандартты Гиббс энергиясының мәндері 0 ден кем болады.Сондықтан көп металдар оттегінің отмосфералық қысымында коррозияға ұшырайды. Термодинамика процесінің жүру мүмкіндігін көрсетеді, оның қандай жылдамдықпен жүруін айтпайды.
Химиялық коррозияның кинетикасы химиялық коррозияның жылдамдығына көп факторлар әсер етеді.Қабыршақ бетінің тутастығы,қорғау қасйеттерімен және оны сызаттармен тотығу жылдамдығы анықталады. Коррозия өнімдерінің қабыршағы сынғыш және сызымдылығы аз. Қабыршақта сызықтың пайда болуы коррозия өнімлерінің металдырмен метал көлемдерінің арақатынасына байланысты. Vок/Vме=Mdme/(ndмеA), Мұнда Vок-окситің көлемі; Vме-металдың көлемі ; M-окситтің молярлық массасы; dme-металдың тығыздығы; n-окситтің молекуласындағы металдың атом саны; A-Металдың атомдық массасы.Егер Vок/Vме<1 корозиядан қорғамайды.Қабыршақтың өсу жылдамдығы уақытқа тәуелді.Егер Vок/Vме>1 түзілген қабыршақ тұтас металды коррозиядан қорғайды.
39. Металдардың физика-химиялық қасиеттері. Металдарды алудың негізгі әдістері Металдардың жалпы қасиеттеріне кристалл торларының ерекше құрылысы себепші болады. Металдардың барлығына тән қасиет - металдық жылтыр. Металдар сондай- ақ радиотолқынын да шағылыстыра алады. Металдар- электр мен жылуды жақсы өткізгіштер.Металдардың электрөткізгіштігі мен жылу өткізгіштігі Hg–нан Ag-ға қарай артады: Hg ,Pb,Fe,Zn,Mg.Al,Au,Cu,Ag Мыс пен алюминий электрді жақсы өткізетін металдар болғандықтан, оларды электрөткізгіштер ретінде пайдаланады.Металдар атомдарының химиялық реакция кезінде валенттік электрондар беріп, оң зарядты ионға айналуы олардың ең жалпы химиялық қасиеті болып табылады, яғни металдар реакция кезінде тотықсыздандырғыш болып келеді. Металдр электртерістігі күшті галогендермен, оттегімен, күкіртпен қуаттырақ әрекеттеседі. Бұл реакцияларда сәйкес келетін бейметалдар тотықтырғыш болып табылады. Металдар, сондай- ақ сутегі иондарымен де, басқа металдар иондарымен де тотыға алады.Li, K, Ca, Na, Al, Zn, Cr, Fe, Ni, Sn, Pb, H, Cu, Ag, Pt, Au
Бұл қатар металдар кернеуінің электрохимиялық қатары деп аталады. Мұндай қатардағы ең актив элемент литий екен.Кернеудің электрохимиялық қатарындағы солға қарай тұрған металл оңға қарай орналасқан металл тұзының ерітіндіснен немесе балқымасынан металды ығыстырып шығара алады.Кернеудің электрохимиялық қатарына сондай -ақ сутегі де енеді. Бұл металдардың қайсысы қышқыл ерітіндісінің сутегіні ығыстыра алатынына қорытындыжасауға мүмкіндік береді. Металдады алу әдістеріАктивтігі жоғары металдар (Na,K, Ca, Mg) электролиз әдісімен алынады. Активігі аз металдарды оладың оксидінен көмірмен, көміртегі оксидімен неме алюминий оксидімен тотықсыздандырады, ал металл сульфидтерін алдымен өртейді.
