
- •2. Бейорг-қ қосылыстардың негізгі кластары: қышқылдар, негіздер, тұздар, оксидтер.
- •3. Менделеевтің периодтық заңы мен элементтердің периодтық жүйесі,оның құрылымы.
- •4. Атом құрылысының квант-механикалық моделі.
- •6. Орбитальдарды элетрондармен толтыру реті. Энергияның кішірею принципі. Паули принципі. Хунд ережесі. Клечковский ережесі.
- •7. Энергетикалық денгейлермен денгейшелердін сиымдылығы. Атомдардын электрон қауыздарынын құрлысы. Периодтық жүйенің атом құрлысымен байланысы.
- •8. Периодтық жүйе бойынша элементтердің өзгеретін және өзгермейтін қасиеттері.
- •9. Иондану энергиясы, электронға тартқыштық, электртерістілік. Иондану потенциалы.
- •10. Химиялық байланыстың табиғаты. Валенттілік теориясы. Тотығу дәрежесі туралы түсінік.
- •11. Коваленттік байланыс.
- •12. П және σ байланыстар. Бай/с ұзындығы мен энергиясы
- •13. Коваленттік байланыс түзілуінің донорлы-акцепоторлы механизмі.
- •14. Иондық байланыс.
- •15. Металдық байланыс.
- •16. Сутектік байланыс. Оның түзілу механизмі.
- •17.Химиялық термодинамика.
- •24. Әр түрлі топтар мен периодтар элемент атомдарының валенттік мүмкіндіктері.
- •28. Су. Судың иондық күші, сутекті көрсеткіш.
- •30. Тұздар гидролизі. Гидролиздену дәрежесімен тұрақысы
- •40. Метал құймалары,қатты ерітінділер және интерметалдық қосылыстар.
1.
Химияның
негізгі тусінігі: атом, молекула, атомдық
ж/е молекулалық массалар, жәй ж/е күрделі
зат, химиялық эквивалент, моль.
Химия
–
ол зат жайлы, олардың құрылысы, қасиеттері
мен бірінің біріне айналуы туралы
ғылым. Химияның зерттеу нысандары:хим-қ
элемент ж\е оның қосылыстары. Атом-хим-қ
элемент-ң электрбейтарапты ең кіші
бөлшегі,ол оң заряд-н атомдық ядродан
ж/е теріс заряд-н электрон-н тұрады.
Молекула-ол
сол зат-ң химия-қ қасиеті бар,ең кіші
бөлшегі. Атомдық
масса-ол
массаның атомдық бірлігімен
өрнектелген,химиялық элемент массасының
орташа мәні. Молекулалық
масса-масса-ң
атомдық бірлігінде өрнектелген молек-ң
массасы,ол молекула құралған, барлық
атом-р масса-ң қосындысына тең. Жәй
заттар
бір элементтің атомынан түзілледі. Жәй
заттың 400 артық түрі белгілі. Ол белгілі
бір тығыз/мен, ерігіш/мен балқу ж/е
қайнау темпера/н ж/е т.б.сипат/ды. Күрделі
зат/р
молекулалары әр түрлі хим-қ элементтердің
атомдарынан тұрады. Химиялық
эквивалент-
хим/қ реак/ғы сутек атом/ң 1моль/н қосылыса
н/е сутек атом/ң сон/ма санын алмастыра
алат/н, оның сондай санын айтады.Заттың
1эквивалнетінің массасын эквиваленттік
масса д.а. Берілген тотығу-тотықсыздану
реакцияларында 1электронға,ал алмасу
реакцияларында 1протонға сәйкес келетін
нақтылы бөлшекті эквивлент д.а. Қышқыл/ң
экв/т - металл атомымен орын алмаса
алатын сутек атомының саны)
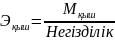 .
Негіздің экв/ті - негіз түзетін гидроксид
ионының санына н\е металл валенттілігі.
.
Негіздің экв/ті - негіз түзетін гидроксид
ионының санына н\е металл валенттілігі. .
Тұздың экв/ті - тұздың молярлық массасының
металдың атом санымен (n) металл
валенттілігі (B) көбейтіндісінің
қатынасына тең:
.
Тұздың экв/ті - тұздың молярлық массасының
металдың атом санымен (n) металл
валенттілігі (B) көбейтіндісінің
қатынасына тең:
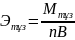 .
Оксид/ң экв/ті - оттек ж\е онымен қосылған
элемент эквиваленттерінің қосындысына
тең:
.
Оксид/ң экв/ті - оттек ж\е онымен қосылған
элемент эквиваленттерінің қосындысына
тең:
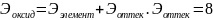 Моль-массасы
12-ге тең көміртегі атом/ң 0,012кг қанша
атом/р болатын б/са ,берілген заттың да
сонша құрылымдық бөлшегі болатын зат
мөлшері.
Моль-массасы
12-ге тең көміртегі атом/ң 0,012кг қанша
атом/р болатын б/са ,берілген заттың да
сонша құрылымдық бөлшегі болатын зат
мөлшері.
2. Бейорг-қ қосылыстардың негізгі кластары: қышқылдар, негіздер, тұздар, оксидтер.
Қышқылдар деп бір н\е бірнеше сутегі атомынан ж\е қышқыл қалдығынан тұратын күрделі зат. Ол 2 бөлінеді: оттекті: H2SO4, HNO3, оттексіз: HCl, HCN, H2S. Олар қатты (H3PO4, H3BO3, HJO4) ж\е сұйық (H2SO4, H|NO3) түрде болады.
Негіздер деп металл атомынан ж\е гидроксод тобынан тұратын күрделі зат. Ол 2 бөлінеді: суда еритін (сілтілік металдардын гидроксидтері) NaOH, LiOH, KOH, RbOH, CsOH, Ca(OH)2; ерімейтін: Cu(OH)2, Fe(OH)2, Fe(OH)3.
Тұздар деп металл атомынан ж\е қышқыл қалдығынан тұратын күрделі зат. Ол 5 бөлінеді: орташа (сутек атомдардың орнын металл атомдары толық басқан кезде түзіледі): NaCl, Al2(SO4)3; қышқылды: ( көп негізді қышқыл молекуласындағы сутек атомдарының орнын қышқыл қалдықтары басады) KHSO4, Ca(H2PO4)2; негіздік (көпқышқылды гидроксид молекуласындағы гидроксотоптың орнын қышқыл қалдығы басады): CuOHCl, Fe(OH)2SO4; қос (көпнегіздік қышқылдағы сутек атомдарының орнын екі әртүрлі металл атомдары басады): KAl(SO4)2, NaKCO3; кешенді (диссосация кезінде кешенді иондарды бөледі): Na2[Zn(OH)4],[Ag(NH3)2]Cl.
Оксидтер деп 2 элементтен тұратын ж\е оның біреуі міндетті түрде оттегі болатын күрделі зат. Ол 2-ге бөлінеді: 1) тұз түзбейтіндер: CO, SiO, N2O, NO; 2) тұз түзбейтіндер 3 бөлінеді: амфотерлік: ZnO,Al2O3,Cr2O3,MnO2,Fe2O3; қышқылдық (бейметалдардың оксиді): B2O3, N2O5, Mn2O7, негіздік (активті металдың оксиді): CuO, MgO.
3. Менделеевтің периодтық заңы мен элементтердің периодтық жүйесі,оның құрылымы.
1869ж Менделеев периодтық заңды ашты: жай заттың қасиеті, сол сияқты элементтер қосылыстарының қасиеті мен пішіні атом ядросының зарядына периодтық тәуелділікте болады. Кестеде 7 период, 8 топ бар. Период деп элементтер реттік нөмірінің өсу реті б\ша орналасқан элементтердің көлденең қатары. Кіші период 1ші – 2 элемент, 2ші, 3ші – 8 элемент; үлкен период 4ші,5ші – 18 элемент, 6шы – 32 элемент, 7ші – 21 элемент (аяқталмаған). Үлкен периодтар 2 қатардан тұрады: жұп қатарлар тек металдар ғана, тақ қатарлар металдар мен бейметалдар болады. Әрбір периодта солдан оңға қарай элементтердің металдық қасиеттері әлсіреп, бейметалдық қасиет артады. Период нөмірі – атомның энергетикалық қауызындағы энергетикалық деңгей санын білдіреді. Топ деп элементтердің тік қатары, элементтерде электрондық құрылым ұқсас болады. Негізгі топшаларға кіші ж\е үлкен периодттардың элементтері кіреді. Қосымша топшаларға үлкен периодтардың элементтері кіреді. Топтардағы элементтердің металдық қасиеттері жоғарыдан төменге қарай күшейеді, ал бейметалдық қасиет әлсірейді. Топ нөмірі қосылыстағы элемент атомының жоғары тотығу дәрежесі мен валенттік электрондар санын көрсетеді.
4. Атом құрылысының квант-механикалық моделі.
Бұл теорияның дамып, қалыптасуына барынша үлес қосқан ғалымдар: Эйнштейн, Бройль, Гейзенберг, Шредингер, Дирак. 1933ж Нильс Бор Резерфордтың моделімен Планктың теориясын қолданып, атом моделінің құрылысын жасады. Атом құрылысы квант – механикалық теориясының ережелер: 1. Электронның екі жақты табиғаты (бөлшектік–корпускулалық және толқындық) болады. Ол өзін бөлшек ретінде де, толқын ретінде де ұстай алады: бөлшек ретінде, электронның белгілі массасы мен заряды бар; мұнымен қатар қозғалыстағы электрон толқындық та қасиет көрсетеді, мәселен дифракцияға қабілеттілігімен сипатталады. 2. Электрон үшін координат пен жылдамдықты бірден, бір сәтте дәл өлшеу мүмкін емес.Жылдамдықты неғұрлым дәл өлшенген сайын,соғұрлым координатта белгісіздік болады және керісінше. 3. Атомдағы электрон белгілі траектория бойынша қозғалмайды,ядро маңындағы кеңістіктің кез келген бөлігінде бола алады,алайда оның атом кеңістігінің әртүрлі бөлігінде болу ықтималдылығы бірдей емес.
Ядро айналасындағы электронның болуының ықтималдығы ең жоғары кеңістік атомдық орбиталь д.а.
5. Электрондық бұлт туралы түсінік. Кванттық сандар.
Электронда теріс заряд болатындықтан, оның орбиталі зарядтың белгілі бір таралуын электрондық бұлт д.а. Электрон бұлты-атомдағы электронның кванттық механика тұрғысынан қарағандағы моделі. Орбиталь электрондық бұлттың формасын сипаттайды. Ядроның маңайындағы электрон бұлтының тығыздығы әртүрлі болады. Электронның болу мүмкіндігі дәлірек болатын кеңістікте электрон бұлтының тығыздығы да жоғары болады. Электрон бұлттары бір-бірінен өздерінің энергия мөлшері, пішіндері және кеңістікте орналасу бағыты арқылы ажыратылады. Э.Шредингер теңдеуі арқылы электрон қозғалысының ең маңызды сипаттамаларының бірі-оның толқындық функциясы анықталады.
Әр элементтің атомы ядро зарядымен және саны соған тең электрондармен сипатталады, ал бұл электрондар микробөлшектер болғандықтан, олардың күйін төрт квант саны өрнектейді: Бас квант саны (n)-электронның энергиясы мен орбитальдың өлшемін анықтап, энергетикалық деңгейді сипаттайтын шама. n=1,2,3...∞. Қазіргі таңда n=1,2,3...6,7 белгілі. Оның мәні жоғары болса, энергиясыда жоғары болады. Энергетикалық деңгей - бас квант санының бірдей мәні бар орбитальдардың жиынтығы. Орбитальдық квант саны (l) - энергетикалық деңгейдің деңгейшесінде орналасқан электронның энергиясын сипаттайтын ж\е электрондық бұлт пішінін анықтайтын шама. Орбитальдық моментті р ядро айналысында электронның айналу кезіндегі импульс моменті д.а. Энергетикалық деңгейше - бір энергетикалық деңгейде болатын ж\е бірдей формадағы орбитальдардың жиынтығы. l=0 шар тәрізді(s-деңгей), l=1 гантель формалы (p-деңгей). Магнит квант саны (ml) - сыртқы магнит өрісінің әсерінен орбитальдардың кеңістікте орналасуын және деңгейдегі орбиталдардың санын анықтайтын шама. –l, 0, +l бүтін сандар мәнін қабылдай алады, яғни деңгейшедегі орбитальдар саны (2l+1). Спин квант саны (ms) - электронның өз осінің айналасында айналуын сипаттап, тек қана екі мәнді қабылдай алатын шама. (+1/2 және -1/2)
