
- •ПОЛИМЕР
- •ПОЛИМЕР
- •Преимущество метода
- •метод МС не относится к спектроскопическим,
- ••Масс-спектрометр — это вакуумный прибор, использующий физические законы движения заряженных частиц в магнитных
- •БЛОК-СХЕМА МАСС-СПЕКТРОМЕТРА
- •Детектор
- •СИСТЕМА ВВОДА ПРОБЫ
- •ИОНИЗАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
- •СПОСОБЫ ИОНИЗАЦИИ
- •Химическая ионизация– более мягкий способ ионизации
- •ЭЛЕКТРОСПРЕЙ (ЭЛЕКТРОРАСПЫЛЕНИЕ)
- •ЛАЗЕРНАЯ ДЕСОРБЦИЯ
- •МАСС-АНАЛИЗАТОРЫ
- •В магнитном масс-анализаторе для разделения ионов используют однородное магнитное поле
- •КВАДРУПОЛЬНЫЙ МАСС- АНАЛИЗАТОР
- •ремяпролётный масс-анализатор
- •Схема времяпролетного масс- спектрометра
- •МАСС-СПЕКТРОМЕТР ИОН-ЦИКЛОТРОННОГО РЕЗОНАНСА
- •ВИДЫ РЕГИСТРИРУЮЩИХ УСТРОЙСТВ.
- •ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ ЗАДАЧИ, РЕШАЕМЫ МАСС- СПЕКТРОМЕТРИЕЙ
- •ОБЛАСТИ ПРИМЕНЕНИЯ МС
- •ПРИМЕНЕНИЕ МС В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- •Тохир Х.Рахимов
- •Тохир Х.Рахимов
- •Тохир Х.Рахимов
- •Тохир Х.Рахимов
- •Тохир Х.Рахимов
- •Тохир Х.Рахимов
- •1 МАСС-СПЕКТРОМЕТРИЯ
- •5По способу образования ионов (методу ионизации)
- •7На основе углеродной нанотрубки создан новый тип масс-
- •17Нагревание вещества сопровождается процессом его сублимации (переход
- •22 Определение молекулярного состава пара

17Нагревание вещества сопровождается процессом его сублимации (переход
в газовую фазу) в виде простых или ассоциированных атомов и молекул
Aкр |
t |
A |
|
|
|
|
|
|
|||
ABкр |
t |
AB |
|
||
|
(1) |
||||
Aкр |
t |
An |
|||
|
|
||||
ABкр |
t |
(AB)n |
|
||
|
|
||||
либо при температурах, достаточных для ионизации вещества на |
|||||
нагретой поверхности, реализуется второй процесс – ионная |
|||||
сублимация (термоионная эмиссия) |
|
||||
Aкр |
t |
|
|
|
|
|
A |
± |
(2) |
||
ABкр |
t |
|
|
||
A+ |
+ В |
|
|||
|
|
||||
Простые ионы, в свою очередь, могут взаимодействовать в |
|||||
поверхностном слое с молекулами конденсированной фазы, |
|||||
образуя ионные ассоциаты: |
|
||||
A± + nАВкр |
t |
|
A±(АВ)n |
(3) |
|
|
|||||
Масс–спектрометрический метод позволяет изучать как процессы (1), так и
процессы (2) и (3). Нейтральные компоненты пара исследуют методом ионизации электронами, а ионные компоненты – с использованием метода термоионной эмиссии.

18 |
Метод ионизации электронами (ИЭ) |
|
Метод ИЭ получил наибольшее распространение в ВТМС в виду его простоты.
При столкновении электронов с атомами (молекулами) пара происходят:
(а) упругие столкновения (если энергия мала), т.е. без обмена энергиями между сталкивающимися частицами
(б) неупругие столкновения т.е. с изменением внутренней энергии
|
взаимодействующих частиц. |
|
|
|
Возможны следующие процессы: |
|
|
|
|
(1) |
прямая ионизация с образованием атомарных ионов |
|
||
|
A + е A+(*) + 2е |
(4) |
|
|
(2) |
Оже – процесс |
|
|
|
|
A + е (A*)i (A+)i + 2e ... An+ + (n + 1)е |
(5) |
||
(3) |
возбуждение с последующей автоионизацией |
|
||
|
A + e A(**) + e A+(*) + 2e |
|
(6) |
|
(4) |
многократная ионизация |
|
|
|
|
A + e An+(*) + (n + 1)e |
|
(7) |
|
(5) |
прямая ионизация с образованием молекулярных ионов |
|||
|
AB + e (AB*) + e AB+(*) + 2e |
|
(8) |
|
(6) |
диссоциативная ионизация |
|
|
|
|
AB + e (AB*) + e A+(*) + B(*) + 2e |
(9) |
|
|

|
|
19 |
|
|
|
(7) |
образование ионной пары |
|
|
|
|
|||
|
• AB |
+ e (AB*) + A+ + B– + e |
(10) |
|
|
|
|
|
|
(8) |
диссоциативный захват |
|
||
|
• AB |
+ e (AB–) A–(*) + B(*) |
(11) |
|
•Для большинства соединений вероятность ионизации молекул с образованием положительных ионов, как правило, на несколько порядков выше вероятности процессов с образованием отрицательных ионов и ионных пар
Анализ процессов ионизации
•удобно вести в рамках концепции кривых потенциальной энергии и принципа Франка–Кондона
•переход осуществляется настолько быстро, так что межъядерное расстояние за время перехода не изменяется, т.е. переходы являются вертикальными
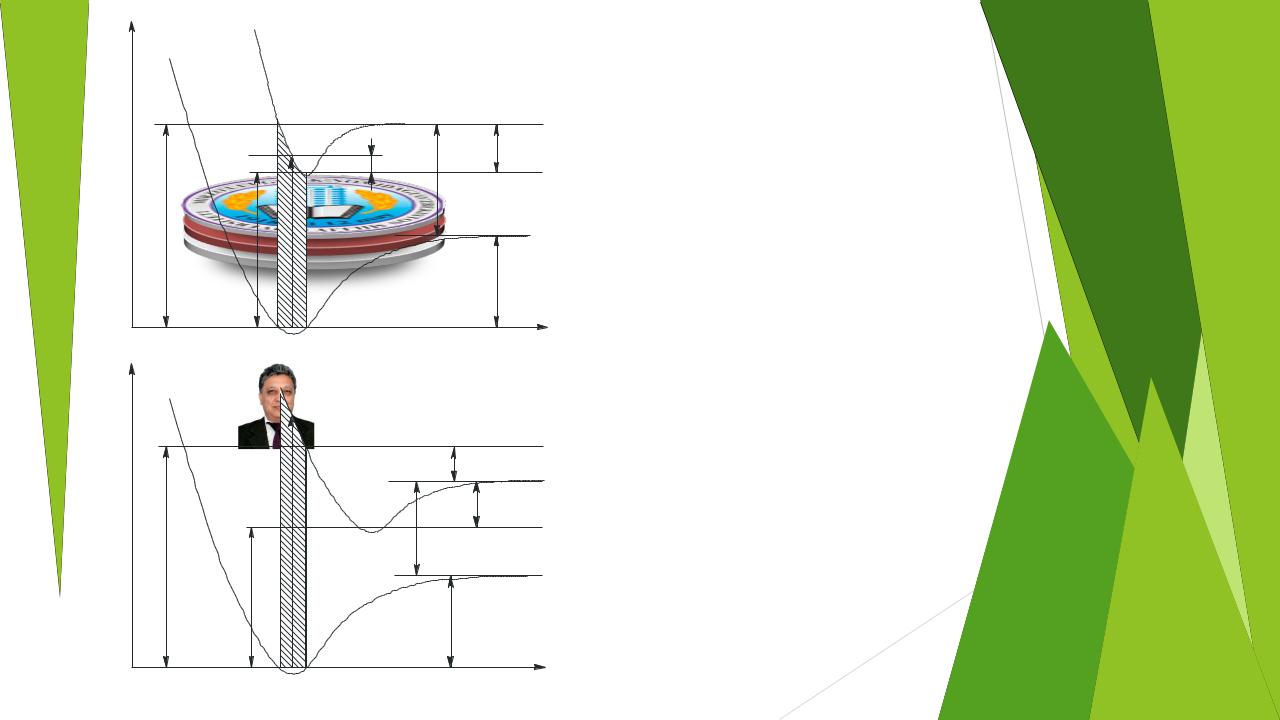
20 |
AB+ |
АE(A+/AB) = I0(A) + D(AB) (12)
АE(A+/AB) = АE(AB+) + D(AB+)
(13)
AB+ |
AB |
АE(A+/AB) = IE(A) + D(AB) + Е |
(14) |
к |
|
АE(A+/AB) = АE(AB+) + D(AB+) + Е |
(15) |
к |
|
АE(AB+) + D(AB+) = I0(A) + D(AB) (16)
АE(AB+)=D(AB+)+I0(A)+D(AB)+Eвозб+Eк (17)

21
Cлучаи с образованием иона в основном и в возбужденном состоянии по масс–спектру не различимы. Если кинетическая энергия ионов может быть измерена в масс–спектрометрическом эксперименте, то об Евозб
определенного сказать ничего нельзя. Поэтому уравнение (17) следует переписать в виде неравенства:
АE(А+/AB) D(AB) + I0(A) + Eк |
(18) |
Выражение (18) часто используют в масс–спектрометрии для расчетов величин энергий диссоциации молекул и энергий ионизации атомов и молекул. Величины АE можно получить из экспериментальных зависимостей интенсивностей ионных токов от энергии ионизирующих электронов, т.н. “кривых эффективности ионизации” (КЭИ).

22 Определение молекулярного состава пара
Для определения качественного состава пара необходимо:
•идентифицировать химические формулы ионов в масс-спектре (по измеренным массовым числам, по распределениям изотопных соотношений в пиках, по составу конденсированной фазы (если известен))
•провести соотнесение ионов их молекулярным предшественникам, т.е. провести расшифровку масс–спектра, или другими словами количественно разделить измеренные интенсивности ионных токов на
составляющие, обязанные своим происхождением различным молекулам. Для расшифровки масс–спектра могут быть использованы различные способы:
а) снижение энергии ионизирующих электронов б) изменение соотношения нейтральных частиц в молекулярном пучке
(например, изменением активности компонентов в конденсированной фазе)
в) изменение соотношений компонентов пара в ячейке Кнудсена (измерение с насыщенным и не насыщенным паром, использование двойных эффузионных ячеек)
г) анализ углового распределения ионов в) анализ форм КЭИ и энергий появления ионов
д) анализ температурных зависимостей ионных токов е) независимость констант газофазных реакций от состава
конденсированной фазы и др.

23 |
Определение парциальных давлений компонентов пара |
|
Ионный ток (I) связан с концентрацией частиц n в области ионизации соотношением:
I = σiеnl, |
(19) |
где – сечение ионизации, iе– ток ионизирующих электронов, l – длина
пути электронов, на котором происходит ионизация.
Величина n связана с концентрацией молекул внутри эффузионной ячейки
(n ) соотношением: |
|
n = n s/4pL2, |
(20) |
где L – расстояние от эффузионного отверстия до области ионизации, |
|
s – площадь эффузионного отверстия. |
|||
С учетом того, что не все образующиеся в области ионизации ионы |
|||
регистрируются (достигает коллектора только некоторая их часть a), а |
|||
также, принимая во внимание общеизвестное соотношение, |
|||
p = n kT, |
|
|
(21) |
где k – константа Больцмана, окончательно получаем |
|||
4 L2k IT |
K |
|
|
p iels |
|
IT |
(22) |
где K – константа чувствительности прибора, которая не зависит от сорта молекул и определяется только геометрией прибора и его режимом работы.

24
В том случае, когда в газовой фазе образуется несколько молекулярных форм, и имеют место процессы диссоциативной ионизации и наложения масс–спектров индивидуальных молекул, вводят индексы для обозначения вида молекулы (j) и вида иона (i).
Уравнение (22) записывается в виде:
p j |
KT |
i |
Iij |
(23) |
|
|
j |
a |
|||
|
|
|
i i |
|
|
где j – полное сечение ионизации молекул j, Iij – суммарный ионный ток
всех сортов i–х ионов из j–молекул, ai – природная распространенность i–го изотопа, i – коэффициент ионно–электронной эмиссии i–го иона
(принимают ~ 1/ M , где M – относительная молекулярная масса иона).
Сечения ионизации молекулы обычно рассчитываются по правилу аддитивности на основе сечений ионизации атомов mol = 0,75 j.

25
Метод термической ионизации
Воспользуемся известным выражением для скорости эффузии вещества
dm |
|
M |
12 |
|
dt |
Ps |
|
(24) |
|
|
||||
|
2 RT |
|
||
где dm – масса эффундирующего вещества за время dt, s – площадь эффузионного отверстия, М– относительная молекулярная масса, R – универсальная газовая постоянная, Т – термодинамическая температура. C другой стороны, скорость эффузии вещества в виде ионов связана с
ионным током соотношением: |
|
|||||||||
dm |
|
I M |
(25) |
|||||||
dt |
e |
|
N A |
|
||||||
где NA – постоянная Авогадро, е – элементарный заряд. |
||||||||||
Из (24) и (25) находим: |
1 |
|
|
|
|
|
|
|||
p |
(2 R) |
|
2 |
1 (MT )12 I |
||||||
eN A |
|
|
||||||||
|
|
|
|
|
s |
(26) |
||||

26
В формулу (26) необходимо ввести еще множитель – коэффициент потерь,
ион = |
(2 R) |
12 |
eN A |
(27) |
|
|
|
|
получаем |
|
(28) |
pi = ионIi T 1/2M1/2 |
||
представляющий собой отношение измеряемого ионного тока на коллекторе |
||
к ионному току на выходе из ячейки (при работе с ВЭУ измеряемый ионный |
||
ток необходимо скорректировать, введя поправку на коэффициент ионно– |
||
электронной эмиссии ). |
|
|
Обозначив |
|
|
С учетом изотопного соотношения уравнение (28) принимает вид |
||
p |
I T 1/ 2M 1/ 2 |
(29) |
i |
||
|
ai |
|
ион – константа, характеризующая чувствительность прибора в режиме ТЭ, |
||
которая не зависит от сорта ионов и определяется только геометрией и режимом работы прибора. Она может быть определена, например, по известным значениям констант равновесия реакций гетеролитической диссоциации, например соединения АВ, т.е. p(A+) p(B–) = K (p )2 = const.

25
