
Курсач, 2 сем
.docxРоссийский химико-технологический университет им. Д. И. Менделеева
Кафедра общей и неорганической химии
Курсовая работа:
-
Метод сравнительного расчета М.Х.Карапетьянца
-
Получение неорганических веществ
Выполнила: студентка I курса
ИМСЭН-ИФХ группы Ф-12
Харькова Софья
Проверил: Лазарев В.М.
Москва 2020
Метод сравнительного расчета М.Х.Карапетьянца
Задание
471.
Построить
график линейной зависимости y=ax+b
и на его основе, используя таким образом
один из методов сравнительного расчета
М.Х.Карапетьянца, определить удельную
теплоемкость водного одномоляльного
раствора RbCl
при 298,15 K
(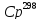 ),
если
),
если
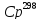 ,
кал/(г*К), водных растворов хлоридов
других щелочных металлов при m=1,000
моль/1000г
,
кал/(г*К), водных растворов хлоридов
других щелочных металлов при m=1,000
моль/1000г
 имеют следующие значения:
имеют следующие значения:
|
|
LiCl |
NaCl |
KCl |
RbCl |
CsCl |
|
|
0,9500 |
0,9347 |
0,9125 |
? |
0,8331 |
|
|
Li |
Na |
K |
Rb |
Cs |
|
Z (x) |
3 |
11 |
19 |
37 |
55 |
В
качестве аргумента x
зависимости
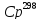 = ax
+ b
используйте порядковый номер щелочного
металла в Периодической системе
химических элементов Д.И.Менделеева.
= ax
+ b
используйте порядковый номер щелочного
металла в Периодической системе
химических элементов Д.И.Менделеева.
Решение: По методу наименьших квадратов:
y = ax + b
a
=
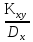
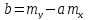
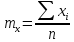 — математическое
ожидание x
— математическое
ожидание x
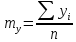 — математическое
ожидание y
— математическое
ожидание y
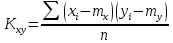

Подставляем числовые данные:
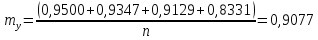
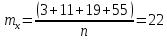
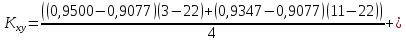
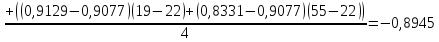
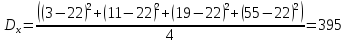
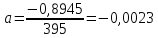
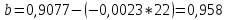
Функция
имеет вид:
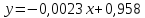
При
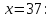
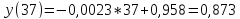
Ответ: 0,873 кал/(г*К)
Получение неорганических веществ
Задание
291: 1.
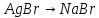
2.
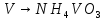
3.

№1

Бро́м— химический элемент с атомным номером 35. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы), находится в четвёртом периоде таблицы. Атомная масса элемента 79,901...79,907 а. е. м. Обозначается символом Br (от лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром при нормальных условиях является тяжёлой едкой жидкостью красно-бурого цвета с сильным неприятным «тяжёлым» запахом, отдалённо напоминающим запах одновременно йода и хлора. Летуч, ядовит. Молекула брома двухатомна (формула Br2).
Для начала необходимо выделить чистый бром:
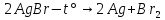
Данная реакция протекает при температуре 700°С или при комнатной температуре и под действием света (фотолитическая диссоциация). Чтобы получить бром в чистом виде и отделить его от других продуктов реакции, в данном случае необходимо нагреть колбу — бром вскипает (58,6°С) и поднимается вверх, где через насадку Вюрца пары брома попадают в холодильник Либиха, далее в круглодонную колбу. Чтобы возрастающее в установке давление её не разорвало, между холодильником и круглодонной колбой установлена еще одна насадка с боковым отводом, которая сообщается с открытой атмосферой. Спустя время на стенках холодильника происходит конденсация паров брома, и образование капель чистого брома, который затем стекает в круглодонную колбу. Приготовим бромную воду. Пару капель жидкого брома добавим в стакан с водой — через некоторое время часть брома растворится.
Бром, более активный, чем йод, вытесняет его из соединения. Йод осаждается, так как практически нерастворим в воде, и его плотность гораздо выше.
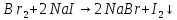
№2
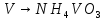
Вана́дий — химический элемент с атомным номером 23. Принадлежит к 5-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к побочной подгруппе V группы), находится в четвёртом периоде таблицы. Атомная масса элемента 50,9415(1) а. е. м. Обозначается символом V (от лат. Vanadium). Простое вещество ванадий — это пластичный металл серебристо-серого цвета. В промышленности при получении ванадия из железных руд с его примесью сначала готовят концентрат, в котором содержание ванадия достигает 8—16 %. Далее окислительной обработкой ванадий переводят в высшую степень окисления +5 и отделяют легко растворимый в воде ванадат натрия NaVO3. При подкислении раствора серной кислотой выпадает осадок, который после высушивания содержит более 90 % ванадия.
Для
начала проводим реакцию взаимодействия
ванадия и тетраоксида диазота (
(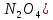 для получения ванадия(V) нитрат-диоксид.
Стружку электролитически чистого
ванадия вводят в 75-100 мл тетраокиси азота
в охлажденной до 0-5
для получения ванадия(V) нитрат-диоксид.
Стружку электролитически чистого
ванадия вводят в 75-100 мл тетраокиси азота
в охлажденной до 0-5 колбе. При добавлении 5-8 мл ацетонитрила
(
колбе. При добавлении 5-8 мл ацетонитрила
(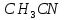 )
начинается реакция, образуется
кирпично-красный осадок. Реакционную
смесь оставляют на 5-6 часов, после чего
в вакууме отгоняют четырехокись азота
и ацетонитрил.
)
начинается реакция, образуется
кирпично-красный осадок. Реакционную
смесь оставляют на 5-6 часов, после чего
в вакууме отгоняют четырехокись азота
и ацетонитрил.
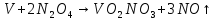
Затем проводим реакцию с аммиачной водой. Выпавший осадок NH4VO3 отсасывают на воронке Бюхнера, промывают 300 мл воды и небольшим количеством этилового спирта и сушат при температуре не выше 20— 25 °С.
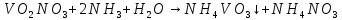
№3
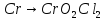
Хро́м — элемент 6-й группы (по устаревшей классификации — побочной подгруппы 6-й группы) 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром — твёрдый металл голубовато-белого цвета. Хром имеет твёрдость по шкале Мооса 8.5, один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке. Хром иногда относят к чёрным металлам. Он является довольно распространённым элементом в земной коре (0,03 % по массе). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Для начала проведем реакцию взаимодействия хрома и кислорода с образованием оксида хрома(III). Реакция протекает при температуре около 600°C, протекает медленно.
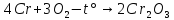
Затем следует реакция окисления оксида хрома (III) калия хлоратом, реакция происходит при температуре 500-700 градусов. Хромат калия из смеси можно получить выпариванием, и последующей очисткой.
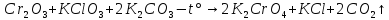
Последним
этапом является реакция получения
диоксид-дихлорида хрома(VI).
В глиняном тигле при не слишком высокой
температуре сплавляют хромат калия ( .
Расплав выливают на железную пластинку
и после остывания разбивают на крупные
куски, помещают их в 2-литровую колбу со
шлифом и заливают 100%-ной
.
Расплав выливают на железную пластинку
и после остывания разбивают на крупные
куски, помещают их в 2-литровую колбу со
шлифом и заливают 100%-ной
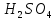 .
Сразу же присоединяют холодильник, на
выходе которого устанавливают колбу
со щлифом и газоотводную трубку. По мере
того как реакция замедляется, реакционную
смесь осторожно нагревают, пока выделение
.
Сразу же присоединяют холодильник, на
выходе которого устанавливают колбу
со щлифом и газоотводную трубку. По мере
того как реакция замедляется, реакционную
смесь осторожно нагревают, пока выделение
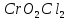 полностью не прекратится. Продукт
очищают путём повторной перегонки.
Чистый
полностью не прекратится. Продукт
очищают путём повторной перегонки.
Чистый
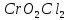 собирают в сухие ампулы, которые затем
запаивают.
собирают в сухие ампулы, которые затем
запаивают.
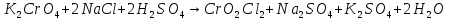

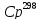 (y)
(y)