
- •Медико-биологический факультет
- •Оглавление
- •1.Введение
- •2.Материалы и методы
- •2.2Методы
- •2.2.1 Выделение днк из лейкоцитов периферической крови методом высаливания
- •2.2.2 Выделение днк из лейкоцитов периферической крови при помощи AxyPrep Blood Genomic dna Miniprep Kit.
- •2.2.3 Полимеразная цепная реакция (пцр)
- •2.2.4 Электрофорез пцр-продуктов в 1,5% агарозном геле.
- •2.2.5 Очистка пцр продукта.
- •2.2.6 Секвенирование.
- •2.2.7. Пцр в реальном времени.
- •3.Результаты и обсуждение
- •4.Выводы
- •5. Список литературы
3.Результаты и обсуждение
Для диагностики использовали периферическая кровь пациента. После выделения ДНК из крови (раздел 2.2.2) была проведена ПЦР (раздел 2.2.3). Ген FKTN состоит из 10 экзонов, каждый из которых анализировали отдельно. После проведения ПЦР и постановки электрофореза (рис. 8) были выбраны пробы, которые давали достаточно сильный и чистый сигнал. На втором этапе эти пробы были очищены от остатков праймеров и dNTP (раздел 2.2.5). Далее было проведено сиквенирование экзонов (раздел 2.2.6). Был проведен анализ данных секвенирования при помощи программ LaserGene и Chromas pro. Этот анализ не выявил мутаций в экзонах (рис. 9).

5
7
10
10
1
2
4
6
9
8
3
Рисунок 8. Пример ПЦР.1 – первый экзон, 2 – второй экзон, 3 – третий экзон, 4 – четвертый экзон, 5 – пятый экзон, 6 – шестой экзон, 7 – седьмой экзон, 8 – девятый экзон, 9 – десятый экзон, 10- маркер молекулярного веса (леддер)
В публикациях отмечена относительная редкость мутаций в экзонах, в тоже время была отмечено достаточная частота инсерции ретранспозона в 3’ нетранслируемую область. Для определения инсерции в 3’ нетранслируемой области был использован метод Real time PCR (раздел 2.2.7).

Рисунок 9. Примеры секвенирования экзонов. Римскими цифрами обозначен номер экзона. Мутаций ни в одном не обнаружено.
Для статистической достоверности было взято 6 одинаковых ПЦР миксов. Пробы были сделаны по стандартной прописи (таблица 4). Первая группа из 6 проб содержала ДНК больного и праймеры на транспозон, аналогично сделана группа с ДНК здорового человека, вторая группа проб содержала ДНК больного и праймеры на контрольный ген SALL4 (его копийность известна), аналогичная группа и для ДНК здорового человека.
В результате проведения ПЦР в реальном времени получили ряд данных, которые обработали с помощью программы CFX Manager 1000 (рисунок 10). Значение С(t) было занесено в Microsoft Excel, где использовали формулу для сравнения экспрессии ДНК:
Xtest/Xcontrol = 2ddC(t) , где
Xtest - содержание тестируемого фрагмента у больного
Xcontrol – содержание фрагмента у здорового
ddC(t) = dC(t) здорового - dC(t) больного
dC(t) здорового = С(t)с праймерами для транспозона здорового - С(t)с праймерами для контрольного гена здорового
dC(t) больного = С(t)с праймерами для транспозона больного - С(t)с праймерами для контрольного гена больного

Рисунок 10. Окно программы CFX manager. Цифрой 1 обозначено поле, на котором размещен график зависимости флуоресценции от номера цикла, цифрой 2 обозначено зона выбора пробирки с образцами, цифрой 3 – зона данных, в частности в ней обозначено значение с(t)
1)
2)
3)
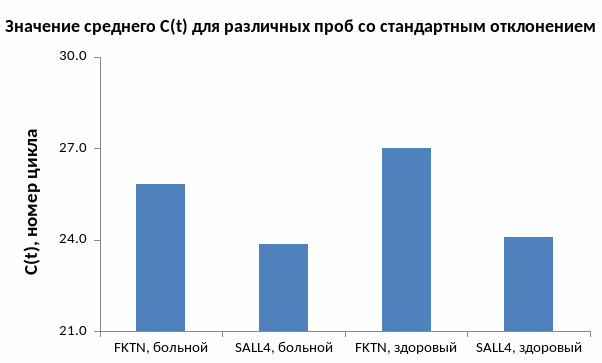
Подтвердили статистически приемлемый характер распределения значений С(t) среди одинаковых проб (рисунок 11). Также было проведено сравнение между разбросом С(t) с испольщванием праймеров для контрольного гена SALL4 у больного и у здорового с использованием критерия Стьюдента, аналогично для проб с праймерами на транспозон. Статистическая обработка показала, что с только доверительной вероятностью 0,8 пробы с праймерами для контрольного гена SALL4 у здорового и больного человека будут различны и находиться в разных совокупностях. В тоже время пробы с праймерами для транспозона у больного и здорового человека с уровнем значимости 0,999 имеет различия (что собственно и ожидалось).
О
Рисунок 11. Значение среднего С(t) для различных проб со стандартным отклонением.
 днако
результаты эксперимента могли быть
неверно трактованы по причине неодинаковой
эффективности амплификации ДНК. Для
подтверждения одинаковой эффективности
амплификации был проведен эксперимент
с серией разведения ДНК. Материал
пациента и больного была разведена в
4, 16, 64 и 256 раз соответственно, после чего
была поставлена ПЦР реакция в реальном
времени по стандартной прописи (таблица
4) и стандартной программой амплификации
(таблица 5). В результате эксперимента
получились характерные кривые
флуоресценции (рисунок 12). В программе
CFX manager была
построен точечный график зависимости
значения С(t) от десятичного
логарифма концентрации (разбавления)
ДНК. Построив линию тренда (линейное
приближение), мы нашли ее формулу –
y=ax+b.
Эффективность находилась по соотношению:
днако
результаты эксперимента могли быть
неверно трактованы по причине неодинаковой
эффективности амплификации ДНК. Для
подтверждения одинаковой эффективности
амплификации был проведен эксперимент
с серией разведения ДНК. Материал
пациента и больного была разведена в
4, 16, 64 и 256 раз соответственно, после чего
была поставлена ПЦР реакция в реальном
времени по стандартной прописи (таблица
4) и стандартной программой амплификации
(таблица 5). В результате эксперимента
получились характерные кривые
флуоресценции (рисунок 12). В программе
CFX manager была
построен точечный график зависимости
значения С(t) от десятичного
логарифма концентрации (разбавления)
ДНК. Построив линию тренда (линейное
приближение), мы нашли ее формулу –
y=ax+b.
Эффективность находилась по соотношению:
E = 101/a , где
Е- эффективность амплификации
а- коэффициент линии тренда

Рисунок 12. Окно программы CFX manager. Цифрой 1 обозначено поле, на котором размещен график зависимости флуоресценции от номера цикла, цифрой 2 обозначено зона выбора пробирки с образцами, цифрой 3 – зона данных, в частности в ней обозначено значение с(t), цифрой 4 обозначено окно построения графика зависимости С(t) от log10(концентрация образца).
1)
2)
3)
4)
В результате обсчетов было обнаружено, что эффективность амплификации у больного примерно такая же, даже несколько меньше, чем у здорового человека. Это говорит о том, что наши данные о наличии перемещения транспозона верны не только статистически.
Таким образом, можно с уверенностью говорить о том, что пациент страдает синдромом Фукуямы.
