
- •Методичні вказівки
- •«Розрахунок хімічних рівноваг в шлако-металічних системах»
- •Загальна характеристика рівноваги хімічних реакцій в металургійних агрегатах
- •2. Розрахунки активностей елементів в залізі
- •3. Розрахунки активностей компонентів шлаку
- •4. Загальна методика розрахунку констант рівноваги в системі шлак – метал
- •5. Розрахунки рівноваги реакцій взаємодії елементів з киснем, розчиненим в металі
- •5.1. Вуглець
- •6. Реакція між елементами, розчиненими в металі і оксидами заліза шлаку (FeO)
- •7. Розрахунок відхилення реакцій від рівноваги
- •Література
Мінестерство освіти і науки України
Криворізький металургійний інститут
ДВНЗ «Криворізький національний університет»
Кафедра металургійних технологій
Методичні вказівки
до виконання курсової роботи
«Розрахунок хімічних рівноваг в шлако-металічних системах»
для студентів які навчаються за напрямом 6.050401« Металургія»
професійного спрямування « Металургія сталі»
Кривий Ріг
2014 р.
Пастушенко З.З. Методичні вказівки до виконання курсової роботи «Розрахунок хімічних рівноваг в шлако-металічних системах» для студентів які навчаються за напрямом 6.050401« Металургія» професійного спрямування « Металургія сталі» – Кривий Ріг. - 2014.- 27с.
Методичні вказівки вміщують розрахунки по термодинаміці рівноваги реакцій в системі шлак-метал ; включають теоретичну частину, яка відноситься до змісту навчальної дисципліни, задачі і приклади розрахунків рівноважних і нерівноважних станів системи метал-шлак.
Мета – допомогти студентам в засвоєнні основних теоретичних положень курсу і методів розрахунку рівновагих концентрацій елементів в металі і ухилення реакції від рівноваги в процесах окислення і відновлення.
Укладач доц., к.т.н. Пастушенко З.З.
Рецензент проф., д.т.н. Лялюк В.П.
Розглянуто та затверджено на засіданні кафедри металургійних технологій
«27» серпня 2014 р., протокол №1.
Загальна характеристика рівноваги хімічних реакцій в металургійних агрегатах
В
якості однієї з характеристик рівновагого
стану термодинамічної системи з хімічними
реакціями використовується константа
рівноваги, яка висловлюється через
закон діючих сумішей і визначає рівновагий
стан системи. Для
чисто газових реакцій
закон діючих
сумішей
записується
через парціальний
тиск
продуктів
реакції
і
вихідних
речовин. Так, вираз
константи рівноваги
для реакцій
![]() має
вигляд
має
вигляд
![]()
![]() .
.
У випадку ідеальних розчинів парціальні тиски заміщуються концентраціями
![]() .
.
Для реальних розчинів, замість концентрацій реагуючих речовин і продуктів реакції записують їх активності, які представляють собою, так звані «вільні концентрації».
![]() .
.
Величина
активності
залежить
від вибору
стандартного стану,
визначеного початком
відрахунку
для концентрації.
Для розчинів
застосовуються
два основних
стандартних
стани
: чиста
речовина
і
розбавленний
розчин.
В першому
випадку
концентрації
висловлюються
в мольних
долях і
позначаються
через
![]() ,
для чистої
речовини
,
для чистої
речовини
![]() . В другому випадку за початок відрахунку
приймаєтся 1% розчин, його концентрація
висловлюється через С, % . Активність
речовини в розчині рівна помноженню
його концентрації на коефіціент
активності.
. В другому випадку за початок відрахунку
приймаєтся 1% розчин, його концентрація
висловлюється через С, % . Активність
речовини в розчині рівна помноженню
його концентрації на коефіціент
активності.
В
залежності від обраного стандартного
стану прийняті наступні вирази для
активності : при стандартному стані
„чиста речовина”
![]() , при стандартному стані „розбавлений
розчин” -
, при стандартному стані „розбавлений
розчин” -
![]() (
(![]() і
і
![]() - коефіціенти активності). Для чистої
речовини в першому випадку
- коефіціенти активності). Для чистої
речовини в першому випадку
![]() В металургії для запису реакцій і
констант рівноваги прийнято розчин
елементу в залізі брати в квадратні
дужки, наприклад, [Mn],
речовини
в шлаці
в круглі,
наприклад,
(SіО2).
Гази беруть в фігурні дужки або
супроводжують індексом „г” або „газ”
– { CO},
COг
,
COгаз
.
При гетерогенних реакціях з участю
газів запис реакції і вираз константи
її рівноваги будуть мати вигляд
В металургії для запису реакцій і
констант рівноваги прийнято розчин
елементу в залізі брати в квадратні
дужки, наприклад, [Mn],
речовини
в шлаці
в круглі,
наприклад,
(SіО2).
Гази беруть в фігурні дужки або
супроводжують індексом „г” або „газ”
– { CO},
COг
,
COгаз
.
При гетерогенних реакціях з участю
газів запис реакції і вираз константи
її рівноваги будуть мати вигляд
![]()
![]() .
.
У багатьох випадках при розрахунках металургійних процесів розв'язується задача визначення рівновагого стану реакцій, протікаючих тільки в металі з утворенням нової фази, і на кордоні метал-шлак. У багатьох випадках к першим відносяться реакції взаємодії з киснем, розчиненим в металі, в вругому – реакції обміну між металом і шлаком.
Реакції взаємодії речовин в об'ємі металу (а це, в першу чергу, реакції окислення домішок розчиненим в металі киснем і розкислення) можуть не протікати з утворенням як чистих речовин, так і складних оксидних розплавів. У випадку протікання їх на кордоні метал-шлак, з домішками взаємодіє шлакова фаза відомого складу.
При виникненні конденсованої нової фази в реакції між домішками, розчиненими в залізі, і киснем завжди бере участь і залізо. Але доля оксидів заліза в складі конденсованої фази відносно невелика і в більшості розрахунків в якості продукту реакції може бути прийнятий оксид окислюючої домішки. При цьому реакції окислення при температурах сталеплавильних процесів можуть бути описані рівняннями
![]() тв
,
(A)
тв
,
(A)
![]() тв
,
(Б)
тв
,
(Б)
![]() тв
, (B)
тв
, (B)
Вирази для константи рівноваги цих реакцій будуть мати вигляд (активності чистих конденсованих речовин рівні одиниці)
![]() ,
(1)
,
(1)
![]() ,
(2)
,
(2)
![]() ,
(3)
,
(3)
Якщо в ході реакцій утворяться комплексні продукти розкислення, які знаходяться в рідкому станні або реакція окислення киснем протікає на кордоні шлак-метал і оксид, який утворився розчинений в шлаці, то згадані реакції записуються рівняннями :
, (Г)
, (Д)
. (Е)
Вирази для констант рівноваги будуть :
![]() ,
(4)
,
(4)
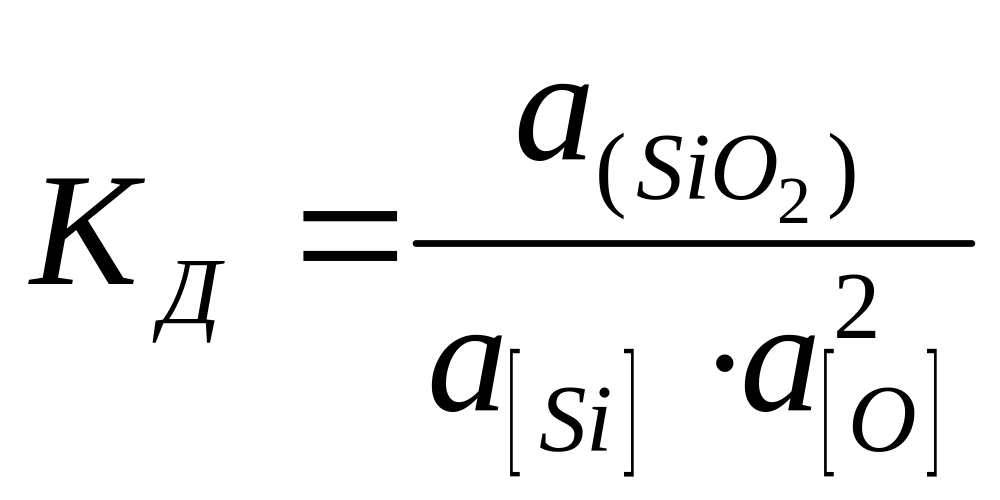 ,
(5)
,
(5)
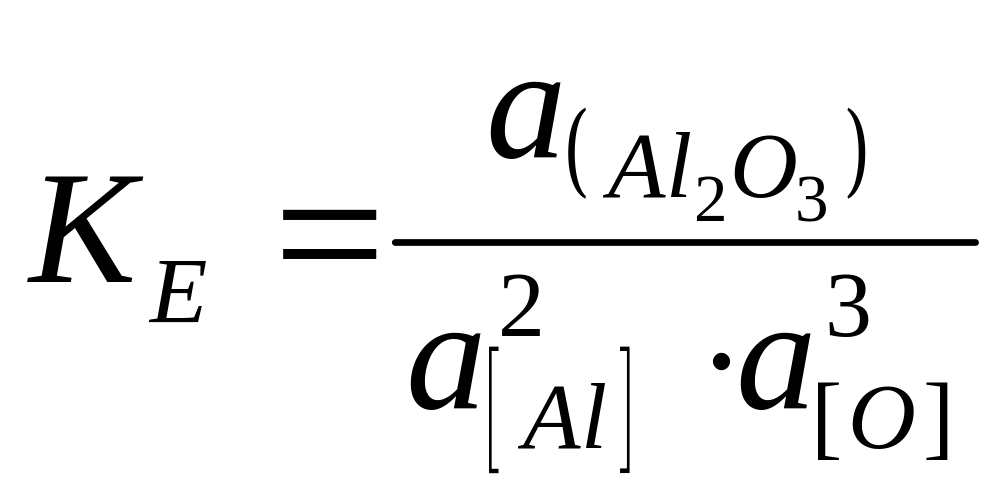 ,
(6)
,
(6)
Декілька відмінна по своєму характеру реакція окислення вуглецю, так як в якості її продукту утворюється газ – монооксид вуглецю
![]() ,
(Ж)
,
(Ж)
і вираз для константи рівноваги буде
![]() ,
(7)
,
(7)
При протіканні реакцій окислення на кордоні метал-шлак окислювачем є оксид заліза – FeO, і рівняння реакцій можуть бути записані як
![]() ,
(З)
,
(З)
![]() ,
(І)
,
(І)
![]() (К)
(К)
![]() .
(Л)
.
(Л)
В загальному вигляді константи рівноваги для такого запису реакцій будуть мати вигляд
![]() ,
(8)
,
(8)
![]() ,
(9)
,
(9)
 ,
(10)
,
(10)
 ,
(11)
,
(11)
При розрахунках рівноваги реакцій (3) – (Л) найбільшу складність представляє розрахунок як активностей елементів в металі, так і активностей компонентів шлаку. Для більшості приведених реакцій константи рівноваги отримані експериментальним шляхом і вирази для їх розрахунку залежать від вибору авторами модельних уявлень про механізм взаємодії структурних часток в розплавах. При докладі розрахунків рівноваги окремих реакцій будуть необхідні дані рекомендації про вибір моделі для розрахунку активностей.
При
відносно
невеликому
вмісту
домішок
в розплавах
заліза
(до 6-10%), до
яких
відносяться більшість
марок сталей і
чавунів,
прийнято
рахувати,
що
активність
заліза
в металургійному
розплаві
дорівнює
одиниці
![]() ,
а розрахунки
активностей виконувати
по параметрам взаємодії
(параметрам Вагнера) [1,2,3].
,
а розрахунки
активностей виконувати
по параметрам взаємодії
(параметрам Вагнера) [1,2,3].
Для шлаків найбільш часто в розрахунках використовують модель регулярних іонних розчинів В.А. Кожеурова [3,4] і модель шлаку як фази з колективними електронами А.Г. Пономаренко [2,3].
