
- •1. Титриметрические методы анализа
- •1.1 Метод кислотно-основного титрования
- •1.1.1 Приготовление раствора тетрабората натрия
- •1.1.2 Приготовление раствора соляной кислоты
- •1.1.3 Стандартизация раствора соляной кислоты
- •1.1.4 Определение щелочи в растворе
- •1.1.5 Определение щелочи и соды при совместном присутствии
- •1.1.6 Определение карбонатной (временной) жесткости воды
- •1.1.7 Определение соляной и борной кислоты при их совместном присутствии
- •1.1.8 Вопросы для самостоятельной подготовки
- •Вопросы к коллоквиуму "Общие принципы титриметрии, кислотно-основное титрование. Потенциометрия и потенциометричес-кое титрование. Ошибки в количественном анализе"
- •1.2 Методы окислительно-восстановительного титрования
- •1.2.1 Перманганатометрический метод титрования
- •1.2.1.1. Стандартизация раствора kMnO4
- •1.2.1.2 Перманганатометрическое определение железа (II) в соли Mора
- •1.2.1.3 Перманганатометрическое определение кальция
- •1.2.1.4 Определение железа в стали
- •1.2.1.5 Перманганатометрическое определение железа в сталях
- •1.2.2 Дихроматометрическое определение железа в сталях
- •1.2.2.1 Сравнение эффективности независимых методик по определению железа в стали
- •1.2.3. Иодометрическое определение меди
- •1.2.3.2 Иодометрическое определение меди
- •1.2.3.3 Иодометрическое определение кислорода
- •1.2.3.4 Вопросы для самостоятельной подготовки
- •1.3. Метод осадительного титрования
- •1.3.1 Приготовление стандартных растворов
- •1.3.2 Определение хлорид-иона методом Мора
- •1.3.3 Определение хлорид-иона методом Фольгарда
- •1.3.4. Титриметрическое определение сульфатов солями бария с индикатором нитрохромазо
- •1.3.5 Вопросы для самостоятельной подготовки
- •1.4.1 Комплексонометрическое титрование
- •1.4.1 Определение кальция и магния при совместном присутст-вии. Определение общей жесткости воды
- •1.4.2 Вопросы для самостоятельной подготовки
1.2.1.5 Перманганатометрическое определение железа в сталях
П рисутствие
в титруемом растворе хлорид-ионов
приводит к перерас-ходу титранта и
получению нечеткого конца титрования.
Это вызвано тем, что реакция между Fe2+
и KМnO4
индуцирует реакцию
между MnO4-
и Cl
-.
Этого осложнения
не возникает, если в растворе в достаточной
концентрации присутствует соль Mn2+.
Кроме того, титрование следует проводить
в присут-ствии фосфорной кислоты,
которая дает с образующимися при реакции
тит-рования ионами трехвалентного
железа бесцветный комплекс [Fe(HPO4)2]
-,
поэтому раствор в конце титрования не
желтеет
от накопления в
нем Fe3+,
и не маскирует бледно-розовую окраску
перманганата в конце титрования.
рисутствие
в титруемом растворе хлорид-ионов
приводит к перерас-ходу титранта и
получению нечеткого конца титрования.
Это вызвано тем, что реакция между Fe2+
и KМnO4
индуцирует реакцию
между MnO4-
и Cl
-.
Этого осложнения
не возникает, если в растворе в достаточной
концентрации присутствует соль Mn2+.
Кроме того, титрование следует проводить
в присут-ствии фосфорной кислоты,
которая дает с образующимися при реакции
тит-рования ионами трехвалентного
железа бесцветный комплекс [Fe(HPO4)2]
-,
поэтому раствор в конце титрования не
желтеет
от накопления в
нем Fe3+,
и не маскирует бледно-розовую окраску
перманганата в конце титрования.
Рекомендуется перед титрованием вводить в исследуемый раствор смесь Рейнгарда-Циммермана (H2SO4, MnSO4, H3PO4). Смесь готовят следу-ющим образом: растворяют 60 г сульфата марганца в 500 мл дистиллирован-ной воды, добавляют 132 мл фосфорной кислоты (пл. 1,70), 140 мл серной кислоты (пл. 1,84) и доводят объем раствора дистиллированной водой до 1л.
Реагенты:
Калий перманганат, KМnO4, раствор с точно установленной концентрацией
Смесь Рейнгарда-Циммермана
Выполнение работы. В колбу для титрования вносят при помощи пи-петки 20.00 мл исследуемого на содержание железа раствора, добавляют 8 мл смеси Рейнгарда-Циммермана и медленно титруют при тщательном переме-шивании раствором KМnO4 до появления неисчезающей бледно-розовой ок-раски. Определение повторяют пять раз.
Рассчитывают титр перманганата по железу по формуле (7), а затем – количество железа в лезвии для каждой пробы по формуле:
![]()
Полученные данные заносят в таблицу и проводят математическую обработку результатов.
Таблица 3
Математическая обработка результатов железа (II) в сталях методами титриметрического анализа (P = 0,95, tp,n-1 = 2,78 при n = 5)
m
![]() =
=
![]()
![]()
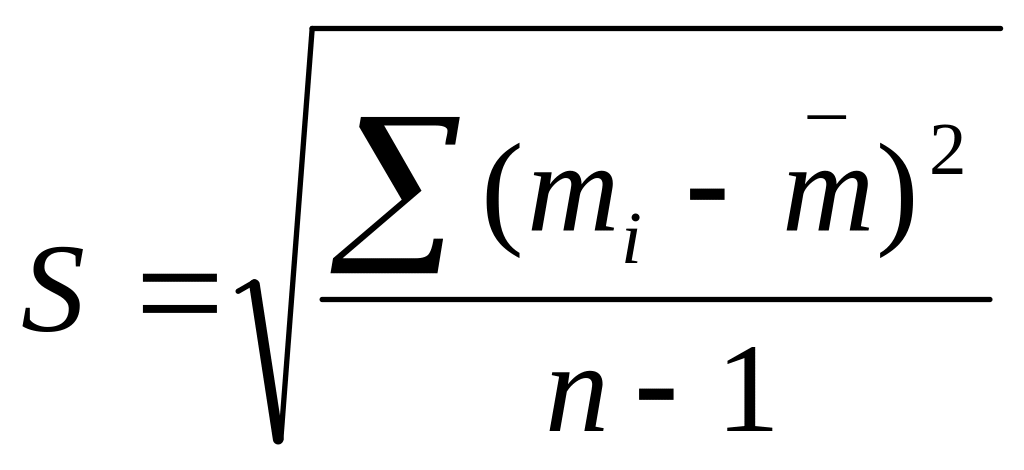
![]()
![]()
Рассчитывают процентное содержание железа в стали, используя полу-ченные значения:
mобразца - 100 %
Fe
![]() - Х
%
- Х
%
1.2.2 Дихроматометрическое определение железа в сталях
Дихромат
калия является сильным окислителем
(![]() 1,33
В) в кислой среде и используется для
прямого определения железа (II).
Раствор дихромата калия удовлетворяет
требованиям, предъявляемым к первичным
стандартным растворам. Его можно
приготовить по навеске или из фикса-нала.
В основе определения лежит реакция:
1,33
В) в кислой среде и используется для
прямого определения железа (II).
Раствор дихромата калия удовлетворяет
требованиям, предъявляемым к первичным
стандартным растворам. Его можно
приготовить по навеске или из фикса-нала.
В основе определения лежит реакция:
6Fe2+
+ Cr2O72-
+ 14H+
![]() 6Fe3+
+ 2Cr3+
+ 7H2O
6Fe3+
+ 2Cr3+
+ 7H2O
Конечную точку титрования фиксируют при помощи индикатора дифе-ниламина. Для точного определения необходимо создавать высокую кислот-ность раствора. С этой целью в раствор добавляют серную кислоту, а также связывают образующиеся по реакции ионы Fe3+ в комплексные соединения:
Fe3+ + H3PO4 [FeH2PO4]2+ + H+
что понижает окислительно-восстановительный потенциал этой редокс-пары. Только при этом условии перемена окраски индикатора происходит в преде-лах скачка потенциала на кривой титрования.
Реагенты:
Калий дихромат, K2Cr2O7, 0,0500 М раствор.
Защитная смесь, H2SO4 + H3PO4
Индикатор – дифениламин, 1%-ный раствор в концентрированной серной кислоте.
Выполнение работы. Отмеряют пипеткой 10 мл приготовленного рас-твора соли железа и переносят в колбу для титрования. К раствору добавля-ют защитной смеси, 2 капли индикатора и титруют по каплям из бюретки дихроматом калия до появления сине-фиолетовой окраски. Рекомендуется сначала установить нужный объем дихромата калия с точностью до 1 мл и таким образом определить примерный конец реакции, а затем повторить опыт и в конце титрование проводить медленно с интервалами между кап-лями 30 с. Содержимое колбы при этом необходимо тщательно перемеши-вать, Следует провести не менее пяти параллельных определений, каждый раз фиксируя объем дихромата калия в конце титрования.
Рассчитывают титр дихромата калия по железу по формуле (7) и коли-чество железа в лезвии для каждой пробы:
![]()
Полученные данные заносят в таблицу (4) и проводят математичес-кую обработку результатов анализа.
Рассчитывают процентное содержание железа в образце стали, ис-пользуя полученные значения.
