
- •1. Титриметрические методы анализа
- •1.1 Метод кислотно-основного титрования
- •1.1.1 Приготовление раствора тетрабората натрия
- •1.1.2 Приготовление раствора соляной кислоты
- •1.1.3 Стандартизация раствора соляной кислоты
- •1.1.4 Определение щелочи в растворе
- •1.1.5 Определение щелочи и соды при совместном присутствии
- •1.1.6 Определение карбонатной (временной) жесткости воды
- •1.1.7 Определение соляной и борной кислоты при их совместном присутствии
- •1.1.8 Вопросы для самостоятельной подготовки
- •Вопросы к коллоквиуму "Общие принципы титриметрии, кислотно-основное титрование. Потенциометрия и потенциометричес-кое титрование. Ошибки в количественном анализе"
- •1.2 Методы окислительно-восстановительного титрования
- •1.2.1 Перманганатометрический метод титрования
- •1.2.1.1. Стандартизация раствора kMnO4
- •1.2.1.2 Перманганатометрическое определение железа (II) в соли Mора
- •1.2.1.3 Перманганатометрическое определение кальция
- •1.2.1.4 Определение железа в стали
- •1.2.1.5 Перманганатометрическое определение железа в сталях
- •1.2.2 Дихроматометрическое определение железа в сталях
- •1.2.2.1 Сравнение эффективности независимых методик по определению железа в стали
- •1.2.3. Иодометрическое определение меди
- •1.2.3.2 Иодометрическое определение меди
- •1.2.3.3 Иодометрическое определение кислорода
- •1.2.3.4 Вопросы для самостоятельной подготовки
- •1.3. Метод осадительного титрования
- •1.3.1 Приготовление стандартных растворов
- •1.3.2 Определение хлорид-иона методом Мора
- •1.3.3 Определение хлорид-иона методом Фольгарда
- •1.3.4. Титриметрическое определение сульфатов солями бария с индикатором нитрохромазо
- •1.3.5 Вопросы для самостоятельной подготовки
- •1.4.1 Комплексонометрическое титрование
- •1.4.1 Определение кальция и магния при совместном присутст-вии. Определение общей жесткости воды
- •1.4.2 Вопросы для самостоятельной подготовки
1.1.3 Стандартизация раствора соляной кислоты
Реагенты:
Соляная кислота, НСl, примерно 0,1н. раствор
Натрий тетраборат, Na2B4O7 .10H2O, раствор с точно установленной концентрацией
Индикатор метиловый оранжевый, 0,1%-ный раствор
Выполнение работы. В коническую колбу на 250 мл переносят пипет-кой 10 мл приготовленного раствора буры, 2-3 капли индикатора метилового оранжевого, разбавляют раствор небольшим количеством дистиллированной воды ( 10 мл) и титруют раствором приготовленной кислоты до перехода окраски из желтой в розовую, которая появляется от одной капли титранта. Титрование повторяют не менее трех раз, определяют Vср и рассчитывают концентрацию соляной кислоты
![]()
1.1.4 Определение щелочи в растворе
Реагенты:
1. Соляная кислота, НСl, раствор с точно установленной
концентрацией
Индикатор метиловый оранжевый, 0,1%-ный водный раствор
Выполнение работы. В коническую колбу, содержащую раствор ще-лочи, прибавляют 2-3 капли индикатора метилового оранжевого, титруют раствором соляной кислоты, которую наливают в бюретку, до перехода ок-раски раствора из желтой в розовую. Для титрования щелочи можно исполь-зовать индикатор фенолфталеин – в этом случае титруют кислотой до обес-цвечивания раствора. Расчет проводят по формуле :
![]() .
.
1.1.5 Определение щелочи и соды при совместном присутствии
Метод основан на фиксировании двух точек эквивалентности при тит-ровании сначала с индикатором фенолфталеином (титруется вся щелочь и половина соды) и с индикатором метиловым оранжевым (титруется полови-на соды).
Реагенты:
Соляная кислота, НСl, раствор с точно установленной концентрацией
Индикатор метиловый оранжевый, 0,1%-ный водный раствор
Индикатор фенолфталеин, 0,1%-ный спиртовый раствор
Выполнение работы. К анализируемой смеси щелочи и соды прибав-ляют 8-10 капель 0,1 %-ного раствора фенолфталеина и оттитровывают стан-
д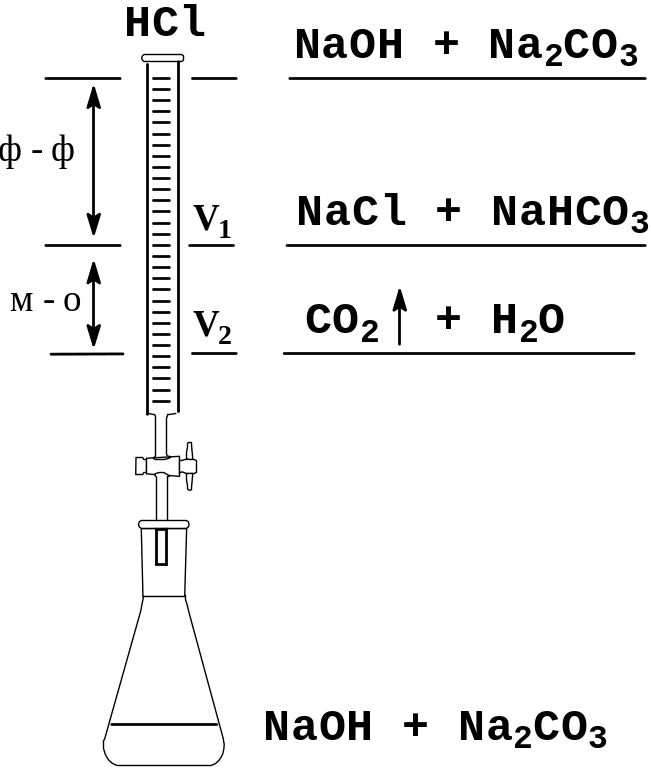 артным
раствором соляной кислоты до исчезновения
малиновой окраски раст-вора от одной
капли. Записывают пока-зание бюретки
(V1).
Прибавляют к этому раствору 2 капли
метилового оранжево-го (при этом раствор
окрасится в желтый цвет) и продолжают
титрование до пере-хода окраски раствора
от желтой к розо-вой. Снова делают отсчет
показания бю-ретки (V2).
В соответствии со схемой на титрование
соды до NaHCO3
пойдет
артным
раствором соляной кислоты до исчезновения
малиновой окраски раст-вора от одной
капли. Записывают пока-зание бюретки
(V1).
Прибавляют к этому раствору 2 капли
метилового оранжево-го (при этом раствор
окрасится в желтый цвет) и продолжают
титрование до пере-хода окраски раствора
от желтой к розо-вой. Снова делают отсчет
показания бю-ретки (V2).
В соответствии со схемой на титрование
соды до NaHCO3
пойдет
V2 – V1 мл раствора HCl, а на титрование соды до угольной кислоты –
2(V2
-V1)
мл. Значит,
на титрование щелочи будет затрачено
V2
- 2(V2
-V1)
мл кислоты.
Определив объемы кислоты, которые
пойдут на титрование соды и щелочи,
можно рассчитать количества анализируемых
веществ по формуле (6), принимая во
внимание, что
![]() ,
а
,
а
![]() .
.
1.1.6 Определение карбонатной (временной) жесткости воды
Карбонатная (временная) жесткость воды (ВЖВ) обусловлена присут-ствием в растворе бикарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Эти соли титруются соляной кислотой по схеме :
HCO3-
+ H+
H2CO3
H2O
+
CO2![]()
Реагенты:
Соляная кислота, НСl, раствор с точно установленной концентрацией
Индикатор метиловый оранжевый, 0,1%-ный водный раствор
Выполнение работы. Пипеткой емкостью 50 или 100 мл вносят в кони-ческую колбу исследуемую воду, прибавляют к ней две-три капли метилово-го оранжевого и оттитровывают стандартным раствором соляной кислоты. Титрование повторяют 2-3 раза и определяют объем HСl, пошедший на тит-рование воды:
![]() ,
ммоль-экв/л
,
ммоль-экв/л
где V – объем пробы воды, взятой для титрование, мл.
