
- •Содержание
- •Общие указания
- •Рекомендуемая литература
- •Земная кора
- •Стратиграфия и геохронология
- •Геологические процессы и явления
- •Гидрогеология
- •1.2.1. Происхождение, состав и свойства подземных вод
- •1.2.2. Разновидности подземных вод и их характеристика
- •Инженерно-геологические изыскания
- •Индивидуальные задания к контрольной работе по дисциплине «инженерная геология»
- •Вопрос № 1. Основы геологии
- •Вопрос № 2. Гидрогеология
- •Вопрос № 3. Описание горных пород
- •Вопрос № 4. Обработка результатов гранулометрического состава горных пород
- •Вопрос № 5. Обработка результатов химического анализа подземных вод
- •Вопрос № 6. Определение коэффициента фильтрации по результатам опытных кустовых откачек
- •Вопрос № 7. Инженерная геология
- •Пример обработки результатов гранулометрического состава горных пород
- •Пример обработки результатов химического анализа подземных вод
- •Определение коэффициента фильтрации по результатам опытной кустовой откачки
- •Приложения
Пример обработки результатов химического анализа подземных вод
Основной формой выражения результатов химического анализа воды является весовая ионная форма, которая является исходной для получения других форм выражения химических анализов воды. В этой форме в виде соответствующих таблиц результаты анализов проб воды поступают в производственные организации (см. табл. 3.4).
Таблица 3.4
Результаты химического анализа подземных вод
Катионы, мг/л |
Анионы, мг/л |
Растворенные газы, мг/л |
|||||
|
|
|
|
|
|
|
|
42,9 |
13,2 |
47,6 |
195,2 |
74,1 |
15,9 |
13,2 |
|
Для полного выявления свойств воды и точного представления о соотношении ионов результаты анализов переводят из весовой в эквивалентную форму – в миллиграмм-эквиваленты ионов в 1 л.
Для перевода мг/л в мг/экв в 1 л воды необходимо количество каждого иона разделить на его эквивалентный вес (частное от деления ионного веса на валентность).
Например, по данным
анализа, содержание
![]() составляет 42,9 мг/л. Атомный вес
– 40,08, валентность – 2, то эквивалентный
вес этого иона буде равен 40,08 : 2 = 20,04.
Значит, в эквивалентной форме выражение
анализа содержание кальция будет
составлять 42,9 мг/л : 20,04 = 2,14 мг-экв/л.
составляет 42,9 мг/л. Атомный вес
– 40,08, валентность – 2, то эквивалентный
вес этого иона буде равен 40,08 : 2 = 20,04.
Значит, в эквивалентной форме выражение
анализа содержание кальция будет
составлять 42,9 мг/л : 20,04 = 2,14 мг-экв/л.
Вместо деления на эквивалентный вес часто производят умножение количества миллиграммов иона в 1л на величину, обратную эквивалентному весу. Эта величина называется пересчетным коэффициентом. Так, пересчетный коэффициент для будет составлять 1:20,04 = 0,0499. Пересчетные коэффициенты наиболее часто встречающихся ионов приведены в таблице 3.5.
Таблица 3.5
Пересчетные коэффициенты основных катионов и анионов
Пересчетный коэффициент |
Катионы |
Анионы |
||||||
|
|
|
|
|
|
|
|
|
0,0499 |
0,0822 |
0,0438 |
0,0256 |
0,0164 |
0,0208 |
0,0282 |
0,0333 |
|
Для выражения результатов химического анализа в процент-эквивалентной форме сумму катионов и сумму анионов в миллиграмм-эквивалентной форме принимают за 100 % каждую. Далее с помощью пропорции определяют процентное содержание каждого катиона и аниона.
Так как вода является природным химическим раствором, находящимся в подвижном равновесии, то ионы противоположного знака взаимодействуют друг с другом, как уже говорилось, в эквивалентных количествах.
Поэтому сумма катионов в эквивалентной форме должна равняться сумме анионов. Если суммы не равны, то либо пересчет сделан неправильно, либо анализ проведен не точно. Допустимое расхождение сумм анионов и катионов не должно превышать 5 %.
В нашем случае:
![]() .
.
Результаты пересчетов результатов химического анализа воды приведены в таблице 3.6.
Таблица 3.6
Результаты обработки химического анализа подземных вод
Форма выражения анализа |
Анионы
|
Сумма |
Катионы
|
Сумма |
Жесткость |
Минерализация |
Водородный показатель pH |
Растворенные газы |
Название воды |
|||||
|
|
|
|
|
Na++ K+ |
мг-экв/л |
град |
|||||||
мг/л |
195,2 |
74,1 |
15,9 |
|
42,9 |
13,2 |
47,6 |
|
|
|
389 |
7,2 |
13,2 |
Сульфатно-гидрокарбонатная Натриевокалиевая кальциевая |
мг-экв/л |
3,20 |
1,54 |
0,45 |
5,19 |
2,14 |
1,09 |
1,22 |
5,31 |
3,23 |
9,03 |
|
|
||
% мг-экв/л |
61,7 |
29,7 |
8,6 |
100 |
40,3 |
20,4 |
39,3 |
100 |
|
|
|
|
||
Для систематизации химических анализов подземных вод используются многочисленные классификации, графические методы изображения состава подземных вод и формулы. Однако в настоящее время отсутствует единая классификация химического состава подземных вод. В связи с этим, предлагается большое количество классификаций вод по их ионному и компонентному составу, химическим свойствам и др.
Рассмотрим наиболее распространенные классификации подземных вод по их химическому составу и свойствам.
Минерализация воды – это сумма всех найденных при химическом анализе воды минеральных веществ. О величине минерализации судят по сухому остатку, который получается после выпаривания определенного объема воды и выпаривания его при температуре 110 °С. Минерализация выражается в мг/л и г/л.
По величине минерализации природные воды подразделяются на 6 групп (см. табл. 3.7).
Таблица 3.7
Классификация природных вод по величине минерализации
Группа природных вод |
Минерализация, г/л |
Сверхпресные |
менее 0,2 |
Пресные |
0,2−1,0 |
Слабосолоноватые |
1–3 |
Сильносолоноватые |
3−10 |
Соленые |
10−35 |
Рассолы |
более 35 |
По величине минерализации вода, химический анализ которой представлен в табл. 3.6, относятся к пресным.
Водородный показатель (pH) показывает концентрацию водородных ионов принято выражать показателем pH, представляющим собой отрицательный десятичный логарифм концентрации иона Н+: pH = −lg [Н+]. Практически показатель pH равен показателю степени концентрации ионов водорода взятому с обратным знаком. По величине водородного показателя природные воды подразделяются на 7 групп (см. табл. 3.8).
Таблица 3.8
Классификация природных вод по величине водородного показателя
Группа природных вод |
Водородный показатель (pH) |
Сильнокислые |
менее 1,9 |
Кислые |
1,9−4,0 |
Слабокислые |
4,1−6,9 |
Нейтральные |
7 |
Слабощелочные |
7,1−8,2 |
Щелочные |
8,3−10,3 |
Сильнощелочные |
более 10,3 |
По величине водородного показателя вода относится к слабощелочным.
Жесткость воды
обуславливается содержанием в воде
ионов
и
![]() .
Для вод, используемых в хозяйственных
и технических целях, жесткость имеет
большое значение. Величина жесткости
выражается в мг-экв/л, либо в немецких
градусах (1 мг-экв/л равен 2,8 немецких
градусов).
.
Для вод, используемых в хозяйственных
и технических целях, жесткость имеет
большое значение. Величина жесткости
выражается в мг-экв/л, либо в немецких
градусах (1 мг-экв/л равен 2,8 немецких
градусов).
Различают общую, временную (устранимую) и постоянную (неустранимую) жесткость воды.
Общая жесткость
определяется суммарным содержанием в
воде ионов
и
.
Временная жесткость обусловлена наличием
в воде гидрокарбонатных и карбонатных
солей кальция и магния. Для ее определения
сравнивают между собой содержание в
воде
![]() и сумму
и
.
В том случае, если содержание
гидрокарбонатного иона больше суммы
ионов кальция и магния, то величина
устранимой жесткости будет равна сумме
этих ионов и наоборот. Постоянная
жесткость равна разности между величинами
общей и временной жесткости.
и сумму
и
.
В том случае, если содержание
гидрокарбонатного иона больше суммы
ионов кальция и магния, то величина
устранимой жесткости будет равна сумме
этих ионов и наоборот. Постоянная
жесткость равна разности между величинами
общей и временной жесткости.
По величине общей жесткости природные воды подразделяются на 5 групп (табл. 3.9).
Таблица 3.9
Классификация природных вод по величине общей жесткости
Группа природных вод |
Общая жесткость, мг-экв/л |
Очень мягкие |
менее 1,5 |
Мягкие |
1,5−3,0 |
Умеренно жесткие |
3,1−6,0 |
Жесткие |
6,1−9,0 |
Очень жесткие |
более 9,0 |
Общая
жесткость воды, результаты химического
анализа которой представлены в табл.
6.1, будет равна 3,23 мг-экв/л или
9,03 °С, временная жесткость также будет
равна 3,23 мг-экв/л (т.к.![]() <
<![]() +
).
По величине общей жесткости вода
относится к умеренно жестким водам.
+
).
По величине общей жесткости вода
относится к умеренно жестким водам.
Для графического изображения результатов химического состава и систематизации анализов наибольшее распространение получили графики-прямоугольники, циклограммы, графики-треугольники, а также представление химического состава воды в виде формулы М.Г.Курлова.
Для наглядного изображения данных химического состава используется формула М.Г. Курлова, которая представляет собой псевдодробь, в числителе которой слева направо записывают анионы и их содержание (в % мг-экв/л) в порядке убывания. В знаменателе таким же способом записываются катионы. Количество катионов и анионов округляется до целых чисел. Для более четкого представления об условиях формирования химического состава вод в формуле указываются все анионы и катионы, содержание которых превышает 1 % мг-экв/л. Слева от дроби записывается величина общей минерализации в граммах на литр, а если имеются элементы, специфичные для данного химического анализа (газы, активные элементы и др.), то их количества (в г/л) записывают перед минерализацией. Справа от дроби записываются величины pH, дебита воды (в л/с) и температура воды в градусах Цельсия.
В наименование состава воды указываются те компоненты, содержание которых более 25 % мг-экв/л. В начале пишут название воды по преобладающему аниону (если анионов с содержанием 25 % мг-экв/л два и более, то название воды пишут через черточку от меньшего содержания к большему), затем добавляют название типа воды по преобладающим катионам и пишут их через черточку по тому же принципу.
Так, химический состав воды, результаты химического анализа которой представлены в табл. 3.6, будет обозначаться следующей формулой:
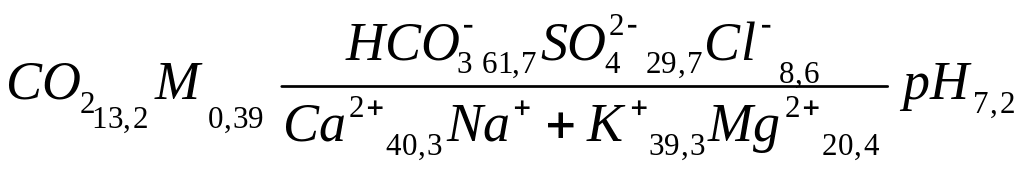 .
.
Название воды, состав которой приведен в записанной выше формуле, будет: сульфатно-гидрокарбонатная натриево-калиевая кальциевая.
График-прямоугольник
представляет собой два вертикальных
прямоугольника на одном из которых в
масштабе нанесены % мг-экв/л анионов, на
другом - % мг-экв/л катионов, в
последовательности, определяемой
относительной реакционной силой (для
анионов:
![]() +
+![]() ,
,
;
для катионов:
,
,
;
для катионов:
![]() ,
,
![]() ,
)
(см. рис. 3.5).
,
)
(см. рис. 3.5).

Рис. 3.5. График-прямоугольник химического состава воды
П ри
построении циклограмм, вычерчивается
окружность, диаметр которой в масштабе
равен величине минерализации воды.
Окружность разбивается на две половины
вертикальной плоскостью, площадь левой
половины круга соответствует 100 %
содержания катионов, а площадь правой
– 100 % содержания анионов. Содержание
каждого иона показывается в виде сектора,
площадь которого пропорциональна его
содержанию в % мг-экв/л (см. рис. 3.6).
ри
построении циклограмм, вычерчивается
окружность, диаметр которой в масштабе
равен величине минерализации воды.
Окружность разбивается на две половины
вертикальной плоскостью, площадь левой
половины круга соответствует 100 %
содержания катионов, а площадь правой
– 100 % содержания анионов. Содержание
каждого иона показывается в виде сектора,
площадь которого пропорциональна его
содержанию в % мг-экв/л (см. рис. 3.6).
Рис. 3.6. График-прямоугольник химического состава воды
Для изображения результатов массовых химических анализов вод используют графики-треугольники (см. приложение 2), на которых показывается содержание катионов и анионов. Методика построения подобных графиков подробно изложена в п.п. 3.2.
Построенные точки одного анализа подписываются одинаковой цифрой. Графики-треугольники, показанные на рис. 3.6, построены по данным результатов химического анализа (см. табл. 3.7).


Рис. 3.7. Графики-треугольники химического состава воды
Вредное (разрушающее) воздействие подземных вод на материал сооружений (бетон, железобетон, металл и т.д.) называется агрессивностью.
В зависимости от химических соединений, обуславливающих разрушающее воздействие, различают следующие виды агрессивности: углекислую, выщелачивающую, сульфатную, магнезиальную и общекислотную.
Углекислая агрессивность заключается в разрушении бетона в результате растворения карбонатов кальция (СаСО3) под действием свободной углекислоты (СО2). Данный вид агрессивности проявляется при содержании агрессивной СО2 в концентрациях более 3 мг/л.
Выщелачивающая агрессивность проявляется в виде растворения карбонатов кальция (СаСО3) и выщелачивания гидрооксида кальция (Са(НО)2).
Подземные воды считаются агрессивными при содержании менее 1,5 мг-экв/л.
Сульфатная агрессивность проявляется в виде вспучивания и разрушения бетона, под действием солей серной кислоты. Проявляется при содержании в водах ионов в концентрации более 250 мг/л.
Магнезиальная агрессивность отмечается при высоких содержаниях ионов Mg2+, более 1000 мг/л. Бетон при этом вспучивается и разрушается.
Общекислотная агрессивность выражается в виде разрушения металлических частей сооружений и установок подземными водами с водородным показателем (рН) менее 7.
Рассматриваемая подземная вода проявляет углекислую агрессивность, так как содержание СО2 превышает значение 3 мг/л.
