
- •Основные параметры состояния
- •Законы идеальных газов Уравнение Менделеева – Клапейрона
- •Смеси жидкостей, газов и паров Газовые смеси. Закон Дальтона
- •Теплоемкость Нахождение истинных и средних теплоемкостей
- •Теплоемкость смесей
- •Термодинамические процессы газов
- •Второе начало термодинамики Круговые процессы тепловых машин
- •Цикл Карно
- •Процессы компрессорных машин
- •Процесс идеального многоступенчатого поршневого компрессора
- •Термодинамические циклы поршневых двигателей внутреннего сгорания
- •Основы теплоснабжения
- •Задачи Основные параметры состояния
- •Законы идеальных газов Уравнение Менделеева – Клапейрона
- •Смеси жидкостей, газов и паров Газовые смеси. Закон Дальтона
- •Теплоемкость Нахождение истинных и средних теплоемкостей Теплоемкость смесей
- •Термодинамические процессы газов
- •Второе начало термодинамики Круговые процессы тепловых машин Цикл Карно
- •Процессы компрессорных машин
- •Термодинамические циклы поршневых двигателей внутреннего сгорания
- •Основы теплоснабжения
- •Литература:
Основные параметры состояния
Пример 1. В пусковом баллоне дизеля вместимостью 0,3 м3 содержится воздух, плотность которого 2,86 кг/м3. Определить массу воздуха в баллоне.
Решение. Массу воздуха определим из уравнения m = V ,
m = 2,860,3 = 0,858 кг.
Ответ: 0,858 кг.
Пример 2. Диаметр днища коллектора водопроводного котла 1,2 м. Давление пара в котле 2,5 МПа. Найти силу, действующую на днище коллектора изнутри.
Решение. Площадь днища коллектора найдем как площадь круга s = d2/4.
s = 3,141,21,2/4 = 1,1304 м2.
Сила, действующая на днище коллектора изнутри F = ps.
F = 2,5106 1,1304 = 2,826106 H.
Ответ: 2,826 МН.
Пример 3. Выразить в единицах СИ давление 367,7 мм. рт. ст. , 882,6 мм рт. ст. и 300 мм вод. ст.
Решение. Для определения давления столба жидкости используем формулу p = g h .
Плотность ртути равна 13560 кг/м3, плотность воды – 1000 кг/м3.
Следовательно,
1). р =135609,8 367,710-3 = 48913 Па
2). р =135609,81882,610-3 = 117407 Па
3). р =10009,8130010-3 = 2943 Па
Ответ: 48,9 кПа; 0,117 МПа; 2,94 кПа.
Пример 4. Манометр, установленный на паровом котле, показывает давление 1,8 МПа. Найти давление пара в котле, если атмосферное давление 99 кПа.
Решение. Абсолютное давление – это сумма атмосферного и избыточного давлений
pабс = pизб +ратм ;
p= 1,8 + 0,099 = 1,899 МПа.
Ответ: 1,899 МПа.
Пример 5. Вакуумметр показывает разрежение 80 кПа. Каково должно быть давление в сосуде, если атмосферное давление по барометру составляет 100 кПа?
Решение. Абсолютное давление – это разность атмосферного и вакуумметрического давлений:
pабс = pатм - рвак ;
pабс= 100 – 80 = 20 кПа.
Ответ: 20 кПа.
Законы идеальных газов Уравнение Менделеева – Клапейрона
Пример 6. В баллоне содержится кислород массой 2 кг при давлении 8,3 МПа и температуре 15С. Вычислить вместимость баллона.
Решение. Используем уравнение состояния идеальных газов:
pV=mR0T;
Из уравнения состояния идеальных газов получаем
V=mR0T/;.
V= 2259,8(15+273)/(8,3106) = 0,018 м3.
Ответ: 0,018 м3 = 18 л.
Пример 7. Резервуар вместимостью 4 м3 заполнен углекислым газом. Найти массу газа и его вес , избыточное давление в резервуаре 40 кПа, температура 80С, а барометрическое давление 102,4 кПа.
Решение. Абсолютное давление газа pабс = p = pизб +ратм ;
p = (40+102,4) 103 = 142,4 кПа.
Используем уравнение состояния идеальных газов:
pV=mR0T.
Из уравнения состояния получаем:
m = pV/(R0T) = 142,41034/(188,9(273+80)) = 8,542 кг.
Вес газа G=mg.
G= 8,5429,81 =83,797 H.
Ответ: 83,797 H.
Смеси жидкостей, газов и паров Газовые смеси. Закон Дальтона
Пример 8. Сухие продукты сгорания нефти массой 1 кг имеют следующий состав : m(CO2) = 3,20 кг; m(CO) = 1,01 кг; m(O2) = 1,33 кг; m(N2) = 17,40 кг. Найти массовые компоненты газов, составляющих эту смесь, молярную массу и удельную газовую постоянную смеси.
Решение. Предварительно найдем массу смеси по уравнению
m = m(CO2) + m(CO) + m(O2) + m(N2) ;
m = 3,20+1,01+1,33+17,40= 22,94 кг.
Вычислим массовые доли компонентов по формуле i = mi/ m
(CO2) = m(CO2 )/ m =3,20/22,94 = 0,394;
(CO) = m(CO)/ m =1,01/22,94 = 0,44;
(O2) = m(O2)/ m =1,33/22,94 = 0,058;
(N2) = m(N2)/ m = 17,40/22,94 = 0,759.
Проверим
произведенные вычисления по контрольному
уравнению
![]()
(CO2) +(CO) +(O2) +(N2) =0,139+ 0,44+0,058+0,759=1,00.
Сумма массовых долей равна 1, значит, вычисления произведены правильно.
Пользуясь
уравнением
![]() ,
определим молярную массу смеси (молярные
массы компонентов находим по табл. 1
приложения
,
определим молярную массу смеси (молярные
массы компонентов находим по табл. 1
приложения

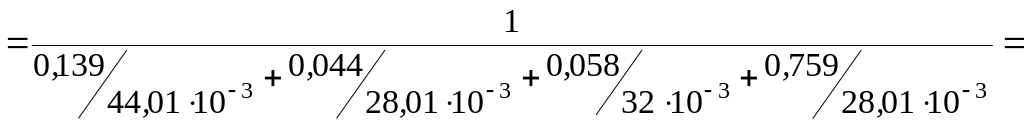
![]() кг/моль.
кг/моль.
Определим удельную газовую постоянную смеси R0 =R/Mсм
R0 = 8,31/(29,7310-3 )= 279,5 Дж/(кг К).
Ответ: 0,394; 0,44; 0,058; 0,759; 0,02973 кг/моль; 279,5 Дж/(кг К).
Пример 9. Найти удельную газовую постоянную смеси, состоящей из азота с приведенным объемом 0,4 м3 и кислорода с приведенным объемом 0,2 м3.
Решение. Общий объем смеси
V = V(N2) + V(O2) = (0,4 +0,2) м3 = 0,6 м3.
Объемные доли компонентов:
х(O2) = V(O2)/ V = 0,2/0,6 =0,333;
х(N2) = V(N2)/ V = 0,4/0,6 =0,667.
Контрольное уравнение:
х(O2) +х(N2) = 0,333+0,667= 1,000.
Молярная масса смеси:
![]() ;
;
Мсм = 0,3333210-3+0,6672810-3 =29,33210-3 кг/моль.
Удельная газовая постоянная смеси
R0 =R/Mсм ;
R0 = 8,31/29,33210-3 = 283,3 Дж/(кг К).
Ответ: 283,3 Дж/(кг К).
Пример 10. Найти для условий предыдущего примера парциальные давления азота и кислорода газовой смеси. Давление смеси равно 0,1 МПа.
Решение. Парциальные давления компонентов:
р(O2) = х(O2)р = 0,3330,1106 = 33333 Па;
р(N2) = х(N2)р = 0,6670,1106 = 66667 Па.
Контрольное уравнение:
![]()
р(O2) + р(N2) = 33333+66667= 10000 Па = 0,1 МПа.
Ответ: 33,3 кПа; 66,7 кПа .
Пример 11. Продукты сгорания топлива массой 1 кг имеют следующий состав (в моль): n(H2O) (паров воды) = 60,3; n(CO2) = 73,9; n(O2) = 123,2; n(N2) = 849,5. Найти молярную массу и массу смеси.
Решение. Количество вещества продуктов сгорания
nсм = n(H2O) +n(CO2) +n(O2) +n(N2),
nсм = 60,3+ 73,9+ 123,2+ 849,5 = 1106,9 моль.
Молярные доли компонентов:
х(H2O )= n(H2O)/n = 60,3/1106,9=0,0544;
х(CO2 )= n( CO2)/ n = 73,9/1106,9 =0,0668;
х(O2 ) = n(O2)/ n = 123,2/1106,9 =0,1113;
х(N2) = n(N2)/ n = 849,5/1106,9 =0,7675.
Контрольное уравнение:
х(H2O )+ х(CO2 )+ х(O2) +х(N2) = 0,0544+0,0668+0,1113+0,7675= 1,000.
Молярная масса смеси, заданной молярными долями:
![]()
Мсм = х(H2O ) М(H2O )+ х(CO2 )М(CO2 )+ х(O2)М(O2) +х(N2)М(N2);
Мсм = (0,054418+ 0,066844 +0,111332+0,767628)10-3 = 29,33210-3 кг/моль;
![]() 1106,929,33210-3
= 32,47 кг.
1106,929,33210-3
= 32,47 кг.
Ответ: 29,33210-3 кг/моль; 32,47 кг.
