
TORCH_Аряев
.pdf
Неонатология
ние женщин этими инфекциями происходило во время беременности. Следо вательно, внутриутробно или в родах плод мог инфицироваться не только ВИЧ, но и другими возбудителями инфекций. Установлено, что 10,12 % ВИЧ инфи цированных женщин лечились по поводу туберкулеза, в том числе во время бе ременности. Настоящая беременность протекала на фоне гестоза второй поло вины в 31,64 % случаев, с анемией — в 62,03 %. В результате неблагоприятного влияния ВИЧ инфекции и вышеперечисленных факторов в исследуемой груп пе детей чаще, чем в популяции, наблюдалась низкая масса тела при рождении: недоношенными родилось 6,96 % детей (в общей популяции — 4 %), со ЗВУР — 29,11 % (в общей популяции — 8,9 %). Как видно из данных табл. 68, неблаго приятные воздействия чаще отмечались в анамнезе детей с низкой массой тела. Наблюдаемая разница показателей определена как не случайная (Р ≤ 0,05). У детей с низкой массой тела в период новорожденности чаще, чем у детей с нор мальной массой тела, отмечались респираторный дистресс синдром, метаболи ческие расстройства, нарушения процессов адаптации. Дети с низкой массой при рождении, как недоношенные, так и с задержкой внутриутробного развития, имеют более высокий риск летальности и заболеваемости в первые месяцы жиз ни, чем дети с нормальной массой тела.
Проведенные исследования выявили, что на внутриутробное развитие ребен ка и на состояние его здоровья после рождения, наряду с ВИЧ инфекцией, су щественно влияют целый ряд факторов: вредные привычки матери, инфекции, которыми ребенок может заразиться внутриутробно или в родах (гепатиты В, С, сифилис, гонорея, туберкулез), осложненное течение беременности (анемия, гестоз второй половины). Эти факторы, несомненно, повышают риск перина тальной трансмиссии ВИЧ и увеличивают летальный риск ребенка.
Особенности ведения новорожденных, рожденных ВИЧ"инфицированными женщинами. Чтобы предотвратить попадание крови и секретов родовых путей матери в кровоток только что рожденного ребенка, необходимо перед пересече нием пуповины между двумя зажимами обработать ее раствором хлоргексиди
Таблица 68
Факторы, влияющие на плод ВИЧ инфицированных беременных женщин
(Н. Л. Аряев и соавт., 2002)
|
Нормальная |
ЗВУР и недоно |
|
|
Факторы |
масса тела |
шенность (низкая |
Р |
|
при рождении, %, |
масса тела при рож |
|||
|
|
|||
|
n=101 |
дении), %, n=57 |
|
|
|
|
|
|
|
Наркомания |
5,94 |
56,14 |
≤0,01 |
|
Табакокурение |
9,90 |
75,44 |
≤0,01 |
|
Гепатит С |
9,90 |
19,30 |
≤0,05 |
|
Гепатит В |
3,96 |
10,53 |
≤0,05 |
|
Сифилис |
– |
14,04 |
– |
|
Трихомонадный кольпит |
5,94 |
– |
– |
|
Туберкулез |
– |
10,53 |
– |
|
Гонорея |
1,98 |
– |
– |
|
|
|
|
|
598

Раздел V. Инфекционные заболевания, специфические для перинатального периода
на (водного или спиртового). Следует бережно и тщательно отсосать содержи мое из полости рта, носа и желудка новорожденного, чтобы уменьшить загла тывание и всасывание инфицированных ВИЧ биологических жидкостей мате ри.
Сразу после пересечения пуповины в пробирку набирают кровь ребенка из пуповины для определения антител к ВИЧ. Выявление у ребенка антител к ВИЧ позволит юридически приравнивать его к ВИЧ инфицированным, даст ему пра во на получение социальной помощи.
Первичный туалет новорожденного проводят очень бережно и тщательно, чтобы не повредить кожу, исключить втирание секретов родовых путей и кро ви матери в кожу. Ребенка следует погрузить в теплый мыльный раствор, об мыть его, затем ополоснуть теплой водой. При наличии ссадин на коже ново рожденного их обрабатывают раствором 3% й перекиси водорода, затем спир товым раствором хлоргексидина; ссадины на слизистых оболочках необходимо обработать водным раствором хлоргексидина. Обработку остатка пуповины, слизистых оболочек глаз, половых органов проводят так же, как всем новорож денным.
Ребенка не прикладывают к груди и не кормят материнским молоком. Необ ходимо объяснить матери риск заражения ребенка ВИЧ при грудном вскарм ливании.
На основании анамнеза матери, данных о состоянии ее здоровья во время бе ременности, результатов объективного обследования новорожденного оценива ют риск заболевания ребенка врожденными инфекциями — гепатитом В, С, си филисом, герпес инфекцией, цитомегалией, токсоплазмозом и другими TORCH инфекциями. По показаниям проводят исследование крови ребенка (серологическими тестами или методом ПЦР) в целях выявления названных инфекций.
Необходимо подробно расспросить мать о возможных контактах с больны ми туберкулезом и оценить риск заражения ребенка в семье. Эта информация очень важна, так как до исключения диагноза ВИЧ инфекции вакцинацию БЦЖ ребенку, рожденному ВИЧ инфицированной женщиной, не проводят.
Иммунизацию против гепатита В целесообразно осуществлять в зависимос ти от инфекционного статуса матери. Если ребенок рожден HBsAg отрицатель ной матерью, то вакцинацию проводят по календарю прививок. Первое введе ние вакцины осуществляют в течение 24 ч жизни. Если ребенок рожден HBsAg положительной матерью, в первые 12 ч после рождения ему необходимо ввести 0,5 мл противогепатитного иммуноглобулина (Hepatitis B immune globulin — HBIG), а также провести вакцинацию против гепатита В. Если ребенок рожден матерью с неизвестным HBsAg статусом, то в первые 12 ч после рождения не обходимо провести вакцинацию против гепатита В, уточнить материнский HBsAg и при положительном результате как можно скорее (не позже первой недели жизни) ввести ребенку HBIG.
Если ВИЧ инфицированной женщине в родах назначали невирапин (син. вирамун), то ребенку следует назначить невирапин внутрь в виде сиропа в пе риод между 48 и 72 ч после рождения в дозе 2 мг/кг 1 раз. Если мать получила невирапин меньше, чем за 1 ч до рождения ребенка, новорожденному назнача ют препарат дважды: первая доза 2 мг/кг — как можно раньше после рождения,
599

Неонатология
вторая доза 2 мг/кг — в период между 48 и 72 ч после рождения. Невирапин не назначают: детям, рожденным в сроке гестации менее 28 нед; при наличии у ре бенка пороков развития, несовместимых с жизнью; при нарушении функции печени, если AЛТ превышает норму в 10 раз.
Если ВИЧ инфицированная женщина во время беременности не получала специфические антиретровирусные препараты, то назначение зидовудина жен щине во время родов и ребенку после рождения также снижает риск перина тальной передачи ВИЧ. Ребенку, рожденному ВИЧ инфицированной женщи ной, назначают зидовудин в дозе 2 мг/кг каждые 8 ч внутрь в виде сиропа в те чение 6 нед. При начале такого курса профилактики ребенку в возрасте менее 48 ч риск перинатальной трансмиссии ВИЧ составляет 9 %. При более позднем начале курса зидовудина риск заражения увеличивается вдвое (18 %). Посколь ку зидовудин в сиропе не зарегистрирован в Украине, то препарат, как прави ло, детям не назначают.
ГЛАВА 7. ВРОЖДЕННЫЙ СИФИЛИС
Повышение уровня заболеваемости сифилисом в последнее десятилетие ак туализировало проблему врожденного сифилиса. Своевременное лечение бере менной женщины дает возможность предупредить рождение ребенка с врожден ным сифилисом.
Этиология. Возбудитель сифилиса бледная трепонема — Treponema pallidum
— относится к роду спирохет, включающему как патогенные, так и непатогенные для человека микроорганизмы, являющиеся представителями нормальной фло ры полости рта, пищеварительного тракта и половых путей. Бледная трепонема представляет собой спиральный нитевидный микроорганизм длиной 6–20 мкм и диаметром 0,1–0,18 мкм. Для ее выявления при бактериологическом исследова нии используют окраску серебром или иммунофлюоресцентные методы.
Эпидемиология. Передача инфекции происходит половым и трансплацентар ным (от матери к плоду in utero) путями. Внутриутробное инфицирование пло да наиболее вероятно при раннем скрытом и вторичном сифилисе у матери. При отсутствии лечения в 25–30 % случаев происходит внутриутробная гибель пло да, примерно в 35–40 % случаев рождаются дети, больные врожденным сифи лисом. Передача инфекции может происходить на любой стадии беременности.
Клинические проявления сифилиса во время беременности аналогичны при знакам заболевания вне беременности. После первичного инфицирования на ступает инкубационный период продолжительностью около 3 нед (в пределах 10–90 дней); затем в месте внедрения возбудителя наблюдаются первичные про явления — шанкры. Появление безболезненных эрозий с твердыми краями обыч но сопровождается регионарным лимфоаденитом. У женщин первичные пора жения, расположенные на шейке матки, могут протекать бессимптомно, затруд няя диагностику заболевания. Вторичный период сифилиса начинается через 6–12 нед после первичного инфицирования и может продолжаться до 3–4 лет. Вторичный сифилис проявляется как генерализованная инфекция с обильны
600

Раздел V. Инфекционные заболевания, специфические для перинатального периода
ми пятнисто узелковыми, реже пустулезными высыпаниями на коже и слизис тых оболочках. После периода вторичного сифилиса наступает латентная фаза заболевания, переходящая в дальнейшем в поздний висцеральный и нейроси филис.
Основу профилактики врожденного сифилиса составляют своевременная диагностика и лечение беременных, которое назначает дерматовенеролог.
Клиника врожденного сифилиса. Согласно МКБ X, под ранним врожденным сифилисом (РВС) понимают внутриутробную инфекцию, проявляющуюся у ребенка до двух лет. Различают манифестный (с клиническими проявлениями) и скрытый (без клинических проявлений) ранний врожденный сифилис. Кли нические проявления позднего врожденного сифилиса проявляются в возрасте старше двух лет.
Ранний врожденный манифестный сифилис. К возможным проявлениям ран него врожденного сифилиса относятся ЗВУР и недоношенность. В классичес ких случаях новорожденный имеет своеобразный «старческий» вид. Кожа мор щинистая, грязно желтого оттенка, тургор резко снижен.
Наиболее ранний клинический признак врожденного сифилиса — это ринит, который вначале проявляется затруднением носового дыхания, связанным с отеком слизистой оболочки. Затем появляется слизистое, гнойное или обиль ное зловонное кровянисто гнойное отделяемое из носа. Возможно развитие но совых кровотечений. Сифилитический ринит может сопровождаться глубоки ми изъязвлениями слизистой оболочки, повреждением хрящей и костей лице вого черепа.
Характерные изменения кожи (сифилитическая пузырчатка) могут быть об наружены непосредственно после рождения или появляются в первые недели жизни. Пузыри с серозно гнойным или кровянистым содержимым чаще всего расположены на коже ладоней и подошв. В основании пузырей находится спе цифический инфильтрат. Диффузная инфильтрация кожи обычно возникает к концу второго месяца жизни. Ей предшествует эритематозная сыпь, которая мо жет быть расположена на ладонях и подошвах, в перианальной области, на бед рах, ягодицах, волосистой части головы, лице.
Специфичным признаком врожденного сифилиса считается остеохондрит Ве генера, характеризующийся поражением трубчатых костей на границе эпи физа и диафиза.
К клиническим проявлениям раннего врожденного сифилиса относят также гепато и спленомегалию, признаки поражения ЦНС, хориоретинит.
Ранний врожденный скрытый сифилис проявляется только серологически и составляет более половины всех зарегистрированных случаев врожденного си филиса.
Поздний врожденный сифилис. Самое распространенное клиническое прояв ление позднего врожденного сифилиса — интерстициальный кератит, который наблюдают приблизительно у 40 % больных. В возрасте от 5 до 20 лет поража ется костная ткань. В основном это большеберцовые кости, однако, возможно поражение носовой перегородки и твердого неба.
Поражения, характерные для раннего и позднего врожденного сифилиса, могут приводить к развитию деформаций лицевого черепа («седловидный» нос)
601

Неонатология
и зубов. В результате интерстициального кератита, характерного для позднего врожденного сифилиса, развиваются аномалии роговицы.
Диагностика основывается на анализе клинико анамнестических данных. Для диагностики раннего врожденного сифилиса на 7–8 й день жизни новорож денному проводят серологическое обследование при помощи комплекса серо логических реакций (КСР), состоящего из реакции связывания комплемента (РСК) с кардиолипиновым антигеном, РСК с трепонемным антигеном и реак ции микропреципитации (РМП) с кардиолипиновым антигеном. Результаты подтверждают с помощью одного из специфических тестов — реакции иммуно флюоресценции (РИФ), реакции пассивной гемагглютинации (РПГА), опреде ления специфических IgM при помощи иммуноферментного анализа (ИФА). В пользу врожденного сифилиса свидетельствуют положительные результаты серологических реакций. Специфические IgM не проходят через плаценту, по этому их наличие в сыворотке крови подтверждает наличие врожденной инфек ции у новорожденного.
При признаках поражения ЦНС в спинномозговой жидкости выявляют ци тоз преимущественно лимфоцитарного характера, повышение содержания бел ка выше 1,5–1,7 г/л, положительные результаты РИФ и КСР.
Рентгенографическое исследование трубчатых костей предплечий и голеней позволяет обнаружить остеохондриты и периоститы.
Профилактическое лечение новорожденных. К показаниям для проведения профилактического лечения новорожденных относятся:
—отсутствие лечения матери во время беременности;
—недостаточное или неполноценное лечение матери во время беременности;
—поздно начатое (после 32 й недели беременности) специфическое лечение матери;
—специфическое лечение матери эритромицином.
Лечение проводится одним из препаратов пенициллина. Пенициллина на триевую соль применяют детям первых 6 мес жизни в дозе 100 000 ЕД/кг в сут ки, детям старше 6 мес — 50 000 ЕД/кг в сутки. Пенициллины средней продол жительности действия (прокаин пенициллин, новокаиновая соль пеницилли на) применяют в дозе 50 000 ЕД/кг на одну инъекцию. Пенициллина натрие вую соль вводят 6 раз в сутки (каждые 4 ч) в течение 10 дней, прокаин пеницил лин — 1 раз в сутки в течение 10 дней. При непереносимости пенициллина воз можно применение оксациллина, ампициллина или ампиокса в суточной дозе 100 000 ЕД/кг, разделенной на 4 инъекции, в течение 10 дней, цефтриаксона в дозе 50 мг/кг 1 раз в сутки в течение 10 дней.
Специфическое лечение раннего врожденного сифилиса. Лечение проводится одним из препаратов пенициллина в тех же дозах, что и для профилактическо го лечения новорожденных. Пролонгированные пенициллиновые препараты (экстенциллин, ретарпен) применяют в разовой дозе 50 000 ЕД/кг. Выбор пре парата определяется наличием патологических изменений в спинно мозговой жидкости. Если есть признаки менингита, то пролонгированные пенициллино вые препараты не применяют. Натриевую соль пенициллина вводят 6 раз в сутки (каждые 4 ч) в течение 28 дней. Прокаин пенициллин назначают 1 раз в сутки в течение 28 дней. Для доношенных детей с массой тела более 2000 г без патоло гических изменений спинно мозговой жидкости возможно применение экстен
602

Раздел V. Инфекционные заболевания, специфические для перинатального периода
циллина или ретарпена 1 раз в неделю в течение трех недель. При непереноси мости препаратов пенициллинового ряда возможно использование ампицилли на, оксациллина, ампиокса или цефтриаксона.
Диспансерное наблюдение. После окончания лечения ребенок выписывается под наблюдение дерматовенеролога. Клинико серологический контроль детей, получивших профилактическое лечение, осуществляют 1 раз в 3 мес в течение первого года жизни. При отсутствии признаков заболевания ребенка снимают с учета в возрасте 1 год. Наблюдение детей, перенесших ранний врожденный сифилис, продолжается до 3 лет. Клинико серологические исследования в те чение первого года проводят 1 раз в 3 мес, в дальнейшем — 1 раз в 6 мес.
Профилактика. При выявлении серологических или клинических симптомов сифилиса у беременной проводится специфическое лечение по следующим схе мам:
1. Первичный сифилис (методики равноценны):
•Прокаин пенициллин по 1,2 млн ЕД ежедневно 10 дней.
•Новокаиновая соль пенициллина по 600 000 ЕД 2 раза в сутки в течение 10 дней.
•Натриевая соль пенициллина по 1 млн ЕД 4 раза в сутки в течение 10 дней. 2. Вторичный сифилис (методики равноценны):
•Прокаин пенициллин по 1,2 млн ЕД ежедневно 10 дней.
•Новокаиновая соль пенициллина по 600 000 ЕД 2 раза в сутки в течение 20 дней.
•Натриевая соль пенициллина по 1 млн ЕД 4 раза в сутки в течение 20 дней. Профилактическое лечение беременных в сроке 18 нед показано в том слу
чае, если специфическое лечение проведено до беременности, но комплекс се рологических реакций остался положительным, а также если специфическое лечение осуществлено в ранние сроки беременности. Профилактическое лече ние проводят следующими методиками равнозначной эффективности:
•Натриевая соль пенициллина по 1 млн ЕД 4 раза в сутки в течение 10 дней.
•Прокаин пенициллин по 1,2 млн ЕД ежедневно 10 дней.
•Новокаиновая соль пенициллина по 600 000 ЕД 2 раза в сутки в течение 10 дней.
ГЛАВА 8. ВРОЖДЕННЫЙ ТОКСОПЛАЗМОЗ
Этиология. Токсоплазмоз — протозойное заболевание, возбудитель которого
— облигатный внутриклеточный паразит Toxoplasma gondii (тип Sporozoa, класс Coccidea). Жизненный цикл Toxoplasma gondii проходит с участием окончательного и промежуточного хозяев. Окончательным хозяином служат представители семейства кошачьих, а промежуточным — многие виды млекопитающих и птиц. Инфекция распространена повсеместно. Антитела к токсоплазме обнаруживают у 10 % детей, у 10–37 % людей в возрасте от 10 до 20 лет, у 60–80 % — к 50–60 летнему возрасту.
603

Неонатология
В природе Toxoplasma gondii существует в двух биологических циклах: эн тероэпителиальном половом и экстраэпителиальном, а также в трех формах. Продуктом энтероэпителиального цикла являются ооцисты, содержащие спо розоиты. Тахизоиты относятся к инвазивным формам Toxoplasma gondii. В ла тентной стадии инфекционного процесса Toxoplasma gondii персистирует в форме тканевых цист, содержащих брадизоиты.
Ооцисты представляют собой овоиды размером 10–12 мкм. Они образуются в результате энтероэпителиального цикла в тонком кишечнике животных се мейства кошачьих. Инфекционную способность ооцисты приобретают в резуль тате созревания после экскреции их в окружающую среду. В процессе созрева ния в результате клеточного деления из ооцисты образуются 8 спорозоитов. При температуре окружающей среды 24 °С созревание ооцист происходит в течение 2–3 дней, при 11 °С — в течение 14–21 дня. Животные начинают выделять в окружающую среду ооцисты через 1–2 нед после инфицирования, при этом ко личество ооцист, выделяемых ежедневно одним животным, может достигать
10млн.
Тахизоиты — инвазивная форма Toxoplasma gondii, характерная для острой
стадии инфекции. Их размеры составляют 3–7 мкм. Несмотря на то, что они име ют собственный комплекс Гольджи, рибосомы и митохондрии, тахизоиты не способны к самостоятельному внеклеточному существованию. В цитоплазме клетки хозяина каждые 4–6 ч происходит деление тахизоитов внутри парази тофорных вакуолей, в результате чего образуются розетки и псевдоцисты. Пос ле серии повторных делений трофозоиты разрушают инфицированную клетку. При развитии специфического гуморального иммунного ответа внеклеточные тахизоиты могут быть лизированы антителами или комплементом.
Размеры тканевых цист варьируют от 10 до 50 мкм. Эти цисты содержат до нескольких тысяч брадизоитов, которые могут выходить из тканевой кисты без полного разрушения ее оболочки, при этом в пораженном органе образуются дочерние тканевые цисты.
Жизненный цикл. Заражение животных происходит при заглатывании ооцист или трансплацентарно. При заглатывании цист или ооцист их наружная стенка разрушается под действием ферментов пищеварительного тракта. Освободив шиеся спорозоиты или брадизоиты из просвета кишечника внедряются в эпи телиальные клетки, где происходит их размножение. В кишечнике животных семейства кошачьих осуществляется половой цикл Toxoplasma gondii. Через 3– 15 дней после инфицирования животного образуются гаметоциты, а в резуль тате фузии макро и микрогаметоцитов — зиготы. Формированием наружной защитной стенки заканчивается формирование ооцист, которые секретируют ся в просвет кишечника и выделяются в окружающую среду. В стенке кишеч ника и других тканях вторичных хозяев, в том числе и человека, образуются тка невые цисты. В такой форме токсоплазменная инфекция персистирует в орга низме вторичного хозяина в течение всей жизни.
Первичное инфицирование Toxoplasma gondii приводит к формированию пожизненного иммунитета, вследствие чего реинфицирование не приводит к возникновению клинических проявлений инфекции.
Эпидемиология. Люди высоко восприимчивы к токсоплазмозу, частота инфи цирования увеличивается с возрастом. Первичная инфекция, как правило, про
604

Раздел V. Инфекционные заболевания, специфические для перинатального периода
текает бессимптомно, однако возможно развитие токсоплазменного хориорети нита. Инфицирование человека происходит при употреблении в пищу недоста точно термически обработанных мясных продуктов, при питье загрязненной воды, вдыхании инфицированной пыли. Внутриутробное трансплацентарное или перинатальное инфицирование случается при инфицировании матери во время беременности. Возможно заражение токсоплазмозом при переливании крови, пересадке органов.
Клиника токсоплазмоза у беременных. Инфицирование и паразитемия в боль шинстве случаев протекают бессимптомно. У 10 % больных наблюдают повы шение температуры тела, общее недомогание, боль в мышцах и суставах, гене рализованное увеличение лимфатических узлов, увеличение печени и селезен ки, возможно появление экзантемы. При иммуносупрессии первичное инфици рование или реактивация латентной инфекции могут проявляться поражением ЦНС, дыхательной и сердечно сосудистой систем, глаз. Возможно развитие ге нерализованного диссеминированного токсоплазмоза с клинической картиной септического шока, выраженной дыхательной недостаточностью и ДВС синд ромом.
Риск врожденного токсоплазмоза связан с паразитемией и последующим пла центитом у матери. При первичном инфицировании во время беременности па разитемия, как правило, продолжается до 3 нед. На ранних стадиях беременно сти плацента служит достаточно эффективным барьером для цитоплазм. Про ницаемость плаценты увеличивается на поздних стадиях беременности, при на личии плацентита любой этиологии. Риск внутриутробного заражения токсо плазмозом при первичном инфицировании в I триместре беременности состав ляет 25 %, в III триместре он приближается к 65 %. Хроническое инфицирова ние может послужить причиной внутриутробной передачи только в случае им муносупрессии у матери.
Тяжелые антенатальные поражения плода при внутриутробном инфициро вании токсоплазмой могут быть выявлены при ультразвуковом исследовании. В этом случае отмечают ЗВУР, расширение желудочковой системы мозга, гид роцефалию.
Клиника врожденного токсоплазмоза у новорожденных. Внутриутробное ин фицирование в ранний период фетального развития (от 9 до 29 нед) может при вести к внутриутробной гибели плода, формированию гидроцефалии. Степень выраженности клинических проявлений врожденного токсоплазмоза может быть различной. У 10–20 % инфицированных новорожденных наблюдают тя желое течение заболевания, которое проявляется врожденной гидроцефалией, менингоэнцефалитом, хориоретинитом, гепатитом, пневмонией, миокардитом. Впоследствии у таких детей наблюдают грубую задержку психомоторного и не рвно психического развития. При нейроносонографии и компьютерной томог рафии выявляют кальцификаты головного мозга, гидроцефалию (рис. 94).
При бессимптомных и субклинических формах врожденного токсоплазмоза возможно развитие отставания в нервно психическом развитии, нарушения слу ха и зрения.
Диагностика токсоплазменной инфекции базируется на выявлении специ фических антител методом ИФА. При первичном инфицировании IgM появ ляется спустя 1–2 нед от момента инфицирования и определяется в течение не
605
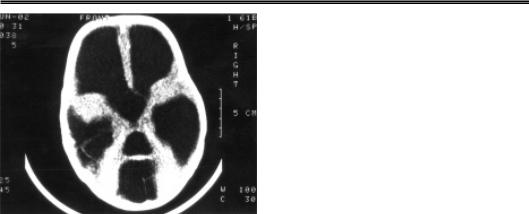
Неонатология
|
|
скольких недель, IgG обнаруживается |
|
|
|
|
|
в крови через 1–2 мес после инфици |
|
|
рования и его уровень в низких титрах |
|
|
держится многие годы. Рецидив забо |
|
|
левания при хронической или латент |
|
|
ной инфекции, как правило, не дает |
|
|
значительного повышения титра IgM. |
|
|
Таким образом, обнаружение специфи |
|
|
ческого IgM у обследуемого — доста |
|
|
точно точный показатель первичного |
|
|
инфицирования. К прямым методам |
|
|
диагностики токсоплазмоза относится |
|
|
выявление генетического материала |
|
|
|
Рис. 94. Компьютерная томограмма го |
возбудителя методом ПЦР. |
|
ловного мозга. Врожденный токсоплазмоз. |
Лечение беременных. При первич |
|
Гидроцефалия |
ном инфицировании в I триместре бе |
|
|
|
ременности женщине назначают анти |
биотик из группы макролидов (предпочтительнее спирамицин) по 1 г 3 раза в сутки. Лечение продолжают на протяжении всей беременности курсами по 2– 3 нед с 2 недельными перерывами. Во II и III триместрах беременности можно назначать комбинации пириметамина с сульфаниламидными препаратами (фан сидар) по 25–50 мг в сутки из расчета по пириметамину курсами на 5–7 дней с перерывами на 7–10 дней. Циклы приема фансидара можно чередовать с назна чением спирамицина. За 2 нед до предполагаемых родов фансидар необходимо отменить для предотвращения развития конкурентозависимой гипербилируби немии. С целью уменьшения токсического воздействия фансидара на костно мозговое кроветворение прием препарата сочетают с назначением препаратов фолиниевой кислоты (лейковарин) в дозе 10 мг в сутки.
Лечение новорожденных. Наиболее эффективные схемы лечения врожденно го токсоплазмоза у новорожденных включают препараты пириметамина (тин дурин, дараприм, хлоридин) и сульфаниламиды короткого действия. Пириме тамин применяют в дозе 1 мг/кг в сутки, сульфаниламиды короткого действия
— 0,1 г/кг в сутки. Цикл терапии рекомендуют проводить в течение 5–7 дней. Курс лечения включает 3 цикла терапии с перерывами между ними 7–14 дней. Возможно применение комбинированных препаратов (фансидар). Назначение пириметамина и сульфаниламидов комбинируют с препаратами фолиниевой кислоты (лейковарин).
Менее токсичны, однако уступающие по эффективности при лечении врожденного токсоплазмоза, антибиотики группы макролидов. Спирамицин назначают в дозе 150 000–300 000 ЕД/кг в сутки на 2 приема в течение 10 дней. Возможно применение рокситромицина (рулида) в дозе 5–8 мг/кг в сутки, азитромицина (сумамеда) в дозе 5 мг/кг в сутки в течение 7–10 дней.
Профилактика включает неспецифические и специфические меры. К неспецифическим мерам относятся общегигиенические нормы, запрещающие употребление в пищу термически необработанных мясных продуктов, немытых овощей и фруктов, меры предосторожности при контакте с домашними животными и т. д.
606

Раздел V. Инфекционные заболевания, специфические для перинатального периода
Специфические меры заключаются в серологическом обследовании женщин до и во время беременности. При первичном инфицировании во время беременности женщине назначают лечение.
ГЛАВА 9. НЕОНАТАЛЬНЫЙ (ДИССЕМИНИРОВАННЫЙ) ЛИСТЕРИОЗ
Этиология. Возбудителем заболевания является Listeria monocytogenes, пред ставляющий собой грамположительный аэробный микроорганизм размером 0,5–0,6 мкм. Листерии устойчивы во внешней среде, они длительно сохраняют ся в испражнениях, почве, зерне, способны размножаться при температуре +4...+6 °С, однако быстро погибают при нагревании и под воздействием дезин фицирующих средств.
Эпидемиология. Листериоз встречается во всех странах мира. Резервуар ин фекции в природе — многие виды грызунов, преимущественно мышевидных. Основной путь инфицирования — алиментарный, при употреблении в пищу за грязненных листериями продуктов. Меньшее значение имеет возможность ин фицирования вследствие контакта с больными домашними животными. При возникновении инфекции во время беременности возможны трансплацентар ная передача возбудителя и внутриутробное инфицирование плода. Транспла центарная передача вируса приводит к развитию генерализованной формы ли стериоза у плода. Существует теория, согласно которой внутриутробное инфи цирование листериозом чаще происходит при реактивации во время беремен ности латентной инфекции.
Клиника листериоза у беременных. Острые формы заболевания характеризу ются внезапным началом, ознобом, повышением температуры тела, увеличени ем лимфатических узлов, наличием общеинтоксикационных симптомов. Забо левание часто протекает с эритематозной или крупнопятнистой сыпью, концен трирующейся в области крупных суставов. Возможно появление на лице эри темы в форме бабочки. В клинике листериоза на первый план могут выступать признаки поражения ЦНС (менингоэнцефалит), острого гастроэнтероколита, пиелита, эндокардита.
У некоторых женщин за несколько недель до родов отмечались повышение температуры тела неясного генеза, мышечная боль, озноб, иногда тонзиллит или гнойный конъюнктивит.
Врожденный листериоз характеризуется тяжелым течением. У новорожден ных развивается генерализованная инфекция с образованием специфических гранулем в различных органах. Антенатальное инфицирование может приводить к внутриутробной гибели плода, невынашиванию. При инфицировании ново рожденного во время родов клинические признаки заболевания появляются че рез 1–2 нед после рождения. Основные проявления заболевания: повышение температуры тела, заложенность носа, признаки дыхательной недостаточности. Пневмония при листериозе чаще носит интерстициальный характер, может ос ложняться развитием гнойного плеврита. У большинства больных наблюдают
607
