
- •230400 «Информационные системы и технологии », 100100 «Сервис»
- •Введение
- •1. Программа курса «химия»
- •3. Задания и методические указания к их выполнению
- •3.1. Строение атома. Периодическая система элементов
- •3.1.1. Методические указания
- •Контрольные задания:
- •3.2. Химическая связь
- •3.2.1. Методические указания
- •3.2.2. Контрольные задания:
- •3.3. Химическая кинетика и равновесие
- •3.3.1.Методические указания
- •3.3.2.Контрольные задания:
- •3.4. Химическая термодинамика
- •3.4.1. Методические указания
- •3.4.2. Контрольные задания:
- •3.5. Растворы. Способы выражения концентрации растворов. Свойства растворов
- •3.5.1. Методические указания
- •3.5.2. Контрольные задания
- •3.6. Гидролиз солей
- •3.6.1. Методические указания
- •3.6.2. Контрольные задания:
- •3.7. Окислительно-восстановительные реакции
- •3.7.1. Методические указания
- •3.7.2. Контрольные задания:
- •3.8. Электродные потенциалы. Гальванические элементы, аккумуляторы
- •3.8.1. Методические указания
- •3.8.2. Контрольные задания:
- •3.9. Электролиз
- •3.9.1. Методические указания
- •3.9.2. Контрольные задания:
- •3.10. Коррозия металлов и сплавов
- •3.10.1 Методические указания
- •3.10.2 Контрольные задания:
- •347383, Г. Волгодонск, Ростовской обл., пр. Мира, 16,
Контрольные задания:
1.Приведите электронные формулы элементов с порядковыми номерами 14 и 23. Укажите электронное семейство. Валентные электроны распределите по квантовым ячейкам и определите значения квантовых чисел n, l, ml, ms для них.
2.Приведите электронные формулы элементов с порядковыми номерами 15 и 24. Укажите электронное семейство. Валентные электроны распределите по квантовым ячейкам и определите значения квантовых чисел n, l, ml, ms для них.
3.Приведите электронные формулы элементов с порядковыми номерами 16 и 25. Укажите электронное семейство. Валентные электроны распределите по квантовым ячейкам и определите значения квантовых чисел n, l, ml, ms для них.
4 – 6. Объясните изменение первой энергии ионизации в указанном ряду атомов элементов. Составьте полные электронные формулы атомов элементов, покажите распределение валентных электронов по квантовым ячейкам:
№ п/п |
Элемент |
||
Первая энергия ионизации, эВ
|
|||
4 |
C
|
Si |
Ge |
11,26 |
8,15 |
7,88 |
|
5 |
Al
|
Si |
P |
5,98
|
8,15 |
10,55 |
|
6 |
N
|
P |
As |
14,54
|
10,55 |
9,81 |
|
7 – 9. Объясните изменение радиуса в указанном ряду атомов элементов. Составьте электронные формулы атомов элементов, покажите распределение валентных электронов по квантовым ячейкам:
№ п/п |
Элемент
|
||
Атомный радиус, r.1010, м
|
|||
7 |
Na |
Mg
|
Al |
1,89 |
1,60
|
1,43 |
|
8 |
Sc |
Ti
|
V |
1,64 |
1,46
|
1,34 |
|
9 |
N |
P
|
As |
0,71 |
1,30
|
1,48 |
|
10. Приведите электронные формулы атомов элементов Al, S, Fe и их ионов Al3+, S2-, Fe2+, Fe3+. Какой из ионов Fe2+ или Fe3+ более устойчив? Почему?
3.2. Химическая связь
3.2.1. Методические указания
Атомы большинства химических элементов существуют в природе в виде соединений с другими атомами или себе подобными – молекул, ионов, радикалов и т.п. При взаимодействии атомов между ними образуется химическая связь, причиной образования которой является выделение энергии атомарной системой и занятием более устойчивого состояния молекулярной системой с меньшим запасом энергии. В результате образования химической связи атомы приобретают завершенную (устойчивую) восьмиэлектронную структуру валентного слоя.
Различают ковалентную, ионную, водородную и металлическую связь. Кроме того, между молекулами возникают различного рода межмолекулярные взаимодействия – диполь-дипольные, ион-дипольные и другие, в частности, с образованием супрамолекулярных систем.
Ковалентная связь возникает вследствие перекрывания орбиталей атомов с неспаренными электронами с антипараллельными спинами с образованием в межъядерном пространстве общей электронной пары. Она характеризуется длиной связи, энергией связи и кратностью (порядком) связи; обладает характерными свойствами – направленности, насыщаемости и полярности.
Насыщаемость связи определяется числом неспаренных электронов на валентном слое атома элемента как в невозбужденном, так и во всех возможных возбужденных состояниях.
Например, атом фосфора может проявлять переменную валентность
15Р 1s2 2s2 2p 63s2 3p3
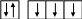 1
1
15 Р Р(111) - число неспаренных электронов 3
3s2 3p3
В возбуждённом состоянии
Р(V)
– число неспаренных электронов 5
3s1 3p3 3d1
В соответствии с этим фосфор может образовывать 3 или 5 химических связей.
Направленность ковалентной связи объясняется наибольшим перекрыванием валентных орбиталей в направлении ориентации их в пространстве.
При взаимодействии атомов элементов с различной электроотрицательностью общая электронная пара смещается к атому элемента с большей электроотрицательностью, что приводит к образованию полярной связи. Чем больше разница электроотрицательностей атомов элементов, тем более полярна связь.
Ионная связь рассматривается как предельный случай полярной ковалентной связи между противоположно заряженными ионами вследствие их электростатического взаимодействия. Этот тип связи возможен между атомами типичных металлов и типичных неметаллов.
Донорно-акцепторная связь образуется за счет перекрывания орбиталей со спаренными электронами одного атома (донора) и свободных орбиталей другого атома (акцептора) с образованием общей электронной пары в межъядерном пространстве.
Возникновение водородной связи обусловлено уникальностью строения атома элемента водорода, обладающего одним протоном в ядре и одним электроном на атомной орбитали. В соединениях водорода с элементами с очень большой электроотрицательностью происходит смещение электрона от водорода к электроотрицательному элементу с образованием катиона водорода Н+, т.е. образуется «голый» протон, обладающий очень большой поляризующей способностью. При электростатическом взаимодействии между ионом водорода одной молекулы и электроотрицательным атомом этой же или другой молекулы образуется специфическая связь, называемая водородной. Вещества, обладающие водородной связью, являются слабыми электролитами, молекулы их связаны в ассоциаты от нескольких штук до нескольких тысяч, имеют повышенную температуру кипения и т.п. по сравнению со своими аналогами.
Ковалентная связь между атомами описывается методами валентных связей или молекулярных орбиталей. Каждый из них имеет свои достоинства и недостатки
Метод молекулярных орбиталей исходит из того, что при перекрывании определенного числа атомных орбиталей образуются молекулярные орбитали, причем половина из них обладают меньшей энергией, их называют связывающими, а другая половина – большей энергией, их называют разрыхляющими. Заполнение молекулярных орбиталей электронами происходит по тем же правилам и принципам, что и атомных орбиталей.
Пример.
Используя метод молекулярных орбиталей, объясните различные значения энергии и длины связи в частицах F2 и F2+; объясните их магнитные свойства.
Решение.
Процесс образования частицы F2 можно представить записью:
F1s22s22p5 + F1s22s22p5 F2(1s)2(1s)2(2s)2(2s)2(2px)2(2py)2(2pz)2(2py)2(2pz)2
Перекрывание 1s-атомных орбиталей приводит к заполнению (1s)-связывающей и (1s)-разрыхляющей молекулярных орбиталей одинаковым числом (2) электронов с антипараллельными спинами, что не влияет на энергию связывающих орбиталей и в дальнейшем может не учитываться. В молекуле F2 имеется избыток двух связывающих электронов, что соответствует одинарной связи или порядку связи n, равному единице. Порядок связи (n) рассчитывается по формуле: Nсв - N 10 - 8
n = ----------------- = ------------ = 1,
2 2
Где Nсв - количество связывающих электронов,
N - количество разрыхляющих электронов.
В молекуле F2 все электроны на связывающих и разрыхляющих молекулярных орбиталях спарены, поэтому частица не обладает магнитными свойствами, т.е. диамагнитна.
Энергетическая диаграмма образования молекулы F2 представлена на рисунке.

Процесс образования частицы F+2 можно представить записью:
F1s22s22p5 + F+1s22s22p4 F2(1s)2(1s)2(2s)2(2s)2(2px)2(2py)2(2pz)2(2py)2(2pz)1
В молекулярном ионе F2+ имеется избыток трех связывающих электронов, что соответствует порядку связи 1,5.

Уменьшение числа разрыхляющих электронов приводит к упрочнению связи, увеличению энергии связи и уменьшению межъядерного расстояния, т.е. длины связи. В молекулярном ионе F2+ имеется один неспаренный электрон на молекулярной орбитали, поэтому частица обладает магнитными свойствами – парамагнитна.
