
- •2 Розрахункова частина
- •2.1 Розрахунок середньої якості збагаченої вугільної шихти
- •2.2 Розрахунок матеріального балансу коксування вугілля
- •2.3 Розрахунок виробничої потужності коксового цеху по переробцівугільної шихти
- •2.4 Розрахунок виробничої потужності цеху вловлювання хімічних продуктів коксування
- •2.5 Розрахунок виробництва коксової продукції
- •2.6 Матеріальні і теплові розрахунки
- •Конструктивні розрахунки обладнання
2.5 Розрахунок виробництва коксової продукції
(% від валового)
Доменного коксу92
Коксовий горішок 2
Коксова дрібнота 6
Реальну виробничу потужність коксового цеху по переробці збагаченої вугільної шихти підраховано раніше вона дорівнює 1446896 т/рік. Річне виробництво сухого валового коксу з сухої вугільної шихти визначаємо заформулою:
ПКсв=КШсв*(Вк/100) т/р
Підрахуємо виробництво сухого валового коксу
ПКсв=1586092*(78,23/100)=1240800т/р
Виробництво коксу перерахуємо у 6% вологості
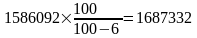 т/р
т/р
Розрахуємо річне виробництво коксової продукції, одержаної при розсіві сухого валового коксу
Річне виробництво сухого доменного коксу
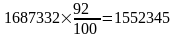 т/р
т/р
Виробництво доменного коксу перерахуємо до 4% вологості
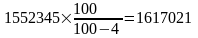 т/р
т/р
Річне виробництво коксового горішка (у сухій вазі)
 т/р
т/р
Річне виробництво коксової дрібноти (у сухій вазі)
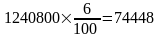 т/р
т/р
Отримані данні зводимо у таблицю 2.5
Таблиця 2.5- Виробництво коксової продукції (у сухій вазі)
-
№
Найменування коксової продукції
По цеху
1
2
3
Доменний кокс >25мм
Коксовий горішок 10-25мм
Коксова дрібнота 0-10мм
1552345
24816
74448
Разом сухого валового коксу
1651609
2.6 Матеріальні і теплові розрахунки
2.6.1. Розрахунок горіння газу.
Елементарний склад опалювального газу приймаємо за звітом коксового цеху за попередній рік.
Таблиця 2.6- Елементарний склад коксового газу.
-
Складові газу
% обсягу
Н2
60,6
СН4
25,6
Н2S
0,3
СО
5,7
N2
1,9
СО2
2,8
СmНn
2,3
О2
0,8
Разом
100,0
Склад повітря: азот 79%, кисень 21%, разом 100%
При повному зпаленні опалювального газу повністю зпалювати, всі його горючі складові, для цього повітря, необхідно подавати в більший кількості чим необхідно по реакції запалення, з надлишком.
Розрахунок витрат повітря на теоретичне спалення газу:
По прийнятому складу повітря підраховуємо кількість сухого повітря, яке приходиться на 1м3 кисню
100 : 21 = 4,762м3 повітря/1м3 кисню
По стехіометричних співвідношеннях реакцій горіння підраховуємо кількість кисню, а потім і повітря, необхідно для спалення кожного компонента опалювального газу.
Підрахуємо цю кількість по реакції горіння сірководня:
Н2S+ 1.5 02 = S02 + Н20
Складемо пропорцію:
Для горіння 1 обсягу Н2S потребує 1,5 обсягів кисню, а для 0,3 - невідомо.
Відкіля:
Х=0,3*1,5/1=0,45обсягів кисню
Необхідно 0,45 обсягів кисню містимуться в наступній кількості сухого повітря:
0,45 * 4,762 = 2,243 обсягів повітря Окрім кисню в цій кількості газу
вміститься азоту
2,243 - 0,45 = 1,793 обсягів азоту
Підрахуємо кількість кисню по реакції горіння водню:
Н2 + 0,5 02 = Н20
Для горіння 1 обсягу водню потребує 0,5 обсягу кисню, а для 60,6 - невідомо
Відкіля: (60,6*0,5)/1=30,3 обсяг кисню
Необхідні 30,3 обсягів 02 будуть міститися в наступної кількості повітря
30,3 * 4,762 = 144,3 обсягів повітря окрім кисню у цій кількості газу міститься азоту
144,3 - 30,3 =114 обсягів азоту.
Підрахуємо кількість кисню по реакції горіння метану:
СН4 + 202 = С02 + 2Н20
Для горіння 1 обсягу метану потребує 2 обсяги кисню, а для 25,6 - невідомо.
Відкіля: 25,6*2/1= 51,2 обсягу кисню
Необхідні 51,2 обсягу кисню будуть міститися в наступної кількості повітря
51,2 * 4,762 = 243,8 обсягів повітря Окрім кисню в цій кількості газу міститься азоту: 243,8-51,2 = 192,6 . Підрахуємо кількість кисню по реакції горіння СО:
СО + 0,5О2 = СО2 Складемо пропорцію: для горіння 1 обсягу СО потребує 0,5 обсягів кисню, а для 5,7 - невідомо
Відкіля: х = 5,7*0,5/1= 2,85 обсягів кисню
Необхідні 2,85 обсягів кисню міститимуться в наступній кількості сухого повітря: 2,85 * 4,762 = 13,57 обсягів повітря
Окрім кисню в цій кількості газу вміститься азоту:
13,57 - 2,85 = 10,72 обсягів азоту.
Підрахуємо кількість кисню по реакції горіння СМНП:
СМНП = 3,2 02 = 2,23 С02 +2,17 Н20
Складемо пропорцію: для горіння 1 обсягу СМНП потребує 3,2 обсягів кисню, а для 2,3 - невідомо.
Відкіля: 1 – 3,315
2,3 – Х
Х=(3,2*2,3)/1=7,36 обсягів кисню
Необхідно 7,36 обсягів кисню будуть міститися в наступній кількості повітря
7,36 * 4,762 = 35,05 обсягів повітря
Окрім кисню в цій кількості газу міститься азоту:
35,05 - 7,36 = 27,69 обсягів азоту
Розрахунок горіння складових виконуємо у вигляді таблиці2.7.
Таблиця 2.7- Розрахунок горіння газу.
-
Складо-ва
Реакція горіння
Склад газу
Витрати
О2
N2
Повіт-ря
1
2
3
4
5
6
Н2
Н2+0,5О2=Н2О
60,6
30,3
114,0
144,3
СН4
СН4+2О2= СО2+ 2Н2О
25,6
51,2
192,6
243,8
Н2S
Н2S+1,5 О2= S О2+ Н2О
0,3
0,45
1,793
2,243
СО
СО+0,5 О2= СО2
5,7
2,85
10,72
13,57
1
2
3
4
5
6
N2
Не горить
1,9
-
-
-
СО2
Не горить
2,8
-
-
-
СmНn
СmНn+3,315О2=2,23
СО2+2,17 Н2О
3,2
7,36
27,69
35,05
О2
Не горить
0,8
-
-
-
Разом витрати повітря
100,0
92,4
347,7
440,10
Витрати повітря по кисню газу
-0,8
-3,01
-3,810
Витрати повітря на теоретичне горіння
91,6
344,7
436,29
Таким чином на згорання газу необхідно слідуючи кількість повітря (теоретично):
на 100 м3 на 1 м3
газу газу
Повітря всього: 436,293 4,36 в тому числі:
кисню 91,6 0,92
азоту 344,693 3,45
Розрахунок продуктів горіння, отриманих при теоретичному горінні газу. Кількість продуктів горіння підраховуємо по стехіометричнимспіввідносинамреакції горіння складових газу. Для горіння підраховуємо слідуючим чином:
Н2S+ 1,5 02 = S02 + Н20
Складаємо пропорцію:
При згоранні 1 обсяг Н2S утворюється 1 обсяг S02 і 1 обсяг Н20 при згоранні 0,3 Н2S утворюється:
Х-S02 та У- Н20
Відкіля
Х=1*0,3/1=0,3 обсягS02
У=1*0,3/1=0,3 обсяг Н20
При згоранні 1 обсягу Н2 утворюється 1 обсяг Н20
Н2+0,5О2=Н2О
При згоранні 60,6 водню утворюється Х води.
Відкіля:
Х=1*60,6/1=60,6 обсягу води
Для горіння метану продукти горіння підраховуємо наступним чином:
СН4+2О2= СО2+ 2Н2О
При згоранні 1 обсягу метану утворюється 1 обсяг СО2 і 2 обсяги Н2О
При згоранні 25,6 обсягів метану утворюється Х СО2 та У Н2О
Відкіля:
Х=1*25,6/1=25,6 обсягу СО2
У=1*25,6/1=51,2 обсягу Н2О
При згоранні 1 обсягу СО утворюється 1 обсяг СО2, при згоранні 5,7 обсягу СО утворюється Х-СО2
Відкіля:
Х=1*5,7/1=5,7 обсягу СО2
При згоранні 1 обсягу СmНn утворюється 2,23 обсягу СО2 та 2,17 обсягу Н2О
При згоранні 2,3 обсягу СmНn утворюється Х - СО2 та У - Н2О
Відкіля:
Х=2,23*2,3/1=5,13 обсягу СО2
У=2,17*2,3/1=5,0 обсягу Н2О
Отримані данні заносимо до таблиці 3.8.
Таблиця 2.8- Горіння газу
-
Скла-дова
Реакція горіння
Склад
газу
СО2
S02
Н2О
О2
N2
Н2
Н2+0,5О2=Н2О
60,6
60,6
СН4
СН4+2О2= СО2+ 2Н2О
25,6
25,6
51,2
Н2S
Н2S+1,5О2= S О2+ Н2О
0,3
0,3
0,3
СО
СО+0,5 О2= СО2
5,7
5,7
N2
Не горить
1,9
1,9
СО2
Не горить
2,8
2,8
СmНn
СmНn+3,315О2=
2,23 СО2+2,17 Н2О
2,3
5,13
5,0
О2
Не горить
0,8
0,8
Разом продуктів горіння
100,0
39,2
0,3
117,1
0,8
0,9
При реальному горінні газу в продукти горіння добавиться:
1,9 м3 азот з газу
436,293 азот з повітрям при теоритичному горінні
невідома кількість кисню і азоту пропорційна прийнятому коефіцієнту повітря
Приймаємо коєфіцієнт надлишку повітря рівним L=1,22.
При такому надлишку на згорання 100 м3 газу в продукти горіння добавиться наступна кількість (м3):
Кисню 91,6*(1,22-1)=20,15
Азоту 344,693*(1,22-1)
Таким чином, склад продуктів горіння при реальному згоранні газу отримаємо наступним:
1. 597,3-100%
39,23-х %(СО2)=39,23*100/597,3=6,57%
2. 597,3-100
0,3-х %(S02)=0,3-100/597,3=0,05%
3. 597,3-100
117,1-х %(Н2О)=117,1*100/597,3=19,60%
4. 597,3-100
2015-х %(О2)=20,15*100/597,3=3,37%
5. 597,3-100
420,52-х %(N2)=420,52*100/597,3=70,4%
Таблиця 2.9- Склад продуктів горіння
Назва газу |
формула |
М3 |
% обсягу |
Вуглекислий газ Сірчаний газ Водяна пара Кисень Азот |
СО2 SО2 Н2О О2 N2 |
39,23 0,3 117,1 20,15 344,693+75,83=420,52 |
6,57 0,05 19,61 3,37 70,4 |
Разом продуктів горіння |
|
597,3 |
100,0 |
Перевіримо величину прийнятого коевіціенту надлишку повітря:
Lповітря=1+0,42(О2/СО2)=1+0,42(3,37/5,57)=1,22
