
- •Предмет аналитической химии. Методы аналитической химии, значение, требования к химическому анализу.
- •Сущность титриметрического метода анализа. Классификация титриметрических методов по характеру протекающей реакции
- •Требования к реакциям, применяемым в титриметрии. Приемы титрования (прямое, обратное, по заместителю).
- •Инструментальная погрешность (абсолютная и относительная). Точность представления результатов, значащие цифры. Воспроизводимость и правильность результатов анализа.
- •Способы выражения концентрации растворов (ω, с, Сн, т, та/в)
- •7.Рабочие и стандартные растворы в кислотно-основном титровании. Способы приготовления стандартных и рабочих растворов
- •8. Требования к стандартным веществам. Стандартизация растворов
- •9 И 10. Электролитическая диссоциация. Степень диссоциации. Ионная сила раствора
- •11. Ионное произведение воды
- •12. Принцип Ле-Шателье. Влияние одноименных ионов на равновесие диссоциации слабых электролитов
- •13.Расчёт концентраций ионов водорода и рН в растворах слабых кислот и оснований.
- •14.Ступенчатая диссоциация слабых многоосновных кислот, расчёт равновесных концентраций ионов, степени диссоциации и рН раствора.
- •16. Гидролиз солей; расчет константы гидролиза, равновесных концентраций ионов, степени гидролиза и рН раствора.
- •17. Буферные растворы. Расчет равновесных концентраций ионов и рН раствора.
- •18.Расчет pH буферного раствора при добавлении небольших количеств сильных кислот или сильных оснований.
- •19.Кривые титрования – основные этапы построения для случая титрования сильной к-ты щелочью.
- •20. Титрование тетрабората натрия соляной кислоты: особенности протекания р-и и приготовления р-ров.
- •1.Приготовление буры
- •21.Основные этапы расчёта кривых титрования и особенности этих кривых для титрования слабой кислоты щёлочью.
- •4.После т.Экв.
- •22. Классификация индикаторов. Кислотно-основные индикаторы. Теории, объясняющие изменение их окраски(ионная, хромофорная, ионно-хромофорная теории).
- •23. Интервал перехода окраски индикатора (вывод формулы) и показатель титрования (на примере метилоранжа, метилового красного, ф-ф).
- •24. Выбор индикатора при кислотно-основном титровании. Индикаторные ошибки титрования.
19.Кривые титрования – основные этапы построения для случая титрования сильной к-ты щелочью.
Кривая титрования – графич.зависимость рН титруемого р-ра от кол-ва добавлен.титранта(кол-ва, %,V).
Vэкв(щ)=
0% по кислоте находим С.
До 100% находим n
n/Vобщ=С
Кривые титрования строятся для того, чтобы правильно выбрать индикатор, проследить изм.рН р-ра в различные моменты титрования, изучить влияние t и C .
Скачок титрования – это резкое изменение рН вблизи точки экв(граница скачка 99,9-100,1%)
20. Титрование тетрабората натрия соляной кислоты: особенности протекания р-и и приготовления р-ров.
1.Приготовление буры
Взвешенную в бюксе буру через сухую воронку переносят в колбу. Через ту же воронку добавляют на 1/3 объема колбы горячей дистиллированной воды и круговыми движениями перемешивают раствор до полного растворения кристаллов. колбу охлаждают до комнатной температуры и доводят объем полученного раствора холодной дистиллированной водой до метки. Колбу закрывают пробкой, и раствор тщательно перемешивают
Рассчитывают концентрацию приготовленного раствора

2.Приготовление соляной к-ты
Мерным цилиндром отбирают нужное количество (мл) 36 % раствора соляной кислоты, переносят в склянку и разбавляют дистиллированной водой до объема 500 мл.
3.Титрование
Титрование тетрабората натрия соляной кислотой можно представить следующим уравнением:
Na2B4O7 + 2HCl +5H2O → 2NaCl + 4H3BO3
2Na+ + B4O72– + 2H+ + 2Cl– +5H2O → 2Na+ + 2Cl– +4H3BO3
B4O72– + 2H+ +5H2O → 4H3BO3
Тетраборат натрия – это соль, образованная катионом сильного основания и анионом слабой кислоты, поэтому ее раствор имеет сильно щелочную реакцию.
Титрование ведут в присутствии индикатора метилового красного, интервал перехода которого 4,4 – 6,2.
21.Основные этапы расчёта кривых титрования и особенности этих кривых для титрования слабой кислоты щёлочью.
1.
0%
- x=
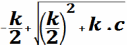
2. до т.экв - найти Vэкв(щ)
х=
С0=n/Vобщ (n=Cк-ты*Vк-ты- Сщ*V)
3.В колбе в т.экв.=соль+вода
Х=
4.После т.Экв.
Соль в щ.р-ре гидролизоваться не будет т.к. в результате гидролиза среда щелочная, мы добавляя щ. мы ув. С(ОН), поэтому по принципу Ле-Шателье гидролиз подавляется.
Считается по изб.щелочи.
22. Классификация индикаторов. Кислотно-основные индикаторы. Теории, объясняющие изменение их окраски(ионная, хромофорная, ионно-хромофорная теории).
1.Кислотно-основные (метилоранж., лакмус,ф-ф)
2.Окислительно-восстановительные(меняются в зависимости от измен.потенциала среды)
3.Комплексонометрические (реагирующие на изменение рК)
4.Адсорбционный(реагирует на изм.С ионов. осаждаемых в виде малорастворимых соединений.)
Теории:
1.Ионная
Согласно теории КО индикаторы представляют собой органич.к-ты или основания, которые в водных р-рах обратимо дисоц.на ионы.
HInd H++Ind-
H++Ind-
Kинд=
Т.к.Кинд явл.постоянной в-ной, то + в р-р к-ты приведёт к ув-ю Н+ и сдвига равновесия в обратимую сторону.
2.Хромофорная
Согласно теории в процессе изменения рН р-ра происходит изменение молекул индикатора. Окраска соединений связано с наличием в их молекуле хромофорных групп и ауксохромных.
(-NHR , которые влияют на окраску инд-ра присоед. или отщепл. Н+ вызывает перестройку мол-л инд-ра, что приводит к появлению или исчезнов. хромофорных групп, что отражается на окраске инд-ра, если хромофорные группы превращ.в неполярные- окраска исчезает.)
3.Ионно-хромофорная
Согласно ей в р-рах кислот.-основн.индикаторов имеет место равновесия обусловлнные диссоциацией молекул и связанных с внутримолекулярными перегруппировками одних форм индикат. в др.
