
- •Предмет аналитической химии. Методы аналитической химии, значение, требования к химическому анализу.
- •Сущность титриметрического метода анализа. Классификация титриметрических методов по характеру протекающей реакции
- •Требования к реакциям, применяемым в титриметрии. Приемы титрования (прямое, обратное, по заместителю).
- •Инструментальная погрешность (абсолютная и относительная). Точность представления результатов, значащие цифры. Воспроизводимость и правильность результатов анализа.
- •Способы выражения концентрации растворов (ω, с, Сн, т, та/в)
- •7.Рабочие и стандартные растворы в кислотно-основном титровании. Способы приготовления стандартных и рабочих растворов
- •8. Требования к стандартным веществам. Стандартизация растворов
- •9 И 10. Электролитическая диссоциация. Степень диссоциации. Ионная сила раствора
- •11. Ионное произведение воды
- •12. Принцип Ле-Шателье. Влияние одноименных ионов на равновесие диссоциации слабых электролитов
- •13.Расчёт концентраций ионов водорода и рН в растворах слабых кислот и оснований.
- •14.Ступенчатая диссоциация слабых многоосновных кислот, расчёт равновесных концентраций ионов, степени диссоциации и рН раствора.
- •16. Гидролиз солей; расчет константы гидролиза, равновесных концентраций ионов, степени гидролиза и рН раствора.
- •17. Буферные растворы. Расчет равновесных концентраций ионов и рН раствора.
- •18.Расчет pH буферного раствора при добавлении небольших количеств сильных кислот или сильных оснований.
- •19.Кривые титрования – основные этапы построения для случая титрования сильной к-ты щелочью.
- •20. Титрование тетрабората натрия соляной кислоты: особенности протекания р-и и приготовления р-ров.
- •1.Приготовление буры
- •21.Основные этапы расчёта кривых титрования и особенности этих кривых для титрования слабой кислоты щёлочью.
- •4.После т.Экв.
- •22. Классификация индикаторов. Кислотно-основные индикаторы. Теории, объясняющие изменение их окраски(ионная, хромофорная, ионно-хромофорная теории).
- •23. Интервал перехода окраски индикатора (вывод формулы) и показатель титрования (на примере метилоранжа, метилового красного, ф-ф).
- •24. Выбор индикатора при кислотно-основном титровании. Индикаторные ошибки титрования.
14.Ступенчатая диссоциация слабых многоосновных кислот, расчёт равновесных концентраций ионов, степени диссоциации и рН раствора.
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся кол.
При диссоциации слабого электролита по нескольким стадиям для каждой можно записать свою константу.
Каждая последующая стадия характеризуется меньшей константой. Так К1>K2>K3.

16. Гидролиз солей; расчет константы гидролиза, равновесных концентраций ионов, степени гидролиза и рН раствора.
Гидролиз
– это взаимодействие соли с водой
приводящее к образованию слабого
электролита.
Примером
гидролиза может служить взаимодействие
хлорида фосфора с водой. В результате
этой реакции образуются фосфористая
кислота и соляная кислота :
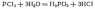 В случае реакций нейтрализации,
в которых участвуют слабые кислоты и
основания, реакции протекают не до
конца. Значит при этом в той или иной
степени протекает и обратная реакция
(взаимодействие соли с водой), приводящая
к образованию кислоты и основания. Это
и есть гидролиз соли.
В
реакции гидролиза вступают соли,
образованные слабой кислотой и слабым
основанием, или слабой кислотой и сильным
основанием, или слабым основанием и
сильной кислотой. Соли, образованные
сильной кислотой и сильным основанием,
гидролизу не подвергаются; нейтрализация
в этом случае сводится к процессу:
В случае реакций нейтрализации,
в которых участвуют слабые кислоты и
основания, реакции протекают не до
конца. Значит при этом в той или иной
степени протекает и обратная реакция
(взаимодействие соли с водой), приводящая
к образованию кислоты и основания. Это
и есть гидролиз соли.
В
реакции гидролиза вступают соли,
образованные слабой кислотой и слабым
основанием, или слабой кислотой и сильным
основанием, или слабым основанием и
сильной кислотой. Соли, образованные
сильной кислотой и сильным основанием,
гидролизу не подвергаются; нейтрализация
в этом случае сводится к процессу: а
обратная реакция — диссоциация молекулы
воды на ионы — протекает в ничтожно
малой степени.
а
обратная реакция — диссоциация молекулы
воды на ионы — протекает в ничтожно
малой степени.
1.
Рассмотрим гидролиз соли, образованной
одноосновной кислотой и одновалентным
металлом. В качестве примера возьмем
ацетат натрия — соль слабой кислоты и
сильного основания. Уравнение гидролиза
этой соли имеет вид
Уравнение
показывает, что в данном случае гидролизу
подвергается анион соли и что реакция
сопровождается образованием ионов  .
Но поскольку ионное произведение
воды [
.
Но поскольку ионное произведение
воды [ ]
[
] —
величина постоянная, то при накоплении
ионов
концентрация
ионов водорода уменьшается. Следовательно,
растворы солей, образованных слабой
кислотой и сильным основанием, имеют
щелочную реакцию.
]
[
] —
величина постоянная, то при накоплении
ионов
концентрация
ионов водорода уменьшается. Следовательно,
растворы солей, образованных слабой
кислотой и сильным основанием, имеют
щелочную реакцию.
2. Аналогично в случае соли, образованной слабым основанием и сильной кислотой, гидролизу подвергается катион соли и реакция сопровождается образованием ионов , например

Накопление
ионов
приводит
к уменьшению концентрации ионов .
Таким образом, растворы
солей, образованных слабым основанием
и сильной кислотой, имеют кислую реакцию.
.
Таким образом, растворы
солей, образованных слабым основанием
и сильной кислотой, имеют кислую реакцию.
В рассмотренных случаях гидролизу подвергается не все количество находящейся в растворе соли, а только часть его. Иначе говоря, в растворе устанавливается равновесие между солью и образующими ее кислотой и основанием. Доля вещества, подвергающаяся гидролизу, — степень гидролиза — зависит от константы этого равновесия, а также от температуры и от концентрации соли.
Запишем
уравнение гидролиза в общем виде. Пусть
НА — кислота, МОН — основание, МА —
образованная ими соль. Тогда уравнение
гидролиза будет иметь вид: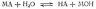
Этому равновесию отвечает константа:

Концентрация воды в разбавленных растворах представляет собою практически постоянную величину. Обозначая

получим:

Величина  называется
константой гидролиза соли. Ее значение
характеризует способность данной соли
подвергаться гидролизу; чем больше
называется
константой гидролиза соли. Ее значение
характеризует способность данной соли
подвергаться гидролизу; чем больше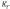 ,
тем в большей степени (при одинаковых
температуре и концентрации соля)
протекает гидролиз.
,
тем в большей степени (при одинаковых
температуре и концентрации соля)
протекает гидролиз.
Для
случая соли, образованной слабой кислотой
и сильным основанием, константа гидролиза
связана с константой диссоциации
кислоты  зависимостью:
зависимостью: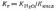
Это
уравнение показывает, что
тем
больше, чем меньше 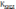 .
Иными словами, чем
слабее кислота, тем в большей степени
подвергаются гидролизу ее соли.
.
Иными словами, чем
слабее кислота, тем в большей степени
подвергаются гидролизу ее соли.
Для
солей, образованных слабым основанием
и сильной кислотой, аналогичное
соотношение связывает константу
гидролиза о константой диссоциации
основания  :
:
Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
Для
солей, образованных слабой кислотой и
слабым основанием, константа гидролиза
связана с константами диссоциации
кислоты и основания следующим
соотношением:
Соотношения, связывающие константу гидролиза с константами диссоциации кислоты и основания, легко получить из выражения константы гидролиза. Выведем первое из них, относящееся к случаю слабой кислоты и сильного основания. Для этого учтем, что основание МОН, от которого образована соль МА, — сильное, т. е. диссоциирует нацело. Поэтому

Сама соль также диссоциирует нацело. Следовательно:

Концентрацию
кислоты, пренебрегая диссоциированной
ее частью, выразим через константу
диссоциации кислоты
: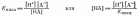
Подставляем
найденные значения концентраций МОН,
МА и НА в выражение константы гидролиза:
Учитывая,
что [
]
[
] ионное
произведение воды, окончательно получим:
Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость от концентрации выражается в том, что с разбавлением раствора степень гидролиза увеличивается. В самом деле, пусть мы имеем, например, раствор цианида калия. В нем устанавливается равновесие

которому
отвечает константа:
