
- •Предмет аналитической химии. Методы аналитической химии, значение, требования к химическому анализу.
- •Сущность титриметрического метода анализа. Классификация титриметрических методов по характеру протекающей реакции
- •Требования к реакциям, применяемым в титриметрии. Приемы титрования (прямое, обратное, по заместителю).
- •Инструментальная погрешность (абсолютная и относительная). Точность представления результатов, значащие цифры. Воспроизводимость и правильность результатов анализа.
- •Способы выражения концентрации растворов (ω, с, Сн, т, та/в)
- •7.Рабочие и стандартные растворы в кислотно-основном титровании. Способы приготовления стандартных и рабочих растворов
- •8. Требования к стандартным веществам. Стандартизация растворов
- •9 И 10. Электролитическая диссоциация. Степень диссоциации. Ионная сила раствора
- •11. Ионное произведение воды
- •12. Принцип Ле-Шателье. Влияние одноименных ионов на равновесие диссоциации слабых электролитов
- •13.Расчёт концентраций ионов водорода и рН в растворах слабых кислот и оснований.
- •14.Ступенчатая диссоциация слабых многоосновных кислот, расчёт равновесных концентраций ионов, степени диссоциации и рН раствора.
- •16. Гидролиз солей; расчет константы гидролиза, равновесных концентраций ионов, степени гидролиза и рН раствора.
- •17. Буферные растворы. Расчет равновесных концентраций ионов и рН раствора.
- •18.Расчет pH буферного раствора при добавлении небольших количеств сильных кислот или сильных оснований.
- •19.Кривые титрования – основные этапы построения для случая титрования сильной к-ты щелочью.
- •20. Титрование тетрабората натрия соляной кислоты: особенности протекания р-и и приготовления р-ров.
- •1.Приготовление буры
- •21.Основные этапы расчёта кривых титрования и особенности этих кривых для титрования слабой кислоты щёлочью.
- •4.После т.Экв.
- •22. Классификация индикаторов. Кислотно-основные индикаторы. Теории, объясняющие изменение их окраски(ионная, хромофорная, ионно-хромофорная теории).
- •23. Интервал перехода окраски индикатора (вывод формулы) и показатель титрования (на примере метилоранжа, метилового красного, ф-ф).
- •24. Выбор индикатора при кислотно-основном титровании. Индикаторные ошибки титрования.
9 И 10. Электролитическая диссоциация. Степень диссоциации. Ионная сила раствора
Сильный электролит: α=1, α=(Спродис/Снач)*100%. К сильным электролитам относят сильные кислоты и т.д.
Степень
диссоциации зависит от концентрации
электролитов, от температуры, от природы
самого электролита(растворителя).

Кажущиеся степень диссоциации- величина, определенная по электропроводности или его коллеготивным св-вом для сильных электролитов. Слабые электролиты: α<1
Коэфициент
активности зависит от ионной силы р-ра,
которая характеризует напряженность
электр.
поля в р-ре. Ионная сила: 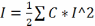
Электролитическая
диссоциация слабых электролитов: 
Активность: а=С*ϒ
11. Ионное произведение воды



 =55,6
моль/л
=55,6
моль/л
Т.к.
диссоциация воды очень маленькая, то
 =const
=const
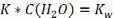
Kw- const ионного произведения воды.

В
чистой воде






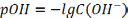

12. Принцип Ле-Шателье. Влияние одноименных ионов на равновесие диссоциации слабых электролитов
Принцип Ле-Шателье: Если на систему находящуюся в состоянии хим. равновесия оказывается какое-либо внешнее воздействие, то равновесие в результате протекания сместится таким образом, чтобы оказанное воздействие уменьшить.
Р авновесие
нарушается при изменении концентрации
одного из участвующих в этом равновесии
ионов: при ее увеличении происходит
процесс, входе которого эти ионы
связываются. Например, если в р-р уксусной
к-ты,
диссоциирующей согласно уравнению
авновесие
нарушается при изменении концентрации
одного из участвующих в этом равновесии
ионов: при ее увеличении происходит
процесс, входе которого эти ионы
связываются. Например, если в р-р уксусной
к-ты,
диссоциирующей согласно уравнению
ввести какую-либо соль этой кислоты и тем самым увеличить концентрацию ионов , то в соответствии с принципом Ле-Шателье, равновесие смещается влево, т.е. степень диссоциации уксусной кислоты уменьшается. Вывод: Введение в р-р слабого электролита одноименных ионов уменьшает степень диссоциации этого электролита.
13.Расчёт концентраций ионов водорода и рН в растворах слабых кислот и оснований.
Слабая кислота диссоциирует согласно следующему уравнению:
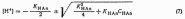

Для точных расчетов в слабых кислотах:
Аналогично для точных расчетов в слабых основаниях:

В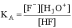 водном растворе слабой кислоты
устанавливается равновесие: HF + H2O
D F– +
H3O+,в
котором участвуют две кислотно-основные
пары: HF/F– и
H3O+/H2O.
Сила кислоты HF количественно характеризуется
ее константой кислотности КА:
водном растворе слабой кислоты
устанавливается равновесие: HF + H2O
D F– +
H3O+,в
котором участвуют две кислотно-основные
пары: HF/F– и
H3O+/H2O.
Сила кислоты HF количественно характеризуется
ее константой кислотности КА:
Ч ем
больше численное значение константы
кислотности, тем сильнее данная кислота
и слабее сопряженное с ней основание.
В общем случае константа кислотности
может быть записана следующим образом:
ем
больше численное значение константы
кислотности, тем сильнее данная кислота
и слабее сопряженное с ней основание.
В общем случае константа кислотности
может быть записана следующим образом:
где [A] и [B] - равновесные концентрации кислоты и сопряженного с ней основания.
Наиболее важной химической характеристикой водного раствора является его водородный показатель pH = - lg [H3O+].
Е сли
в водном растворе присутствует только
рассматриваемая кислота A и ее сопряженное
основание B, то, учитывая, что в состоянии
равновесия [B]=[H3O+],
а также приняв, что равновесная
концентрация [A] в первом приближении
равна исходной концентрации этой
кислоты, то есть [A] » CA,
имеем
сли
в водном растворе присутствует только
рассматриваемая кислота A и ее сопряженное
основание B, то, учитывая, что в состоянии
равновесия [B]=[H3O+],
а также приняв, что равновесная
концентрация [A] в первом приближении
равна исходной концентрации этой
кислоты, то есть [A] » CA,
имеем
П рологарифмируем
это равенство и произведем алгебраические
преобразования:
рологарифмируем
это равенство и произведем алгебраические
преобразования:


К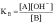 огда
имеем раствор основания B, то в нем
устанавливается равновесие: B + H2O
D A + OH––,
характеризующееся константой основности
огда
имеем раствор основания B, то в нем
устанавливается равновесие: B + H2O
D A + OH––,
характеризующееся константой основности
Чем больше численное значение константы основности, тем это основание сильнее и тем слабее сопряженная с ним кислота. В справочной литературе обычно приводятся только константы кислотности, но поскольку для любой сопряженной кислотно-основной пары произведение константы кислотности на константу основности есть величина постоянная, равная ионному произведению воды то соотношение можно записать следующим образом:


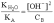
С учетом того, что [A] = [OH–],
а [B] » CB,
имеем:
учетом того, что [A] = [OH–],
а [B] » CB,
имеем:
Откуда
П
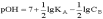 рологарифмировав
это выражение и произведя соответствующие
преобразования, получим:
рологарифмировав
это выражение и произведя соответствующие
преобразования, получим:
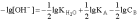


Д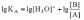

 ля
расчета рН раствора слабой кислоты или
слабого основания можно вывести и другое
выражение, в которое не входит исходная
концентрация С растворенного вещества.
Для этого следует прологарифмировать
выражение (4) и выразить рН раствора
следующим образом:
ля
расчета рН раствора слабой кислоты или
слабого основания можно вывести и другое
выражение, в которое не входит исходная
концентрация С растворенного вещества.
Для этого следует прологарифмировать
выражение (4) и выразить рН раствора
следующим образом:
Данное уравнение выведено, исходя из выражения константы кислотности (1), однако оно пригодно и для вычисления рН раствора основания В, сопряженного с кислотой А, в чем Вы можете убедиться, выведя его из выражения константы основности (6). В дальнейшем будем пользоваться только константами кислотности (К) и их показателями (рК).
