
- •Предмет аналитической химии. Методы аналитической химии, значение, требования к химическому анализу.
- •Сущность титриметрического метода анализа. Классификация титриметрических методов по характеру протекающей реакции
- •Требования к реакциям, применяемым в титриметрии. Приемы титрования (прямое, обратное, по заместителю).
- •Инструментальная погрешность (абсолютная и относительная). Точность представления результатов, значащие цифры. Воспроизводимость и правильность результатов анализа.
- •Способы выражения концентрации растворов (ω, с, Сн, т, та/в)
- •7.Рабочие и стандартные растворы в кислотно-основном титровании. Способы приготовления стандартных и рабочих растворов
- •8. Требования к стандартным веществам. Стандартизация растворов
- •9 И 10. Электролитическая диссоциация. Степень диссоциации. Ионная сила раствора
- •11. Ионное произведение воды
- •12. Принцип Ле-Шателье. Влияние одноименных ионов на равновесие диссоциации слабых электролитов
- •13.Расчёт концентраций ионов водорода и рН в растворах слабых кислот и оснований.
- •14.Ступенчатая диссоциация слабых многоосновных кислот, расчёт равновесных концентраций ионов, степени диссоциации и рН раствора.
- •16. Гидролиз солей; расчет константы гидролиза, равновесных концентраций ионов, степени гидролиза и рН раствора.
- •17. Буферные растворы. Расчет равновесных концентраций ионов и рН раствора.
- •18.Расчет pH буферного раствора при добавлении небольших количеств сильных кислот или сильных оснований.
- •19.Кривые титрования – основные этапы построения для случая титрования сильной к-ты щелочью.
- •20. Титрование тетрабората натрия соляной кислоты: особенности протекания р-и и приготовления р-ров.
- •1.Приготовление буры
- •21.Основные этапы расчёта кривых титрования и особенности этих кривых для титрования слабой кислоты щёлочью.
- •4.После т.Экв.
- •22. Классификация индикаторов. Кислотно-основные индикаторы. Теории, объясняющие изменение их окраски(ионная, хромофорная, ионно-хромофорная теории).
- •23. Интервал перехода окраски индикатора (вывод формулы) и показатель титрования (на примере метилоранжа, метилового красного, ф-ф).
- •24. Выбор индикатора при кислотно-основном титровании. Индикаторные ошибки титрования.
Способы выражения концентрации растворов (ω, с, Сн, т, та/в)
Способы выражения конц. р-ров:
Массовая (процентная) доля – ω, ω%

Молярная концентрация – С

Закон разбавления: nв-ва 1 = nв-ва 2 → С1V1 = C2V2
Нормальная концентрация – Сн – число моль эквивалентов растворенного в-ва 1 г р-ра.
 ,
,
 ,
,
 ,
,

Моль эквивалентов – часть моля, реагирующая с одним молем протонов водорода (кисл-осн р-ция) или с одним молем электронов (ОВР)
Фактор эквивалентности – число, показывающее сколько молей находится в одном эквиваленте в-ва.
Нормальная конц. всегда больше либо равна молярной массе.
 ,
,
 ,
,
 ,
,

Титр – масса растворенного в-ва, которое содержится в 1мл р-ра. Р-р с известной концентрацией называется титрованным р-ром или стандартным. Титрованными р-рами (точной конц) пользуются на лаб практике для определения норм конц других р-ров.
 ,
,

Титр по определяемому в-ву
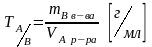 -
титр в-ва А по в-ву В
-
титр в-ва А по в-ву В
7.Рабочие и стандартные растворы в кислотно-основном титровании. Способы приготовления стандартных и рабочих растворов
1-ый способ приготовления станд. р-ров по точной навески станд. в-ва. Для этого рассчитывают массу навески р-ра определенного концентрации и объема. Навеску взвешивают на аналит. весах, затем переносят в мерную колбу нужного объема и после растворения навески доводят до метки дистил. водой. Есть 2 способа количественно перенести навеску: мокрый и сухой. Мокрый закл-ся в том, что взвешенное в-во из бюкса высыпают через воронку в мерную колбу, а остатки в-ва смывают дистил. водой в колбу. Массу в-ва рассчитывают как разницу пустого бюкса и бюкса с в-вом. В сухом способе в-во не вымывается из бюкса, а бюкс с остатками в-ва повторно взвешивают. Массу в-ва рассчитывают как разность между массой пустого бюкса с остатками в-ва и массой полного бюкса.
2-ой способ. Приготовление р-ра из фиксанала. Фиксанал- заполненная ампула, в которой находится точно известное количество запаенного в-ва с точной концентрацией (0,1 моль экв/л). При приготовлении стандарт. р-ра фиксанал разбивается и вымывается или высыпается в мерную колбу через воронку. Ампулу споласкиваем дистил. водой.
3-ий способ. Приготовление станд. р-ра из более концентрированного р-ра. Рассчитанный объем колбы р-ра отмеряют пипеткой и переносят в мерную колбу нужного объема. Если нужно приготовить сразу несколько р-ров, то бюреткой.
Рабочие р-ры готовят с использованием таких же способов, кроме фиксанала, но при этом польз-ся другой посудой и взвешивают на техн. весах. При этом р-ры готовят в склянках. Для измерения объема используют мерные цилиндры и стаканы
8. Требования к стандартным веществам. Стандартизация растворов
Требования: а) они должны иметь кристаллическую структуру
б) состав в-ва должен строго соответствовать формуле
в) в-ва должны быть хим. чистыми, не должно содержаться примеси в таком количестве, в котором они могли бы повлиять на точность анализа (массовая доля примесей не должно превышать 0,05%)
г) в-ва должны быть хим. устойчивыми при хранении ( не должны выветриваться и т.д.)
д) в-во должно иметь как можно большую молекулярную массу, чтобы свести к минимуму погрешность
