
Глава III
Патогенез перитонита
Энтеральная недостаточность
Патогенез перитонита до настоящего времени полностью не изучен. Важнейшим клинико-патогенетическим звеном развития перитонита является энтеральная недостаточность, проявляющаяся угнетением моторно-эвакуаторной функции кишечника. Прогрессирующее растяжение петель кишечника и последующее повышение внутриполостного давления неизбежно приводит к местным и рефлекторным расстройствам, как на органном, так и на системном уровне [Попова Т.С., 1991]. Местное действие этого фактора приводит к нарушению кровообращения, в первую очередь, в венозной системе кишечника, а позднее – в артериальной [Grund K.E., 1980; Zuhlke H.V., 1988]. Возникающие капиллярные стазы и увеличение венозного давления способствуют нарушению всасывания газов и дальнейшему повышению внутрикишечного давления. Когда его величина достигает уровня диастолического давления, прекращается всасывание жидкости, что обусловливает дальнейшее растяжение кишечных петель и нарушение питания кишечной стенки [Кауфман О.Я., 1987; Проценко В.А., 1988]. Глубина нарушения местного кровообращения зависит от степени сдавления сосудов в стенке кишки. Так, повышение давления в просвете двенадцатиперстной кишки до 35-45 мм рт.ст. ведёт к стойким нарушениям кровообращения, а для подвздошной кишки и толстой кишки, где имеются другие анатомические условия кровоснабжения, критическим уровнем внутрипросветного давления, приводящим к нарушению микроциркуляции в стенке кишки является 65-95 мм рт.ст. [Кирпатовский И.Д., 1988].
Роль рефлекторного компонента сводится к раздражению интерорецепторов кишечной стенки, рефлекторному нарушению моторной функции кишечника, усилению патологической секреции желудка и кишечника, нарушению регионального кровообращения, возникновению патологической транссудации жидкости в просвет растянутых петель кишки, а в последующем – в брюшную полость, париетальную и висцеральную брюшину [Волков В.Е., 1986; Карякин А.М., 1988; Попова Т.С., 1991].
В итоге, в результате синергизма местных и рефлекторных факторов развивается острая недостаточность функции тонкой кишки – энтеральная недостаточность. Патогенетическая толерантность порочных кругов приводит к перерастяжению петель кишки, увеличивает секрецию и транссудацию жидкости в просвет кишки, приводит к дальнейшему угнетению моторики желудочно-кишечного тракта. Для этого этапа патогенеза характерно накопление отрицательной динамики метаболических расстройств.
Углублённые исследования позволили выделить три стадии энтеральной недостаточности [Попова Т.С., 1991; Петухов В.А., 2003; 2005].
Первая: несмотря на острые нарушения моторики, газы и жидкость в просвете кишки ещё не скапливается, так как при сохранённой микроциркуляции в кишечной стенке нарушений переваривания и всасывания не возникает.
Вторая: к глубоким нарушениям моторики присоединяется угнетение всасывания газов, а позднее воды, электролитов и мономеров основных питательных веществ. При морфологических исследованиях отмечаются выраженные изменения со стороны эпителия кишечных ворсин и сосудов на уровне микроциркуляторного сектора. Наблюдается укорочение ворсин слизистой, сглаженность эпителиального покрова, уплощение эпителия, истончение щёточной каймы. Острые нарушения в системе микроциркуляции проявляются сначала в блоке оттока крови из кишечных ворсин, что при сохранности артериального притока ведет к увеличению фильтрационной секреции и нарушению всасывания.
Третья: прогрессирующие нарушения микроциркуляции в артериальном отделе приводят к отеку стромы ворсины и ее коллоидных структур, изменению рН и вторичному угнетению транспортных процессов в эпителиоцитах. Отмеченные изменения являются структурной основой прогрессирования нарушений секреторной, переваривающей и всасывательной функции кишечника.
Следствием данного синдрома являются нарушения водно-электролитного обмена, которые проявляются изменениями объема (объема циркулирующей крови и интерстициальной жидкости), состава (буферные соединения, электролиты, белки, гемоглобин), концентрации (калия, натрия, хлора) и распределения (секвестрация жидкости в кишечнике, брюшной полости) жидкостей [Ошатский Я., 1967; Омаров Х.Т., 1983; Малышев В.Д., 1985; Савельев В.С., 1986; Лукомский Г.И., 1988; Томашук И.П., 1991; Попова Т.С., 1991; Berci G., 1993; Schirata J., 1983; Hurting W., 1982; Richter H., 1978].
Нормальное содержание воды в организме взрослого человека у мужчин около 60%, у женщин около 50% массы тела. Весь водный запас организма находится в двух пространствах (секторах): внутриклеточном (интрацеллюлярном), составляя 55% от общего количества воды в организме и 33% от веса тела, и внеклеточном (экстрацеллюлярном), составляя, соответственно 45 и 27% [Жисневский Я.А., 1994; Оболенский С.В., 1998]. Клеточные мембраны подразделяют внеклеточный сектор на внутрисосудистое, интерстициальное (межтканевое) и трансклеточное (трансцеллюлярное) пространства. Внутрисосудистое пространство – это жидкость, находящаяся внутри кровеносных сосудов, то есть объем крови, который состоит из объема плазмы и эритроцитов. В клинической практике вода эритроцитов учитывается как необменная, но способностью эритроцитов удерживать воду не следует пренебрегать, в частности при гипергидратации [Жисневский Я.А., 1994]. Плазменный объем является наиболее мобильным водным сектором, посредником в обменных процессах и составляет 7,5% от общего содержания воды и 4,5 % от веса тела [Жисневский Я.А., 1994; Оболенский С.В., 1998].
Интерстициальный сектор является основой внеклеточного пространства и составляет приблизительно 35% от общего объема воды в организме [Оболенский С.В., 1998]. Через него осуществляется транзит ионов, кислорода, питательных веществ в клетку и обратное движение шлаков в сосуды, по которым они доставляются к органам элиминации [Малышев В.Д., 1985]. Однако межтканевое пространство нельзя рассматривать как гомогенную жидкую фазу [Mertz,1962]. Оно имеет области активного обмена, так называемую легко диффундирующую жидкость, включая лимфу, на долю которой приходится 20%, а также области обмена в трудно диффундирующих жидкостях, которые находятся в соединительной (7,5%), хрящевой и костной ткани (7,5%) [Оболенский С.В., 1998]. Mertz (1962) объединил легко диффундирующую жидкость, включая лимфу, а также небольшую часть жидкости соединительной ткани в «физиологически активный объем» внеклеточного пространства (межуточное пространство, межтканевая жидкость), который составляет 15% от массы тела. Трансклеточное пространство охватывает ту часть жидкости, которая располагается в полостях организма (желудочно-кишечные соки, желчь, спинномозговая жидкость, моча в мочевом тракте, внутриглазная жидкость, перитонеальная, плевральная, перикардиальная и синовиальная жидкости). В норме оно составляет 2,5% от общего объема воды и 1,5% от веса тела [Оболенский С.В., 1998]. Жидкости, находящиеся в различных полостях, имеют четкие различия в химическом составе. Большая часть их находится в желудочно-кишечном тракте, где за одни сутки выделяется и реабсорбируется около 6–10 л [Русаков В.И., 1985].
Водный обмен неразрывно связан с обменом электролитов, которые в водном растворе в большей или меньшей степени диссоциируются на свободные и подвижные ионы. Основными катионами организма являются натрий, калий, кальций, магний, анионами - хлор, гидрокарбонаты, фосфаты, сульфаты, белки, радикалы органических кислот: ацетат (уксусная кислота), пируват (пировиноградная кислота), лактат (молочная кислота), гидроксибутират (гидроксимасляная кислота), ацетоацетат (ацетоуксусная кислота) [Жисневский Я.А., 1994; Hurting W., 1982].
Натрий является основным катионом внеклеточной массы (40% натрия содержится в костях, 50% – во внеклеточном пространстве и 10 % во внутриклеточном и трансклеточном пространствах [Оболенский С.В., 1998]. В активном обмене участвует 67% натрия [Geigy J.R.,1968]. Калий является основным внутриклеточным катионом; 98% ионов находится в клетках и 2% – внеклеточно [Fleischer W., 1960]. В активном обмене участвуют 90% ионов калия [Geigy J.R.,1968].
Между концентрацией калия и натрия внутри клетки и внеклеточным пространством имеются строгие закономерности, которые жизненно необходимы для организма, и обусловлены функционированием натриево-калиевого насоса, локализующего в клеточной мембране [Bradbury M., 1973; Hurting W., 1982]. Нарушение водного баланса (дисгидрия) может наблюдаться в виде дегидратации - дефицит воды и гипергидратации - её избыток. В зависимости от концентрации электролитов последние могут быть гипо-изо-гипертоническими. Регуляция водного обмена тесно связана с состоянием волемии, под которым понимают соответствие объема циркулирующей крови объему заполненных кровью (функционирующих) сосудов, которое в свою очередь связано с гемодинамикой, с соотношением гидростатического и коллоидно-осмотического давлений [Лукомский Г.И., 1988; Жисневский Я.А., 1994].
Таблица 3.1.
Показатели нарушения водно-электролитного обмена при перитоните
Лабораторные показатели |
Стадия энтеральной недостаточности |
Стадия полиорганной дисфункции |
||
|
n |
|
n |
|
Число эритроцитов (1012/л) |
33 |
4,4±0,04 |
12 |
4,7±0,1* |
Hb (г/л) |
33 |
155,1±2,4 |
12 |
159,2±7,0 |
Гематокрит (%) |
20 |
46,7±0,6 |
9 |
53,1±1,0* |
Средний объем эритроцитов |
20 |
107,03±1,3 |
9 |
111,7±1,7* |
Средняя [Hb] в эритроците (г/л) |
20 |
317,0±4,1 |
9 |
294,1±14,0* |
Калий (ммоль/л) |
17 |
3,5±0,1 |
11 |
3,2±0,1 |
Натрий (ммоль/л) |
17 |
134,7±1,2 |
10 |
130,4±1,7 |
Шоковый индекс |
96 |
0,89±0,18 |
23 |
17±0,06* |
Процент снижения ОЦК в зависимости от шокового индекса |
96 |
до 20 |
23 |
более 30 |
Объем жидкости в брюшной полости (мл) |
91 |
500,5±115,5 |
19 |
403,6±118,9* |
Объем жидкости в кишке при ее декомпрессии (мл) |
91 |
1900,5±395,5 |
19 |
1703,6±318,9 |
Суточный диурез (мл) |
38 |
830,3±16,6 |
14 |
464,3±34,1* |
*уровень статистической значимости различий (p<0,05) по отношению к предыдущей стадии |
||||
Скопившаяся жидкость и электролиты в приводящем отрезке кишечника относится к внеклеточному (трансклеточному) пространству и обусловлена секреторной деятельностью желез желудочно-кишечного тракта, образуя так называемое «третье водное пространство», «пространство Рандала» [Ошатский Я., 1967; Лукомский Г.И., 1988], или «осумкованной части» внеклеточного пространства. Вода и электролиты, содержащиеся в этой жидкости, являются как бы блокированным резервом, который, при разрешении непроходимости, восстановлении прохождения кишечного содержимого и возможной хирургической декомпрессии кишечной стенки, может быстро реабсорбироваться, временно перегружая организм [Ошатский Я., 1967; Ерюхин И.А., 1988]. Кроме того, эта жидкость содержит большое количество осмоактивных веществ и, следовательно, обладает высоким осмотическим давлением, что необходимо учитывать при инфузионной подготовке к оперативному вмешательству. Количество этой секвестрируемой жидкости зависит от уровня непроходимости и может достигать 6-10 л в сутки [Reissigl H., 1968; Русаков В.И., 1985].
Рефлекторная рвота приводит к удалению из организма значительного количества пищеварительных соков и богатого белком транссудата, скопившихся в просвете пищеварительного тракта. Нарастает гипопротеинурия (снижение на 6 - 45%) и, в первую очередь, за счет альбуминов [Стручков В.И., 1986; Томашук И.П., 1991]. Гипо- и диспротеинэмия является пусковым моментом в развитии волемических нарушений [Лукомский Г.И., 1988]. Потеря жидкости и солей вследствие рвоты, скопление ее в кишечнике и брюшной полости в результате секреции и транссудации ведет к уменьшению объема внеклеточного пространства и количества натрия – основного электролита внеклеточной жидкости, что является стимулом для увеличения выделения альдостерона. В результате в организме задерживаются ионы натрия и хлора при одновременном увеличении выделения калия с мочой [Стручков В.И., 1986; Bergent S., 1976]. Развивается состояние, известное в литературе под названием синдром Дерроу или трансминерализации (на место трех ионов калия, исчезающих из клетки, входят два иона натрия и один ион водорода), что приводит к внеклеточному алкалозу и внутриклеточному ацидозу [Томашук И.П., 1991; Hurting W., 1982].
Начинающаяся развиваться в этот период внеклеточная дегидратация прежде всего уменьшает объём циркулирующей крови, который, по нашим данным (таблица 3.1), снижается до 20%. В связи с потерей жидкой части крови происходит гемоконцентрация, повышается количество эритроцитов (4,4±0,04×1012/л), гемоглобина (155,1±2,4г/л), гематокрита (46,7±0,6%), изменяется реология крови с повышением ее вязкости, что способствует нарушению микроциркуляции. Шоковый индекс (0,89±0,18) указывает на среднюю степень дегидратации. Суточный диурез свидетельствует о начальных проявлениях олигурии (830,0±16,8 мл/сут). При оперативном вмешательстве в эту стадию наблюдается скопление в брюшной полости серозно-геморрагического выпота в среднем около 500,5±115,5 мл, тонкая кишка может быть дилатирована до 6см, содержит большое количество жидкости (1900,5±395,5 мл) и газа.
При прогрессировании перитонита и возникновении органных нарушений происходят более глубокие расстройства водно-электролитного, а вместе с ним кислотно-щелочного равновесия. Истощается запас гликогена в печени и мышцах. Начинается распад белков и жиров собственных тканей организма. Параллельно этому уменьшается клеточная масса и запасы жира, а продукты их сгорания задерживаются в организме, так как в этом периоде часто уже имеют место выраженные расстройства функции почек. Накапливаются кислые метаболиты, реакция крови перемещается в направлении ацидоза [Томашук И.П., 1991; Попова Т.С., 1991; Успенский Л.В., 1995; Hurting W., 1982].
Катаболические процессы способствуют образованию большого количества эндогенной воды (в норме образуется около 200 - 300 мл/сут) [Ошатский Я., 1967; Томашук И.П. с соавт., 1991], обедненной натрием и обогащенной калием [Hurting W., 1982]. Значительная часть этой воды задерживается вследствие участия антидиуретического гормона, а также в результате задержки натрия в организме, что в свою очередь является результатом усиленной активности альдостерона. Расстройства функции почек усиливают это явление. Прогрессирующие потери жидкости и солей вследствие рвоты, скопление последних не только в кишечнике (1703,6±318,9 мл после декомпрессии), в брюшной полости (403,6±118,9 мл), в кишечной стенке (отек кишечной стенки 2-3 л) [Reissigl H., 1968], но и перитонеальной брюшине (3-4 л), [Kern E., 1978] в результате транссудации и экссудации способствуют развитию внеклеточной дегидратации и внутриклеточной гипергидратации с гипонатриемией. Кроме того, имеются потери натрия с секретами пищеварительных желез вследствие трансминерализации и диффузии в очаг воспаления [Савельев В.С., 1986; Лукомский Г.И., 1988]. Гипонатриемия, достигающая, по нашим данным, 130,4±1,7 ммоль/л, определяет в первую очередь 50%-ное снижение осмотического давления в плазме [Gregersen J.,1971; Mansberger, 1972; Hurting W., 1982]. Это наряду с гипо- и диспротеинемией, по данным Г.И.Лукомского и И.Л.Могилевского (1988), создает условия для обводнения (отека) эритроцитов. По нашим данным, в этот период средний объем эритроцитов значительно превышает норму (111,7±1,7), а средняя концентрация гемоглобина в эритроците снижена (294,1±14,0 г/л) (таблица 3.1). Гемоконцентрация в этот период прогрессирует (количество эритроцитов 4,7±0,1×1012/л, гемоглобин 159,2±7,0г/л, гематокрит 53,1±1,0%).
Вследствие нарастающего дефицита жидкости уменьшается объём циркулирующей крови, который, по нашим данным, снижается более чем на 30%. Его прогрессирующее снижение может привести к гиповолемическому шоку, который, в отличие от геморрагического шока, протекает с гиповолемией и разведением крови. Кроме того, вследствие изменения давления во внеклеточном пространстве может нарушаться и внутриклеточное пространство, что приводит к быстрому развитию шока [Савельев В.С., 1986; Лукомский Г.И., 1988; Ерюхин И.А., 1999; Hurting W., 1982; Sachs S.M., 1982]. Распад клеточной массы приводит к освобождению калия из клеток, а развивающаяся олигурия в финале заболевания способствует задержке ионов во внеклеточном пространстве и плазме [Ошатский Я., 1967; Успенский Л.В., Кузин М.И., 1995; Hurting W., 1982]. Калий теряется вследствие гиперкортицизма, трансминерализации, гиперальдостеронизма, со рвотой, с мочой, с секвестрацией в третье водное пространство и брюшную полость, что, по данным большинства исследователей, способствует гипокалиемии (3,2±0,1 ммоль/л) при полиорганной дисфункции, несмотря на олигурию (464,3±34,1 мл) [Малышев В.Д., 1985; Стручков В.И., 1986; Лукомский Г.И., 1988; Рябцев В.Г., 1991; Попова Т.С., 1991; Dressler C., 1988; Fielding L.P., 1989]. Гипокалиемия усугубляет состояние больного, так как недостаток ионов калия способствует уменьшению функциональной активности желудочно-кишечного тракта вплоть до его паралича, снижает сократительную активность дыхательной мускулатуры и миокарда [Дарбинян Т.М., 1974; Томашук И.П., 1991].
Эндогенная интоксикация
Термин «эндогенная интоксикация» (ЭИ) впервые употреблён в начале семидесятых годов и рассматривается как «отравление ядовитыми веществами, которые вырабатываются организмом, как при некоторых нарушениях нормальной жизнедеятельности, так и при различных заболеваниях» [БМЭ Т.Г., 1975]. В работах Н.М. Федоровского рассматривается дифференцировка клинико-патогенетических элементов эндогенной интоксикации: деление ЭИ на эндотоксемию, синдром эндогенной интоксикации и эндотоксикоз.
Эндотоксемия – это накопление токсичных компонентов в крови.
Синдром эндогенной интоксикации (СЭИ) – комплекс симптомов патологических состояний органов и систем организма, обусловленных накоплением в тканях и биологических жидкостях эндотоксинов (продуктов естественного обмена в аномально высоких концентрациях, медиаторов воспаления, олигопептидов, экзо- и эндотоксинов, активных ферментов и т.д.).
Эндотоксикоз (ЭТ) – это клиническая оценка тяжести СЭИ на фоне полиорганной недостаточности [Фёдоровский Н.М., 1998].
В России с 1994 года синдром эндогенной интоксикации характеризуется как «клинический синдром с проявлениями симптомов интоксикации при патологических состояниях, неоднородных по этиологии и обусловленных накоплением в тканях и биологических жидкостях организма продуктов патологического обмена, веществ и метаболитов, образовавшихся в результате нарушений регуляторных функций, деструкции клеточных и тканевых структур, разрушения белковых молекул».
На сегодняшний день предложено множество классификаций СЭИ, в основе которых лежат различные принципы (таблица 3.2).
Таблица 3.2. Классификации СЭИ
Автор |
Год |
Принцип |
Градации |
Гостищев В.К. |
1996 |
Компоненты ЭИ |
Микробиологический, биохимический, иммунологический |
Фёдоровский Н.М. |
1995 |
Биохимические стадии ЭИ |
Интоксикации, диспротеинемии, накопления промежуточных метаболитов |
Шуркалин Б.К. |
1993 |
Клинические стадии ЭИ |
Компенсация, субкомпенсация, декомпенсация |
Чаленко В.В. |
1990 |
Стадийность патологического процесса в зависимости от его источника |
Семь источников, пять стадий ЭТ |
Корреляция степени тяжести эндотоксикоза и проявлений полиорганной недостаточности описаны В.К.Гостищевым (1989) (таблица 3.3). В основополагающих работах нашей клиники под эндогенной интоксикацией предложено понимать «отравление организма, как конечными продуктами метаболизма вследствие задержки их выведения и накопления в организме выше физиологических норм, так и промежуточными, в связи с нарушениями метаболических процессов» [Белокуров Ю.Н., Рыбачков В.В., 2000].
Целесообразна дифференцировка видов эндогенной интоксикации на:
Резорбционный вид – ЭИ вследствие образования токсичных веществ в полостях тела при ишемии и брожении с последующим всасыванием продуктов распада.
Обменный вид – ЭИ вследствие нарушения обмена и накопления в организме промежуточных продуктов метаболизма в избыточном количестве, проявляющих токсическое действие.
Ретенционный вид – ЭИ вследствие нарушения выведения конечных продуктов метаболизма.
Инфекционный вид – ЭИ вследствие накопления микробных токсинов, а также продуктов распада при инфекционных заболеваниях.
Главным источником ЭИ при перитоните является кишечник. Его роль как источника интоксикации определяется [Петров В.П., 1999]:
нарушением барьерной функции кишечной стенки в связи с микроциркуляторными и гипоксическими изменениями;
угнетением факторов секреторного иммунитета в кишечнике;
развитием дисбактериоза за счет перемещения в проксимальные отделы кишечника несвойственной им аллохтонной анаэробной микрофлоры и приобретения ею патогенных свойств;
развитием симбионтного полостного пищеварения с включением в этот процесс ферментативной активности микроорганизмов, что ведет к неполному гидролизу белковых продуктов и образованию биологически активных полипептидов
Таблица 3.3. Степени тяжести ЭТ при перитоните [Гостищев В.К., 1989]
Критерии |
I степень |
II степень |
III степень |
Частота пульса в 1 мин |
до 110 |
110-130 |
130 |
Частота дыхания в 1 мин |
18 - 22 |
23 - 30 |
30 |
Нарушение функции ЦНС |
легкая эйфория |
заторможенность или возбуждение |
делирий |
Цвет кожных покровов |
нормальный |
бледные |
землистость |
Суточный диурез (мл) |
> 1000 |
800 - 1000 |
< 800 |
Перистальтика кишечника |
вялая |
вялая или отсутствует |
отсутствует |
Лейкоцитарный индекс интоксикации (ЛИИ) |
3 |
3-6 |
6 |
Концентрация СМО (усл. ед.) |
0,2660,03 |
0,40,06 |
0,5350,06 |
Мочевина плазмы крови (ммоль/л) |
7,40,5 |
100,69 |
16,31,8 |
В конечном итоге нарушение барьерной функции кишечной стенки приводит к ЭИ, которая вначале компенсируется детоксицирующим влиянием печени, но по мере прогрессирования процесса принимает угрожающий характер.
Далее решающее значение приобретают следующие патогенетические факторы [Петров В.П., Ерюхин И.А., 1989, 1999]:
постепенное истощение функционального потенциала печени на фоне прогрессирования эндотоксикоза;
развитие и прогрессирование перитонита, второго источника интоксикации;
развитие под влиянием ЭИ системных микроциркуляторных расстройств в органах и тканях, что приводит к нарушению клеточного метаболизма.
Что касается клинической оценки выраженности эндогенной интоксикации, то по нашему мнению, следует учитывать степень церебральных нарушений, как один из главных критериев глубины метаболической перестройки. В связи с этим нами выделяется лёгкая, средняя и тяжёлая степени ЭИ, которые в известной степени соответствуют церебральным расстройствам в виде сопора, прекоматозного состояния и комы.
Для перитонита характерны обменный, резорбционный и инфекционный механизмы развития ЭИ, комбинация которых может рассматриваться как патофизиологическая основа синдрома ЭИ. Эндотоксины, продуцируемые клетками в ходе их жизнедеятельности, являются причиной возникновения эндогенной интоксикации [Е.Ф.Лушников, 1974; В.И.Филин, 1976]. Токсический агент может быть как физиологическим продуктом нормального биологического окисления, так и патологическим продуктом, образующимся в результате стойкого нарушения клеточного метаболизма [Aguirre A., 1974; Fisher Y., 1975]. В случае, когда токсический агент является физиологическим продуктом, он может обнаруживаться в нормальных концентрациях у здоровых людей. Патологические эндотоксины в норме отсутствуют в биологических жидкостях. В процессе уточнения природы эндогенной интоксикации важным моментом является определение момента, с которого начинается образование или накопление токсического агента. Поскольку это происходит как на промежуточных этапах, так и на завершающих этапах клеточного обмена, целесообразна дифференцировка ЭИ на ЭИ промежуточными и конечными продуктами метаболизма [Haller H., 1975; Фёдоров Н.А., 1985]. Образовавшийся в ходе клеточного метаболизма токсин может способствовать вторичному нарушению окислительно-восстановительных клеточных реакций и повреждению клеточных структур.
В результате воздействия токсина в клетке могут происходить следующие изменения:
образование органических перекисей, ускорение окислительных процессов, освобождение и активация ферментов, воздействующих на РНК, ДНК.
высвобождение катепсинов, вызывающих усиление лизиса белка.
увеличение уровня фосфатаз, мононуклеотидов и глюкофосфатов. Образование ферментов, лабилизирующих клеточные мембраны и мембраны клеточных органелл, в том числе митохондрий и лизосом, что ведёт к разобщению процессов дыхания и фосфорилирования, угнетению синтеза белка и АТФ.
активация ферментов в результате нарушения лизосомальных мембран, вызывающих нарушение в системе глюкуроновой кислоты и резко повышающих гликолитические процессы в мукополисахаридах базальных мембран с нарушением их проницаемости.
Таким образом, морфологическим субстратом для развития ЭИ является нарушение клеточных структур с вероятной гибелью клетки и вторичным образованием токсинов [Colombo J., 1977; Гальперин Э.И., 1978; Савельев В.С., 1983].
Среди известных потенциальных токсинов важное место отводится аммиаку, который, обладая церебротоксическим эффектом, приводит к дефектам энергетического метаболизма головного мозга и последующим клиническим проявлениям энцефалопатии [Zieve F., 1972; Schenker S., 1974; Horky J., 1975; Thompson R., 1976; James J., 1987]. Одним из вероятных механизмов увеличения содержания аммиака в периферической крови при перитоните является его гиперпродукция, связанная с распадом белков в просвете кишечника.
Существенную роль в реализации ЭИ играет остаточный азот, как один из конечных продуктов метаболизма, включающий в себя азот мочевины (50%), азот аминокислот (25%), азот эрготионина (8%), мочевой кислоты (4%), креатина (4%), креатинина (2,5%), аммиака и индикана (0,5%) и других небелковых веществ, содержащих азот (полипептиды, нуклеотиды, уробилин, гистамин) [Коровкин Б.Ф., 1969]. Азотемия, в зависимости от её причин, может быть ретенционной (возникающей при недостаточном выделении с мочой азотсодержащих веществ) и продукционной (вследствие избыточного поступления азотсодержащих продуктов в кровь при усилении распада тканевых белков [Рыбачков В.В., 1986].
Другими важными продуктами эндоинтоксикации является билирубин и желчные кислоты, уровень которых увеличивается при любом воспалении органов брюшной полости. Накопление их в крови приводит к подавлению внутриклеточного окисления, угнетению тканевого дыхания и сопряжённого с ним окислительного фосфорилирования [Mustafa N., 1969; Усольцева Г.Е., 1973; Белокуров Ю.Н., 1981].
Определённую роль в естественном биологическом ответе на бактериальную агрессию играет кининовая система, включающая ферменты, образующие кинины – калликреины; субстрат, из которого освобождаются кинины – кининогены; ферменты, разрушающие кинины - кининазы [Меньшиков В.В., 1972]. Поливалентность фармакологического действия кининов вызывает развитие сосудистых нарушений, воспалительных и аллергических реакций, процессов альтерации [Пасхина Г.С., 1976; Nakano G., 1966; Stewart D., 1972]. Установлено, что тяжесть интоксикации при гнойном перитоните соответствует степени ферментемии (протеолитической активности и уровня свободных кининов) [Ивашкевич Г.А., 1983; Сечновец А.С., 1986]. Активность свободных кининов углубляет ферментативную интоксикацию, но может быть снижена лёгочным сурфактантом, недостаточность которого быстро приводит к возникновению лёгочных осложнений. Таким образом, кининовая система является как конечным продуктом метаболизма, так и одним из факторов интоксикации.
Конечными продуктами метаболизма также являются ароматические (триптофан, тирозин, фенилаланин) и серосодержащие (метилен, цистеин, тауриновая кислота) аминокислоты, возникающие при белковом обмене [Fischer J., 1973; Freund H., 1978]. Развивающийся при перитоните дисбаланс аминокислот приводит к нарушению синтеза белков, появлению в крови патологических продуктов белкового обмена и накоплению физиологических метаболитов в концентрациях, токсичных для центральной нервной системы [Record C., 1976].
Промежуточные продукты метаболизма образуются в результате совокупности химических превращений веществ, происходящих в организме с момента поступления продуктов пищеварения в кровь и до момента образования конечных продуктов обмена и их выведения из организма. Среди промежуточных токсических продуктов внимание привлекают трудно идентифицируемые метаболиты, роль и диагностическая ценность которых не всегда ясна и требует уточнения. Ряд из них названы среднемолекулярными олигопептидами («средними молекулами»), к которым относят также инсулин, некоторые витамины и гормоны белкового метаболизма [Габриэлян Н.И., 1981; Boverman G., 1980]. Впервые токсическая роль «средних молекул» в патогенезе эндотосикоза была доказана при хронической почечной недостаточности [Bobb A., 1973]. Позже была выделена группа веществ с молекулярной массой от 500 до 5000 дальтон [Dzurik R., 1973; Migone L., 1975]. Их состав, источник и структура не идентифицированы. Существует мнение, что большинство из них являются продуктами белкового обмена. Токсический эффект определяется их суммарной активностью с не дифференцируемой активностью отдельных метаболитов. «Средние молекулы» способствуют разрушению эритроцитов [Leber H., 1979], оказывают ингибирующее действие на эритропоэз [Гудим В.И., 1979], нарушают синтез белка [Leber H., 1979], тормозят процессы окисления и синтез АТФ [Fürst P., 1980], способствуют возникновению иммунодефицита [Navarro J., 1980]. Токсический эффект СМО плазмы при уремии в 4 раза выше, чем у доноров [Minynart G., 1972].
Ряд авторов считает, что в генезе эндотоксикоза решающую роль имеет устойчивый липополисахаридный комплекс, связанный с белком, усиливающим его антигенные свойства [Мельников Н.И., 1969]. Источником такого токсина являются полимикробные ассоциации [Myzvold N., 1979; Савчук В.Д., 1979].
Важным фактором, способствующим развитию эндотоксикоза, считается неадекватная эвакуаторная функция кишечника, приводящая к внутрипросветному удерживанию различных микроорганизмов, продуктов брожения и гниения, препятствующих нормальному пристеночному пищеварению и индуцирующих чрезмерное вторичное инфицированиие [Cuenos P., 1972; Ерюхин И.А., 1980; Кригер А.Г., 1985].
В настоящее время подробно изучена роль свободных радикалов– высокоактивных химических соединений, обеспечивающих возникновение патологических реакций биологического окисления [Ehrenberg B., 1984]. Среди маркеров подобных реакций наиболее известно появление избыточной концентрации гидроперекисей и альдегидов [Журавлёв А.П., 1975; Дорябиц И.П., 1984]. Имеются данные цитотоксическом действии свободных радикалов и продуктов свободнорадикального окисления, которые в низких концентрациях вызывают нарушение клеточного деления, а в высоких – гибель и лизис клеток [Слейтер Э., 1962; Партешко В.Г., 1969].
Согласно собственным данным, при перитоните появляются свободные радикалы с металлами переменной валентности. Особенно велика вероятность появления таких радикалов в коре головного мозга. Исследования показали, что в качестве химического элемента в этих случаях вероятнее всего выступает молибден.
Таблица 3.4.
Состояние калликреин-кининовой системы плазмы крови при перитоните
Показатель |
Контроль |
Перитонит |
Кининоген (мкг/мл) |
1,370±0,040 |
2,109±0,800* |
Калликреин (мкг/мл) |
0,392±0,17 |
0,271±0,042** |
Прекалликреин (мкг/мл) |
0,323±0,011 |
0,194±0,023*** |
Кининаза (мкг/мл/мин) |
0,97±0,30 |
0,84±0,14 |
Уровень статистической значимости различий *p<0,05; ** p<0,01; ***p<0,001 |
||
В ходе исследований нами определены уровни кининогена плазмы [Diniz C.R., 1961], калликреина и прокалликреина плазмы [Суровинкина, 1973], кининов плазмы [Erdös E.G., 1962] (таблица 3.4). Определение промежуточных продуктов метаболизма – эндогенов в плазме крови больных и животных проводилось методом газо-жидкостной хроматографии, хроматомасспектрометрии, анализа равновесного пара, хроматораспределительного метода.
Структура эндоинтоксикации конечными продуктами метаболизма указывает на значительное отклонение содержания аммиака плазмы. Другие маркеры имели незначительный отрицательный тренд (таблица 3.5).
Таблица 3.5. Структура эндоинтоксикации конечными
продуктами метаболизма при перитоните
Показатель |
Значение |
Аммиак (масс% ×10-4); контроль: 0,01±0,0001 |
0,74±0,18 |
Билирубин общий (мкмоль/л) |
61,1±6,1 |
Билирубин прямой (мкмоль/л) |
50,3±5,4 |
Билирубин непрямой (мкмоль/л) |
10,6±1,0 |
Мочевина (ммоль/л) |
22,3±4,1 |
Креатинин (ммоль/л) |
0,84±0,10 |
Остаточный азот (мг%) |
61,8±6,3 |
Экспериментальные данные, полученные при исследовании животных, указывают на истощение калликреин-кининовой системы после первых суток перитонита (таблица 3.6). По мере прогрессирования экспериментального перитонита наблюдается выраженное истощение калликреин-кининовой системы, характеризующееся резким уменьшением, как кинин-образующих, так и кинин-разрушающих факторов. Возрастающая активность кининовой системы предшествует декомпенсации органных нарушений при перитоните.
Таблица 3.6. Эксперимент на животных:
Состояние калликреин-кининовой системы плазмы крови при перитоните
Показатель |
Контроль |
Длительность перитонита (ч) |
||
24 |
48 |
72 |
||
Кининоген (мкг/мл) |
0,395±0,077 |
0,294±0,0141 |
1,17±0,3101 |
0,145±0,0212 |
Калликреин (мкг/мл) |
0,216±0,017 |
0,058±0,6053 |
0,106±0,0201 |
0,034±0,0622 |
Прекалликреин (мкг/мл) |
0,692±0,014 |
0,023±0,0063 |
0,031±0,0171 |
0,024±0,0011 |
Кининаза (мкг/мл/мин) |
1,15±0,037 |
0,505±0,083 |
0,573±0,09 |
0,103±0,0133 |
Уровень статистической значимости по отношению к предыдущей серии 1 - p<0,05; 2 - p<0,01; 3 - p<0,001 |
||||
Установленные данные свидетельствуют о том, что изменения уровня факторов калликреин-кининовой системы являются не проявлениями эндоинтоксикации, а только отражают возможные механизмы её реализации.
Таблица 3.7. Структура эндоинтоксикации при перитоните
Продукты метаболизма (масс%×10-4) |
Контроль (n=25) |
Перитонит (n=43) |
Диэтиламин |
0,31±0,015 |
2,1±0,05** |
Ацетальдегид |
2,94±0,08 |
3,61±0,18* |
Ацетон |
6,52±0,27 |
34,43±3,96* |
Нормальный масляный альдегид |
0,013±0,003 |
0,66±0,04** |
Изовалериановый альдегид |
0,001±0,000001 |
0,31±0,05*** |
Изопропанол |
2,17±0,12 |
0,35±0,03** |
Этаннитрил |
0,038±0,03 |
0,26±0,029*** |
Метилизоцианид |
0,12±0,05 |
1,21±0,06** |
Триметиламин |
0,001±0,000001 |
1,15±0,054*** |
Этанол |
9,28±0,1 |
42,5±3,74* |
Уровень статистической достоверности *p<0,05; ** p<0,01; *** p<0,001 |
||
Определение уровня продуктов промежуточного обмена, изменяющих свою концентрацию в процессе развития перитонита, привела к идентификации 10 органических соединений (таблица 3.7): диэтиламин, ацетальдегид, ацетон, нормальный масляный альдегид, изовалериановый альдегид, изопропанол, этаннитрил, метилизоцианид, триметиламин, этанол.
Таблица 3.8. Структура эндоинтоксикации в зависимости при перитоните
Продукты метаболизма (масс%×10-4) |
Стадии перитонита |
|
Энтеральная недостаточность (n=15) |
Полиорганная дисфункция (n=28) |
|
Диэтиламин |
0,92±0,1 |
2,65±0,2** |
Ацетальдегид |
2,19±0,24 |
4,36±0,29* |
Ацетон |
25,7±0,8 |
38,7±1,57* |
Нормальный масляный альдегид |
0,34±0,043 |
0,87±0,07*** |
Изовалериановый альдегид |
0,24±0,06 |
0,33±0,02* |
Изопропанол |
0,14±0,03 |
0,43±0,06* |
Этаннитрил |
0,67±0,04 |
0,05±0,001*** |
Метилизоцианид |
1,07±0,2 |
1,26±0,17* |
Триметиламин |
0,36±0,09 |
1,54±0,35** |
Этанол |
36,76±0,7 |
45,54±1,2* |
Уровень статистической достоверности *p<0,05; ** p<0,01; *** p<0,001 |
||
Содержание этих соединений в плазме крови больных перитонитом изменялось в зависимости от стадии перитонита, которые характеризовались различными уровнями продуктов промежуточного обмена (таблица 3.8).
Значительным повышением триметиламина, диэтиламина, нормального масляного альдегида и ацетальдегида характеризуется стадия полиорганной дисфункции; динамика других метаболитов менее отчётлива.
Таблица 3.9
Структура эндоинтоксикации в при экспериментальном перитоните.
Продукты метаболизма (масс%×10-4) |
Контроль (n=10) |
Химический перитонит (n=10) |
Желчный перитонит (n=10) |
Колибациллярный перитонит (n=10) |
Диэтиламин |
0,815±0,04 |
2,92±0,07 |
1,096±0,04 |
0,853±0,14 |
Ацетальдегид |
|
|
|
40,3±3,08 |
Ацетон |
0,163±0,003 |
2,037±0,08 |
1,67±0,11 |
15,22±0,72 |
Нормальный масляный альдегид |
|
|
|
0,46±0,021 |
Изовалериановый альдегид |
0,017±0,001 |
0,003±0,00001 |
0,007±0,0005 |
2,46±0,39 |
Изопропанол |
0,039±0,009 |
0,623±0,002 |
0,047±0,003 |
1,19±0,07 |
Этаннитрил |
|
|
|
0,0037±0,00001 |
Метилизоцианид |
0,024±0,001 |
0,013±0,00009 |
0,003±0,00001 |
1,36±0,11 |
Триметиламин |
|
|
0,037±0,001 |
0,67±0,04 |
Этанол |
3,25±0,16 |
21,03±0,93 |
14,78±0,87 |
35,66±1,46 |
Аммиак |
0,067±0,0003 |
0,269±0,01 |
0,307±0,03 |
0,2±0,06 |
При изучении в эксперименте различных клинических форм перитонита установлено, что колибациллярная инфекция вызывала наиболее существенную выработку промежуточных метаболитов (таблица 3.9), среди которых наиболее значимым оказался ацетон. При колибациллярном перитоните даже в фазе компенсации отмечается гиперпродукция промежуточных метаболитов, маркирующая активность воспаления брюшины.
Таким образом, значение эндогенной интоксикации при перитоните несомненно. Среди множества токсинов более значимыми являются промежуточные соединения. Их накопление в крови сопровождается прогрессированием перитонита и полиорганной дисфункции.
Симпато-адреналовая система
В ряде работ указывается на связь клинических проявлений перитонита и элементов симпато-адреналовой системы, биологическое действие которых многообразно и затрагивает многие системы органов. Действие катехоламинов проявляется в повышении интенсивности окислительного расщепления и последующем усилении кислородного обмена в клетках. Общеизвестно влияние катехоламинов на функцию сердечной мышцы, желез внутренней секреции. В работах, посвящённых стрессу и формированию защитных и приспособительных реакций [Селье Г., 1960] указывается на главенствующую роль в этих процессах катехоламинов.
Образование избыточных количеств мощных вазодилататоров (гистамин, серотонин) на начальных стадиях перитонита приводит к компенсаторному выбросу вазоконстрикторов. Увеличение концентрации адреналина и норадреналина не способно обеспечить эффективный сосудистый тонус, что приводит к тяжёлым микроциркуляторным расстройствам и поступлению в кровоток токсических высокомолекулярных соединений [Лыткин М.Е., 1980]. Экспериментальные данные показали, что на вторые-четвёртые сутки перитонита в крови животных накапливается избыток адреналиноподобных веществ [Шалимов А.А., 1981]. Выраженный прессорный эффект катехоламинов может способствовать ранней тканевой гипоксии и является одной из причин тяжёлых нарушений клеточного метаболизма [Abboud F., 1969]. Развивающийся дисбаланс плазменных и тканевых катехоламинов, является одним из пусковых моментов развития полиорганной дисфункции и повреждающего действия эндотоксинов.
Таблица 3.10.
Содержание адреналина и норадреналин в крови больных перитонитом (мкг/л)
Показатель (*p<0,05) |
Контроль |
Перитонит |
Адреналин |
0,35±0,01 |
3,03±0,43* |
Норадреналин |
0,35±0,013 |
8,11±0,61* |
Важным этапом собственных исследований явился экспериментальный и витальный анализ содержания адреналина, норадреналина, дофамина и дофа в различных биологических средах [Меньшиков В.В., 1967] и тканях. Установлено, что содержание адреналина и норадреналина в крови пациентов с перитонитом значительно возрастало (таблица 3.10).
В ходе анализа уровня экскретируемых катехоламинов с мочой установлено увеличение скорости синтеза дофамина из дофа в 4,3 раза. На последующем этапе происходит угнетение гидроксилирования дофамина в норадреналин в 3 раза по отношению к норме и в 7,7 раза повышается скорость метилирования норадреналина в адреналин (таблица 3.11). Таким образом, при перитоните отмечается сильное возбуждение симпатико-адреналовой системы, что приводит к существенному увеличению концентрации катехоламинов в крови и изменению экскреции их с мочой.
Таблица 3.11. Скорость синтеза катехоламинов (относительные единицы)
Реакция синтеза |
Контроль |
Перитонит |
Адреналин / Норадреналин |
0,29 |
2,24 |
Норадреналин / Дофамин |
0,75 |
0,25 |
Дофами / Дофа |
0,48 |
2,09 |
Выявленные закономерности, возможно, связаны с изменением содержания катехоламинов в тканях эффекторных органов (таблица 3.12). В связи с этим, интерпретация результатов лабораторного исследования остаётся неоднозначной [Белокуров С.Ю., 1991].
Таблица 3.12. Содержание катехоламинов в органах здоровых животных
Показатель (мкг/г ткани) |
Адреналин |
Норадреналин |
Дофамин |
Дофа |
Продолговатый мозг |
1,330±0,426 |
0,585±0,196 |
0,743±0,201 |
14,907±3,581 |
Надпочечники |
435,9±134,2 |
16,5±7,1 |
52,3±7,1 |
116,99±29,8 |
Печень |
0,566±0,114 |
0,281±0,063 |
0,741±0,162 |
0,367±1,468 |
Миокард |
0,383±0,106 |
0,368±0,110 |
0,393±0,216 |
10,129±2,213 |
Лёгкое |
0,432±0,110 |
0,052±0,014 |
0,373±0,080 |
12,242±2,683 |
Почка |
0,599±0,139 |
0,261±0,078 |
0,375±0,091 |
10,822±2,588 |
В первые сутки желчного перитонита отмечено снижение адреналина во всех исследованных органах, в том числе, в надпочечниках (таблица 3.13). Наиболее существенно оно в тканях печени, почки, миокарда. При химическом экспериментальном перитоните значительное снижение адреналина установлено в продолговатом мозге, почке, миокарде. Соотношение уровней адреналина и норадреналина показано на рисунках 3.1 и 3.2.
Таблица 3.13. Содержание катехоламинов
в надпочечниках экспериментальной группы животных
Показатель (мкг/г ткани) |
Контроль |
Клиническая форма перитонита |
||
Химический |
Желчный |
Колибациллярный |
||
Адреналин |
435,9±134,2 |
322,7±60,8 |
105,9±42,9 |
158,7±29,6 |
Норадреналин |
16,5±7,1 |
128,0±40,1 |
20,2±11,8 |
66,8±23,5 |
Дофамин |
117,0±29,8 |
12,65±6,12 |
10,92±4,69 |
46,68±13,14 |
Дофа |
32,30±7,13 |
35,56±9,61 |
27,13±14,53 |
8,73±2,19 |
Желчный перитонит сопровождается снижением концентрации норадреналина во всех эффекторных органах. При колибациллярном перитоните наблюдается рост содержания норадреналина в миокарде. Предполагаемая корреляция тяжести клинических форм перитонита прослеживается только с содержанием норадреналина в продолговатом мозге. Для более детального представления о состоянии симпатико-адреналовой системы при перитонитах изучено содержание предшественников адреналина и норадреналина.
Рис.3.1. Содержание адреналина (мкг/г ткани) в эффекторных органах
экспериментальной группы животных

Рис.3.2. Содержание норадреналина (мкг/г ткани) в эффекторных органах
экспериментальной группы животных

Снижение уровня дофамина имеется во всех исследованных органах (рис.3.4), однако, наиболее существенно оно при химическом и желчном перитоните. При колибациллярном перитоните уровень дофамина существенно снижается только в почке и миокарде. Содержание дофа в продолговатом мозге и почках не имеет при перитоните значимых различий (рис. 3.3). Значительное снижение уровня дофа отмечено в тканях печени и миокарда.
Рис.3.3. Содержание дофа (мкг/г ткани) в эффекторных органах
экспериментальной группы животных

Таким образом, элементы симпато-адреналовой системы в тканях эффекторных органов при перитоните различной этиологии претерпевают разнонаправленные и весьма значительные нарушения. При отсутствии очерченной однородности выявленных закономерностей выявлена тенденция к истощению синтеза гормонов и их предшественников в первые сутки течения перитонита. Наиболее значительные отклонения содержания катехоламинов в тканях эффекторных органов зафиксировано при химическом и желчном перитоните. При этих клинических формах наблюдается быстрое истощение резервов для биосинтеза конечных катехоламинов. Выявленная гиперадреналинемия свидетельствует о степени напряжения симпато-адреналовой системы на первых этапах развития перитонита.
В клинической практике определение уровня катехоламинов не всегда возможно. Поэтому о состоянии симпато-адреналовой системы в определённой степени можно судить на основании мониторинга кардиоинтервалографии, которая позволяет проследить напряжённость и глубину развивающихся нарушений. Проведённые исследования в основном соответствовали данным эксперимента и информативны в отношении содержания катехоламинов (таблица 3.14).
Рис.3.4. Содержание дофамина (мкг/г ткани) в эффекторных органах
экспериментальной группы животных

Установленные данные, безусловно, играют значительную роль в развитии порочного круга при перитоните со всеми вытекающими последствиями.
Таблица 3.14
Состояние вегетативной нервной системы при перитоните
по данным кардиоинтервалографии
Показатель |
Объём исследования |
Значение |
Вегетативный индекс |
n=21 |
46,0±2,5 |
Мода (сек.) |
n=17 |
0,52±0,01 |
Вариационный размах (сек.) |
0,04±0,005 |
|
Индекс напряжения |
1264,2±105 |
Синдром интраабдоминальной гипертензии
В последние годы возникло и развивалось учение о синдроме интраабдоминальной гипертензии (Abdominal compartment syndrome - ACS). Под термином «внутрибрюшное давление» принято понимать давление в пространстве между париетальным и висцеральным листками брюшины. Оно находится в зависимости, но отличается от давления в просвете полых органов, имеющих мышечные стенки и способных сокращаться [Чадаев А.П., 2003]. На уровень внутрибрюшного давления оказывают влияние степень эластичности и напряжения мышц брюшной стенки, масса внутренних органов, величина атмосферного давления, положение тела в пространстве. Колебания внутрибрюшинного давления при дыхании составляют около 3мм Hg. Во время физической нагрузки оно может повышаться до 340мм Hg, но на короткое время. Внутрибрюшинное давление может быть измерено прямым и непрямым способами. Наиболее часто используется непрямой способ – через полость матки, желудка или мочевого пузыря. Самый простой способ мониторинга внутрибрюшного давления – измерение давления внутри мочевого пузыря. Стенка мочевого пузыря при объеме содержимого не более 100мл выполняет функцию мембраны и точно передает давление брюшной полости. На основании изучения эффектов повышения внутрибрюшного давления различают умеренное (10-20мм Hg), среднее (21-35мм Hg) и значительное (более 35мм Hg) повышение. Причины, приводящие к развитию ACS весьма разнообразны. Наиболее часто развитие ACS происходит при перитоните, кишечной непроходимости, забрюшинных гематомах, гемоперитонеуме, диссеминированных опухолях. Способствовать его развитию может также пневмоперитонеум, наложенный при лапароскопии, цирроз печени при наличии асцита, беременность, стягивание брюшной стенки операционными швами.
В клинической практике имеется большое количество примеров развития ACS при различной патологии. Общие проявления таких состояний сводятся к одному: резкое увеличение давления в ограниченном пространстве брюшной полости ведёт к нарушению кровообращения, гипоксии и ишемии, расположенных в этом пространстве органов и тканей, способствуя выраженному снижению их функции [Ю.М. Гаин 2001]. С дислокацией диафрагмы и повышением внутрибрюшного давления связаны все изменения, происходящие в системе дыхания. Именно они в клиническом плане являются самыми ранними изменениями, происходящими при развитии и прогрессировании ACS. При этом происходит существенное уменьшение функциональной остаточной ёмкости лёгких, коллапс альвеол и ателектазирование ткани лёгких [Захохов Р.М., 2009; Сullen D.J., 1989; Obeid F., 1995]. Нарастающее ухудшение вентиляционно-перфузионных соотношений, прогрессирование легочного шунтирования приводят к выраженному снижению эффективности дыхания и нарастанию тяжёлых метаболических сдвигов. Прогрессирующая гипоксемия и респираторный ацидоз, быстро происходящая декомпенсация дыхательной функции часто являются поводом для проведения искусственной вентиляции легких [Malbrain M.L.N.G., 2000]. ACS ведет к нарушению кровообращения, изменения функции дыхания и мочеотделения [Гаин Ю.М., 2001; Bradley S.E., 1947; Harman P.K., 1982; Ho K.W., 1998; Cheatham, M.L., 1999]. Повышение внутрибрюшного давления на фоне уже имеющейся эндоинтоксикации приводит к прогрессированию системных нарушений, прежде всего - дыхательной и сердечно-сосудистой дисфункции. Компрессия крупных сосудов определяет изменения центральной гемодинамики. Воздействие повышенного внутрибрюшного давления на нижнюю полую вену приводит к снижению венозного возврата. Смещение диафрагмы вверх ведет к механической компрессии сердца и, как следствие, к повышению давления в системе малого круга кровообращения. Исследования показали, что увеличение общего периферического сопротивления сосудов прямо пропорционально величине интраабдоминального давления. Возникновение одышки при перитоните может явиться первым проявлением ACS. Смещение диафрагмы в сторону грудной полости повышает внутригрудное давление, в результате чего снижается дыхательный объем и функциональная остаточная емкость легких. В этих условиях быстро развивается острая дыхательная недостаточность и многим пациентам, даже на начальных этапах заболевания, требуется респираторная поддержка.
Таблица 3.15. Клинические проявления ACS [Савельев В.С., 2006].
Органная дисфункция |
Проявления |
Сердечно-сосудистая система |
Снижение сердечного выброса |
Снижение преднагрузки |
|
Увеличение постнагрузки |
|
Увеличение центрального венозного давления и/или давление заклинивания лёгочной артерии |
|
Система дыхания |
Увеличение пикового инспираторного давления |
Увеличение сопротивления |
|
Гипоксемия |
|
Гиперкапния |
|
Снижение динамического комплайнса |
|
Система мочеотделения |
Снижение почечного кровотока |
Снижение клубочковой фильтрации |
|
Снижение реабсорбции глюкозы |
|
Олигурия и анурия |
|
Органы брюшной полости |
Снижение перфузионного давления органов желудочно-кишечного тракта |
Ацидоз |
|
Снижение мезентериального и спланхнического кровотока |
|
Центральная нервная система |
Снижение перфузионного давления головного мозга |
Повышение внутричерепного давления |
ACS негативно воздействует и на систему мочеотделения вследствие прямой компрессии паренхимы и сосудов почек. По данным литературы, при величине интраабдоминального давления более 30мм Hg возможно развитие олигурии и анурии. Прямая компрессия внутренних органов ведет к нарушениям микроциркуляции, ишемии кишечной стенки, ее отеку, что, в свою очередь, приводит к транссудации и экссудации жидкости и усугубляет ACS, образуя порочный круг. Эти нарушения появляются при повышении внутрибрюшного давления до 15мм Hg. При увеличении давления до 25мм Hg развивается глубокая ишемия кишечной стенки, при которой возможна транслокация бактерий и их токсинов в мезентериальный кровоток [Савельев В.С., 2006]. При снижении портального кровотока (интраабдоминальное давление 20мм Hg) снижаются детоксикационные способности печени. Воздействие ACS на центральную нервную систему проявляется повышением внутричерепного давления и снижением перфузионного давления головного мозга. Симптомы ACS неспецифичны и могут проявляться в разных комбинациях. Диагноз ACS вероятен при внутрибрюшном давлении 15мм Hg и при наличии двух и более признаков полиорганной дисфункции (таблица 3.15) [Савельев В.С., 2006].
В литературе имеются данные о существенном влиянии интраабдоминальной гипертензии на развитие полиорганной дисфункции. Летальность в этих случаях чрезвычайно высока и составляет 60-70%. У 5,5% пациентов с распространённым перитонитом развивается ACS [Савельев В.С., 2006]. После лапаротомий по поводу травматического перитонита ACS развивается у 15% больных.
Несмотря на то, что в последние десятилетия ACS придаётся огромное значение, точных сведений о частоте его развития у больных в критическом состоянии не достаточно [Kirkpatrick A.W., 2000]. У больных с травмой живота, а также после абдоминальных операций внутрибрюшная гипертензия развивается у более 30% больных, а ACS возникает приблизительно у 5,5% пациентов [Ertel W., 1998; Malabrian M.L.N.G., 1999; Yukioka T., 2002]. Летальность при ACS достигает очень высоких цифр - 42-68%, без лечения этот показатель приближается к 100% [Kirkpatrick A.W., 2000].
В настоящее время общепризнанным является следующий перечень заболеваний и состояний, приводящих к развитию ACS [Гаин Ю.М., 2001; Malabrian M.L.N.G., 1999]:
кровотечение в брюшную полость и забрюшинное пространство;
лапаротомия или герниотомия со стягиванием брюшной стенки;
распространённый перитонит или абсцесс брюшной полости;
послеоперационная инфильтрация или отёк внутренних органов;
пневмоперитонеум во время лапароскопии;
послеоперационная кишечная непроходимость;
острое расширение желудка;
послеоперационный парез желудочно-кишечного тракта.
перитонит;
массивная инфузионная терапия;
декомпенсированный (напряжённый) асцит при циррозе печени или опухолях;
острый панкреатит;
острая кишечная непроходимость;
разрыв аневризмы брюшной аорты.
Способ прямого определения давления в брюшной полости был предложен в 1931г. [Overholt R.H., 1931]. Внутрибрюшное давление в норме близко к нулю [Абакумов М.М., 2003] или имеет небольшое отрицательное значение (ниже атмосферного). Внутрибрюшное давление составляет 0-7 мм. вод.ст. и оно повышается практически после любой лапаротомии до 5-12 мм. водного столба [Toens C., 2002].
При достижении интраабдоминальной гипертензии уровня 25 мм ртутного столба и выше наступают значительные нарушения кровообращения внутренних органов, что способствует развитию печеночно-почечной, сердечно-сосудистой и дыхательной недостаточности [Barnes G.E., 1988; Schein M., 1995].
Таким образом, только своевременное выявление интраабдоминальной гипертензии, профилактические мероприятия и лечение ACS могут служить залогом успешной терапии и предотвратить неблагоприятное развитие заболевания [Harrahill M., 1998; Cheatham, M.L., 1999; Pickhardt P.J., 1999].
Таблица 3.16. Уровень интраабдоминальной гипертензии (мм рт.ст.) при
ущемлённой грыже и распространённом перитоните
Время обследования / дни после операции |
Перитонит |
|
Резекция кишки |
Без резекции кишки |
|
Контроль |
7,2±1,2 |
|
До операции |
37,8±3,25 |
|
1 |
33,6±0,5 |
21,1±0,2 |
2 |
31,3±1,6 |
18,2±0,3 |
3 |
26,8±1,2 |
14,9±0,2 |
4 |
21,8±0,7 |
12,1±0,1 |
5 |
16,7±0,5 |
10,5±0,2 |
6 |
14,9±0,5 |
9,1±0,3 |
7 |
3,8±0,5 |
7,1±0,3 |
Специально проведённые исследования в группе из 142 пациентов с ущёмлёнными грыжами и перитонитом показали, что внутрибрюшное давление при перитоните суточной давности превышает контрольные показатели более чем в 4 раза и достигает 33,4 мм рт.ст. После выполнения резекции некротизированной тонкой кишки внутрибрюшное давление возрастает (таблица 3.16). Необходимо отметить, что синдром интраабдоминальной гипертензии сохраняется на протяжении семи суток послеоперационного периода, а полученные данные свидетельствуют о том, что при перитоните имеются предпосылки для поддержания развивающихся нарушений, даже после выполнения оперативного пособия.
В настоящее время единственным эффективным методом лечения данного синдрома является хирургическая декомпрессия. После выполненной лапаротомии при вероятном прогрессировании ACS решается вопрос о способе ушивания брюшной стенки, либо использования пролонгированной декомпрессии. При использовании метода программированных лапаротомий одним из вариантов может быть закрытие санированной и дренированной брюшной полости только кожными швами, что значительно увеличивает ее объем и предотвращает повышение внутрибрюшного давления. Подобная тактика показана в тех случаях, когда паретичная тонкая кишка имеет диаметр более 5см. а тяжесть состояния больного по шкале APACHE II превышает 20 баллов. Последующее формирование послеоперационной грыжи у этого тяжелого контингента больных оправдано в столь критической ситуации.
Второй вариант операционной тактики необходимо применять, когда во время вмешательства невозможно полностью устранить источник перитонита или присутствуют признаки анаэробной инфекции – то есть необходимы программированные санации. Оптимальным способом реализации такой тактики является методика, которая бы предусматривала постепенное сближение краев зияющей лапаротомной раны, прикрытой с помощью синтетической заплаты, в частности метод лапаростомии по D.H.Wittmann. В ходе первой операции необходимо устранить в возможном объеме источник перитонита, санировать брюшную полость. Операцию завершают, оставляя лапаротомную рану широко зияющей и прикрывая ее синтетической заплатой. Данная методика предусматривает такой характер поверхности лоскутов заплаты, который позволяет им слипаться между собой. Оба лоскута фиксируют к апоневрозу с каждой из сторон лапаротомной раны. На заплату укладывают тампоны с гидрофильной антисептической мазью. Для повторных вмешательств достаточно разъединить лоскуты синтетической заплаты. После каждой последующей релапаротомии и по мере регресса перитонита края раны постепенно сближают, отсекая излишки синтетической заплаты.
Влияние эффективной декомпрессии брюшной полости наиболее отчётливо прослеживается при перитонитах, возникших вследствие ущемлённых послеоперационных грыж. Собственные исследования показали, что в случае выполнения герниоаллопластики уровень внутрибрюшного давления в послеоперационном периоде значительно ниже (таблица 3.17). Представленные данные свидетельствуют о том, что декомпрессия брюшной полости сопровождается значительным снижением уровня интраабдоминальной гипертензии.
Таблица 3.17. Влияние декомпрессии брюшной полости на уровень
внутрибрюшного давления при перитоните, возникшем
вследствие ущемлённых грыж
Вид герниопластики |
Сутки послеоперационного периода |
|||
1 |
4 |
7 |
10 |
|
Герниоаутопластика |
||||
Дефект до 10 см |
23,8±2,4 |
11,3±0,9 |
7,6±1,5 |
6,9±0,2 |
Дефект более 10 см |
39,9±2,7 |
33,8±1,9 |
19,6±1,2 |
8,2±1,2 |
Герниоаллопластика ненатяжная |
||||
Дефект до 10 см |
19,7±1,5 |
9,6±1,5 |
6,9±2,4 |
7,0±2,4 |
Дефект более 10 см |
22,7±3,4 |
11,4±2,3 |
9,2±1,4 |
7,2±1,2 |
Во всех остальных случаях разлитого перитонита может быть использована временная декомпрессия брюшной полости с помощью провизорных мышечно-апоневротических швов. Эти швы остаются незатянутыми под непрерывным кожным швом после восстановления перистальтики провизорные швы можно затягивать окончательно. Эту манипуляцию лучше выполнять под пролонгированной перидуральной анестезией, которая также способствует снижению внутрибрюшного давления за счет релаксации мышц живота.
Определение критериев, лечебно-диагностических аспектов ACS имеет своей целью выделить особый фактор внутрибрюшинного давления, как важный элемент, способствующий прогрессированию органной дисфункции и объективно влияющий на результаты лечения. При этом трудно установить зависимость внутрибрюшного давления от объема брюшной полости. Способность к растяжению брюшной стенки уменьшается по мере увеличения содержимого живота (кровотечение, парез кишечника). При этом внутрибрюшное давление возрастает непропорционально резко в ответ на одинаковый прирост объема живота [Schein M., 1995]. На растяжимость брюшной стенки влияют также степень развития мышц живота, подкожного жирового слоя, ригидность брюшины и внутрибрюшной фасции. Повышение внутрибрюшного давления не всегда сопровождается возникновением ACS, именно поэтому в литературе нет точных его цифр, при котором развивается этот синдром. Однако существует закономерность: чем выше внутрибрюшное давление и чем больше факторов, приводящих к повышению внутрибрюшного давления, тем более вероятным является развитие ACS. При этом, чем быстрее нарастает внутрибрюшное давление, тем выше вероятность возникновения ACS [Sugerman H.J., 1999]. Интраабдоминальная гипертензия может приводить к ACS уже при 10 мм. рт. ст., но наиболее часто он отмечается при уровне давления, превышающем 20-25 мм. рт. ст. По выраженности интраабдоминальной гипертензии целесообразно выделять 4 степени: первая – давление в брюшной полости 10-15 мм. рт. ст.; вторая – 16-25 мм. рт. ст.; третья – 26-35 мм. рт. ст.; четвёртая – более 35 мм. рт. ст. [Harman P.K., 1982; Harrahill M., 1998; Sugrue M., 1999]. Очень важным показателем в развитии ACS играет время интраабдоминальной гипертензии [Зубрицкий В.Ф., 2009].
Гипоксия
Не вызывает сомнения факт развития кислородной недостаточности, как один из важных патогенетических аспектов перитонита. В настоящее время многие стороны этого направления изучены достаточно подробно. По данным Н.К.Дорониной (1964), при перитоните, как в клинике, так и в эксперименте, содержание кислорода в артериальной крови понижается на 2-3 объёмных процента, а в венозной – на 3-4 объёмных процента. В результате насыщение артериальной крови кислородом составляет в среднем 75%, а венозной – 47% [Ротенберг Д.Л., 1963; Крижановский Н.А., 1967; Медведев В.Ф., 1975]. Исследования И.К.Сологуба (1969) показали, что практически во всех органах интенсивность поглощения кислорода уменьшается: в печени, почках и кишечнике – почти в два раза, в мышцах кишечника – в 2,5 раза. При этом наблюдался метаболический ацидоз, респираторный алкалоз с последующим переходом в респираторный ацидоз. Развивающаяся кислородная недостаточность в значительной степени поддерживается нарушениями внешнего газообмена в силу сопутствующего пареза кишечника, ведущего к ограничению подвижности диафрагмы. По данным Х.Э.Ахунеянова и Г.Я.Базаровича (1967), объём лёгочной вентиляции при перитонитах снижен почти вдвое, а жизненная ёмкость лёгких - в 1,5 раза. Снижение значения этих параметров, согласно данным Wacul (1973), сочетается с уменьшением альвеолярного pO2, альвеолярного вентиляционного объёма и альвеолярного кровотока. Не менее важную роль в поддержании кислородной недостаточности играют волемические нарушения, связанные с централизацией кровообращения [Маломан Е.П., 1965; Weleh, 1964], депонированием крови в органах брюшной полости и увеличением вязкости крови. По данным В.Ф.Медведева, централизация кровообращения сопровождается расстройством как общей, так и региональной гемодинамики. При анализе ряда клинических наблюдений снижение минутного объёма сердца отмечено в 72% случаев, увеличение периферического сопротивления – в 28%. Наблюдались расстройства портальной гемодинамики. Таким образом, проявления кислородной недостаточности при перитоните протекают по типу смешанной гипоксии.
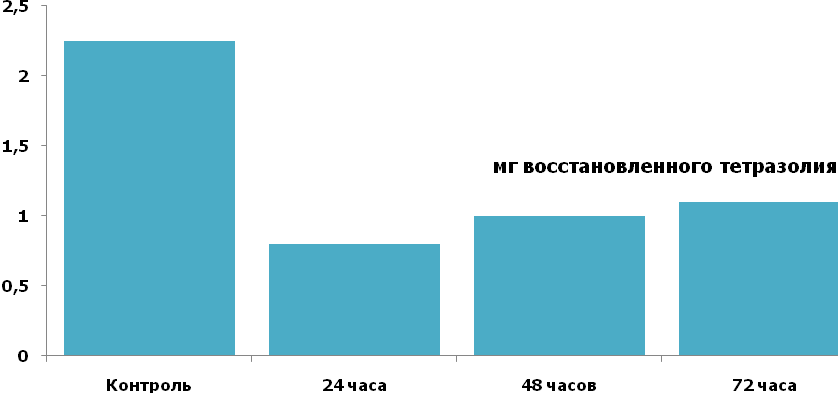
Рис.3.5. Активность сукцинатдегидрогеназы кишечной стенки при
перитоните в различные сроки послеоперационного периода
Следует подчеркнуть, что развивающаяся при перитоните гипоксия в полной мере характерна для стенки тонкой кишки. Специально проведённые исследования показали, что уже при перитоните суточной давности активность сукцинатдегидрогеназы в кишечной стенке снижается более чем в два раза и остаётся примерно на том же уровне в течение двух последующих суток (рис.3.5). Аналогичная тенденция прослеживается и со стороны цитохромоксидазы. Есть все основания считать, что нарушение функции кишечника при перитоните связано с развитием гипоксии в стенке кишки. Продолжительность перитонита существенного значения на тканевую гипоксию не оказывает. Полученные данные указывают на то, что резервы для коррекции гипоксии кишечной стенки сохраняются и при длительно существующем перитоните. Это необходимо учитывать при назначении комплекса интенсивной терапии при запущенных перитонитах.
Состояние иммунитета
Состоянию иммунной защиты при перитоните посвящено достаточно большое число исследований. Согласно собственным данным, при перитонитах, возникших в результате перфорации полого органа, нарушения иммунных реакций очевидны, но не столь существенны. При анализе иммунного статуса у 38 больных с перфоративными язвами досуточной давности установлено нарушение дифференцировки иммунокомпетентных клеток на фоне повышения в крови циркулирующих иммунных комплексов и снижения фагоцитарной активности нейтрофилов. Более выраженные проявления иммунодефицита прослеживаются у больных старше 60 лет (таблица 3.20). Углубление вторичного иммунодефицита характерно для перитонитов в стадии полиорганной дисфункции, когда страдает Т- и В-клеточное звено иммунитета, снижается фагоцитарная активность нейтрофилов, нарушается функция презентации антигена моноцитами HLA-DR+. В ряде случаев углубление иммунодефицита и ухудшение кооперации клеток в ходе иммунного ответа являются прогностически значимыми. Наиболее часто при травме и гнойной инфекции развиваются дефекты иммунной системы, проявляющиеся лимфопенией, миелодепрессией, снижением CD4+ и CD4/CD8, активностью NK-клеток, синтезом и выбросом цитокинов (IL-2, IL-3, IFN-γ), дифференцированными повреждениями IL-1,8 и αTNF, моноцитозом, ухудшением качественных характеристик хемотаксиса и фагоцитоза, выбросом неоптеринов и свободных кислородных радикалов [Ерюхин И.А., 2006].
Рекомендованный для практической деятельности набор лабораторных тестов:
Прокальцитонин,
С-реактивный белок,
Фагоцитарная способность нейтрофилов,
Уровень иммуноглобулинов IgG, IgM, IgA.
Концентрация TNF, IL (1, 6, 8), IFN-γ.
Уровень прокальцитонина и С-реактивного белка отражает степень системного воспалительного ответа и служит элементом мониторинга SIRS. Содержание С-реактивного белка более 50 мг/л с высокой чувствительностью и специфичностью говорит о развитии сепсиса. Уровень прокальцитонина 1,5 нг/мл свидетельствует о наличии сепсиса со 100% чувствительностью. Снижение уровня IgM в три раза и снижение уровня IgG наряду со снижением фагоцитарной активности нейтрофилов является признаком SIRS.
Цитокиновая система
В настоящее время физиологическая роль цитокинов интенсивно изучается. Существует мнение о том, что цитокины выступают в роли медиаторов воспаления и являются основными маркерами системной воспалительной реакции. В настоящее время идентифицировано большое число молекул, которые классифицируются как цитокины. К ним относятся колониестимулирующие факторы, факторы роста, интерлейкины, фактор некроза опухоли и интерферон.
Все цитокины имеют общие свойства:
Низкую молекулярную массу;
Аутокринный и паракринный способ клеточной регуляции;
Участие в развитии иммунного ответа и воспаления;
Связь с высокоаффинными рецепторами, специфичными для каждого цитокина или групп цитокинов;
Участие в регуляции синтеза ДНК, РНК и белка в клетках;
Плеотропную биологическую активность;
Взаимодействие друг с другом и другими медиаторами.
Таблица 3.18
Профиль цитокинов, синтезирующихся Th1-, Th2-, Th0-клетками
Цитокины |
Th1 |
Th2 |
Th0 |
В-клетки |
Макрофаги |
IL-2 |
++ |
|
+ |
|
|
γ-Интерферон |
++ |
|
+ |
|
|
Лимфотоксин |
+ |
|
+ |
|
|
IL-3 |
+ |
+ |
+ |
|
|
αTNF |
+ |
+ |
+ |
|
++ |
Хемокин |
+ |
+ |
+ |
|
++ |
IL-1 |
|
|
|
|
++ |
IL-4 |
|
++ |
+ |
+ |
|
IL-5 |
|
++ |
+ |
|
|
IL-6 |
|
++ |
+ |
|
|
IL-9 |
|
++ |
+ |
|
|
IL-10 |
|
++ |
+ |
+ |
|
IL-12 |
|
|
|
|
++ |
IL-13 |
|
++ |
|
|
|
Каждый цитокин обладает перекрещивающейся, синергической или ингибирующей активностью по отношению к другим цитокинам. Это свойство цитокинов обеспечивает оптимальное развитие иммунных реакций в рамках так называемой «цитокиновой сети». Последняя рассматривается как саморегулирующаяся система, в функционировании которой, наряду с самими цитокинами, принимают участие другие молекулы, в том числе антагонисты цитокиновых рецепторов, растворимые рецепторы цитокинов, антитела к цитокинам, ингибиторные белки. По функциональной активности цитокины можно условно подразделить на пять основных групп:
«провоспалительные» - IL-1, αTNF, γ-интерферон, хемокины.
участвующие в клеточной деструкции – TNF, IL-2, IL-15, γ-интерферон.
способствующие синтезу антител – IL-4, IL-5, IL-6, IL-9, IL-10, IL-13.
участвующие в аллергических реакциях – IL-3, IL-4, IL-5, IL-9, IL-13.
«противовоспалительные» IL-4, IL-10, трансформирующий фактор роста (bТФР).
В настоящее время установлено, что характер антиген-специфического иммунного ответа зависит от селекции или преимущественной активации определенных субпопуляций CD4+ Т-лимфоцитов. Эти клетки синтезируют разные цитокины, что лежит в основе развития различных эффекторных механизмов иммунного ответа. Выделяют три субпопуляции CD4+ Т-лимфоцитов, которые обозначаются как Th1-, Th2-, Th0-клетки и участвуют в синтезе большой группы цитокинов (таблица 3.18). Различие в профиле синтеза цитокинов определяет соответственно Th1- и Th2-типы иммунного ответа. Полагают, что Th2-клетки обеспечивают вспомогательный сигнал в отношении синтеза антител, в то время как Th1-клетки вовлечены в реакции гиперчувствительности замедленного типа, клеточной цитотоксичности и воспаления. Кроме того, в процессе своего развития CD4+ Т-лимфоциты часто проходят через Th0-стадию. Эти клетки синтезируют IL-2, IL-4, IL-5 и, вероятно, другие типы цитокинов. Выделена еще одна клеточная популяция, активно вырабатывающая b-ТФР, которая получила название Th3. Особенностью действия цитокинов Th1-, Th2-клеток является угнетение дифференцировки и эффекторных функций реципрокных фенотипов клеток. При аутоиммунных заболеваниях и различных видах воспаления, как правило, наблюдается продукция цитокинов как Th1-, так и Th2- типов.
Таблица 3.19.
Содержание в плазме крови при распространённом перитоните цитокинов
Показатель (нг/мл) |
До- и послеоперационный период |
Контроль |
||
До операции |
1-3 сутки |
5-7 сутки |
||
IL-8 |
19, 6±3,2 |
13,5±2,5 |
12,3±2,8 |
12,6±1,7 |
IL-10 |
1,5±0,3 |
2,5±0,5 |
1,7±0,2 |
2,9±0,6 |
αTNF |
1,1±0,2 |
0,4±0,1 |
0,39±0,09 |
0,42±0,2 |
Нормальный уровень IL-1,6,8 и αTNF колеблется от 0 до 100 пкг/мл, а летальной считается концентрация 3000-4000 пкг/мл. αTNF считается маркером шока. IL-8 является маркером отдалённых проявлений сепсиса (гипоксия, диссеминированное внутрисосудистое свёртывание, смерть).
Наиболее сложна роль медиаторов иммунного ответа в патогенезе синдрома полиорганной дисфункции. Изучается роль интерлейкинов, комплемента, αTNF, фактора активации тромбоцитов, NO, кооперация факторов свёртывания, фибринолиза и С-реактивного белка [Ерюхин И.А., 2006].
По нашим данным, при перитоните отмечается повышение на 28% в плазме крови концентрации IL-8, концентрации αTNF - в пять раз. Отмечено также снижение содержания IL-10 в 2,3 раза. При благоприятном течении заболевания относительная нормализация уровня цитокинов наступает не ранее седьмых суток послеоперационного периода (таблица 3.19).
Полученные данные свидетельствуют о том, что содержание цитокинов в плазме крови изменяется существенно. Принимая во внимание их мониторинг, при распространённом перитоните есть все основания считать, что их неконтролируемый выброс в системный кровоток приводит к появлению клинических проявлений системной воспалительной реакции.
Таблица 3.20. Показатели иммунитета при перфоративных язвах, осложнённых досуточным перитонитом
Показатель |
Контроль |
Возраст (годы) |
Размер язвенного инфильтрата |
|||
до 40 лет |
40-60 лет |
Старше 60 лет |
до 1,5 см |
1,5 см и более |
||
M±m |
M±m |
M±m |
M±m |
M±m |
M±m |
|
CD 3+ (%) |
64,64±3,9 |
62,8±1,77 |
66,0±1,15 |
66,5±1,5 |
63,7±1,62 |
64,5±2,06 |
CD 4+ (%) |
38,64±3,95 |
39,9±1,42 |
40,7±0,67 |
37,0±3,0 |
38,6±0,94 |
43,0±2,65 |
CD 8+ (%) |
23,44±2,63 |
30,1±0,77* |
34,0±1,15** |
30,0±0,0* |
30,5±0,82* |
31,8±1,18* |
CD 19+ (%) |
18,8±2,29 |
20,5±0,96 |
22,7±1,67 |
20,5±0,5 |
19,8±0,41 |
24,0±2,16 |
ФП (%) |
66,32±4,11 |
39,8±2,13** |
36,0±3,06** |
43,0±5,0** |
38,3±1,23** |
43,0±5,8** |
ФЦ |
4,6±1,8 |
6,3±0,53 |
6,0±1,15 |
6,0±2,0 |
6,3±0,54 |
6,0±0,82 |
IgG (г/л) |
14,72±0,94 |
13,1±0,72 |
9,7±2,16* |
15,3±1,8 |
12,8±0,58 |
12,5±2,71 |
IgM (г/л) |
0,99±0,27 |
1,1±0,10 |
1,2±0,18 |
0,9±0,26 |
1,1±0,10 |
0,9±0,10 |
IgA (г/л) |
1,35±0,21 |
2,9±0,19** |
2,8±0,20** |
2,9±0,08** |
2,8±0,16** |
3,1±0,21** |
ЦИК (уе) |
15,12±6,11 |
30,1±6,10 |
37,3±14,1 |
40,5±4,5** |
35,8±5,89* |
23,8±6,93 |
CD 4+/CD 8+ |
1,66±0,23 |
1,3±0,03 |
1,2±0,04 |
1,2±0,1 |
1,3±0,03 |
1,4±0,06 |
CD 3+ абс. |
1,04±0,19 |
1,3±0,29 |
1,0±0,28 |
1,0±0,74 |
1,2±0,21 |
1,3±0,66 |
CD 4+ абс. |
0,6±0,12 |
0,8±0,19 |
0,6±0,17 |
0,6±0,47 |
0,7±0,12 |
0,9±0,48 |
CD 8+ абс. |
0,38±0,08 |
0,6±0,14 |
0,5±0,15 |
0,4±0,34 |
0,6±0,09 |
0,7±0,33 |
CD 19+ абс. |
0,31±0,07 |
0,4±0,11 |
0,3±0,07 |
0,3±0,23 |
0,3±0,06 |
0,5±0,27 |
Уровень статистической значимости различий с показателями контрольной группы *p<0,05; **p<0,01 |
||||||
