
Материальный баланс печи кс-450
Привод |
Количество |
Расход |
Количество |
||
кг |
м3 |
кг |
м3 |
||
Колчедан Влага колчедана Сухой воздух . . . Влага с воздухом |
18 768 1 198 49 400 358 |
- -
38147445 |
Огарок Обжиговый газ: SO2 SO3 O2 N2 Н2O |
14038
15337 129 1063 37600 1556 |
5243 36 744 30136 1936
|
Всего |
69 724 |
38092 |
Всего |
69 724 |
38 095 |
Объем паров в воздухе (при 20° С и относительной влажности воздуха ȹ = 50% давление паров воды в нем PН2O = 8,77 мм.рт.ст)

Общий объем паров воды в обжиговом газе'
![]()
Тепловой баланс печи КС-450
Приход |
Количество |
Расход |
Количество |
||
10-3 кДж |
% |
103 кДж |
% |
||
Тепло сухого колчедана
Тепло влаги колчедана
Тепло сухого воздуха
Тепло влаги воздуха
Тепло горения колчедана |
204
101
993
13,4
100 656 |
0,20
0,10
0,97
0,01
98,72 |
Тепло огарка
Тепло обжигового газа
Теполопотери
Тепло на получение пара в кипящем слое |
8 380
46 128
1 022
46 437 |
8,2
45,3
1,0
45,5 |
Всегo |
~ 101 967 |
100 |
Всего |
101 967 |
100 |
Как видно из таблицы теплового баланса, тепло горения колчедана преобладает над другими статьями прихода тепла, так что ими можно пренебречь в ориентировочных расчетах. В таблице учтено тепло, израсходованное на получение пара непосредственно в кипящем слое. Однако пар получается также за счет использования тепла отходящего обжигового газа. Таким образом, большая часть тепла горения колчедана используется полезно.
Расчет основных показателей печи КС-450
Исходные данные для расчета:
Высота кипящего слоя печи КС в спокойном состоянии, H0, м …1,0
Интенсивность работы печи I, кг/м3 сут ………………..10000
Количество сжигаемого сухого колчедана, содержащего 41% S,
Gколч, кг/ ч …………...18 768
Температура газа, °С
на входе в котел-утилизагор tвх ……………….850
на выходе из котла-утилизатора tвых ………………450
Теплоемкость обжигового газа сг, кДж/ м3 ………………….1,43
Диаметр печи определяем исходя из уравнения
![]()
где F — поверхность пода печи, м2,
G' — количество сухого колчедана (45% S), сжигаемого в печи, определяют по формуле
![]()

 Рис
8. Диаграмма теплового баланса печи
КС-10
Рис
8. Диаграмма теплового баланса печи
КС-10
Количество тепла, используемого в котле-утилизаторе (если потери тепла в нем составляют 1%), определяют по уравнению
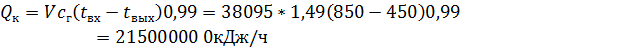
Общее количество используемого тепла (в печи КС и в котле-утилизаторе) составляет [учитывая, что Qп = 46 437 000 кДж/ч (см тепловой баланс)]
![]()
Количество получаемого пара
![]()
где q — энтальпия пара при 40 атм, q = 2790 кДж/кг.
Количество получаемого пара в пересчете на 1 т H2SO4
![]()
или 1,17 т/т H2S04.
Окисление диоксида серы. Реакция
SO2 + 1/2O2 = SO3
является обратимой, экзотермической, протекает на катализаторе с уменьшением объема. Тепловой эффект реакции при температуре 500 °С Qp = 94,2 кДж/моль. Константа равновесия Кр [атм-0.5] зависит от температуры и в интервале 400 - 700 °С равна
Ig Кр = 4905/T- 4,6455.
Согласно закону действующих масс, при равновесии
![]()
где PSO3.p , PSO2.p p , PO2 p - парциальные давления соответствующих компонентов в состоянии равновесия, атм.
Абсорбция триоксида серы - последняя стадия процесса, в которой образуется серная кислота. Взаимодействие SO3 с Н2O
S03 + Н20 = H2S04
протекает достаточно интенсивно как в жидкой, так и в газообразной (паровой) фазах. Кроме того, H2S04 может растворять в себе SO3, образуя олеум Этот продукт удобен для транспортировки, поскольку он не вызывает коррозии даже обычных сталей. Растворы сер ной кислоты чрезвычайно агрессивны. Олеум является основным продуктом сернокислотного производства.
Рис. 9. Схема реактора окисления S02;
1 - слои катализатора; 2 - промежуточные теплообменники; 3 - смеситель; 4 - внешний теплообменник; Хг - ввод холодного газа

Особенностью системы "H2O-H2SO4-SO3" является то, что в широком интервале концентраций раствора H2SO4 в паровой фазе присутствуют почти чистые пары воды, а над олеумом (раствор SO3 в H2SO4) в газовой фазе преобладает S03. Одинаковый состав жидкой и паровой фаз (азеотропная точка) будет при концентрации серной кислоты 98,3%. Если S03 поглощать раствором с меньшей концентрацией, то реакция (5.11) будет проте кать и в паровой фазе - будет образовываться туман серной кислоты, который уйдет из абсорбера с газовой фазой. А это - и потери продукта, и коррозия аппаратуры, и выбросы в атмосферу. Если SO3 абсорбировать олеумом, то поглощение будет неполным.
Из этих свойств следует двухстадийная (двухбашенная) схема абсорбции (рис. 10.). Газ, содержащий S03, после реактора проходит последовательно олеумный 1 и моногидратный 2 абсорберы. Другой компонент реакции (Н2О) подается противотоком в моногидратный абсорбер. За счет интенсивной циркуляции жидкости (абсорбента) в ней можно поддерживать близкую к оптимальной концентрацию H2S04 - 98,3% (увеличение концентрации за проход жидкости не более 1-1,5%). Техническое название такой кислоты - моногидрат, откуда и название абсорбера. Концентрационные условия абсорбции обеспечивают полное поглощение S03 и минимальное образование сернокислотного тумана. Кислота из моногидратного абсорбера поступает в олеумный. В нем циркулирует 20%-й раствор SO3 в H2SO4, который частично отбирается как конечный продукт - олеум. Кислота из предыдущего абсорбера - моногидрат - также может быть продуктом.

Рис. 10. Схема отделения абсорбции в производстве серной кислоты:
1 - олеумный абсорбер; 2 - моногидратный абсорбер; 3 - холодильники; 4 - сборники кислоты; 5 - брызгоотделитель
Образование серной кислоты и абсорбция триоксида серы - экзотермические процессы. Их тепло снимается в оросительных теплообменниках 3 на линии циркуляции жидкости в абсорберах. При температуре менее 100 °С SO3 поглощается практически на 100%. Диоксид серы практически не абсорбируется.
