
- •Общие закономерности химических процессов Энергетика (термодинамика) химических процессов.
- •Контрольные задания
- •Химическая кинетика и равновесие
- •Контрольные задания
- •Строение вещества
- •Контрольные задания
- •Окислительно-восстановительные реакции
- •2. Расстановка коэффициентов в уравнении реакции
- •3. Проверка правильности расстановки коэффициентов в уравнении реакции
- •Контрольные задания

Учебные занятия студентов-заочников по курсу химии состоят из изучения материала по учебникам или учебным пособиям, выполнения контрольных заданий, лекций, выполнения лабораторных работ, сдачи зачета по лабораторному практикуму и экзамена по всему курсу.
В процессе изучения курса общей химии студент должен выполнить контрольные задания. К выполнению контрольного задания следует приступать только после изучения соответствующего материала по учебнику.
1. ОФОРМЛЕНИЕ
Контрольные работы должны быть аккуратно оформлены в тетради. Для замечаний надо оставить поля. Условия задач следует писать в том порядке, в каком они указаны в задании.
Ответы на контрольные вопросы заданий должны быть краткими и ясными, но не односложными (ответ должен быть мотивирован). При решении задач нужно приводить весь ход решения.
ЛИТЕРАТУРА:
1. Глинка Н.Л.Общая химия.- Л.: Химия, 2006 .
2. Коровин Н.В., Масленникова Г.Н., Мингулина Э.И., Филиппов Э.Л. Курс общей химии.- М.: Высшая школа, 1990 .
3. Коровин Н.В. Общая химия.- М.: Высшая школа, 2002.
4.Глинка Н.Л. Задачи и упражнения по общей химии.- Л.:Химия,2008.
5.Коровин Н.В, Мингулина Э.И., Рыжова Н.Г. Лабораторные работы по химии.- М.:Высшая школа, 2008.
6. Коровин Н.В. Общая химия.- М.: Высшая школа, 2008.
ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНЫХ РАБОТ
№ вар. |
№ контрольных заданий |
1 |
2, 11,16, 22, 31, 40, 43 |
2 |
4, 9, 17, 27, 34, 46, 48 |
3 |
3, 10, 19, 28, 32, 36, 41 |
4 |
1, 12, 15, 28, 35, 44, 47 |
5 |
7, 9, 18, 25, 29, 36, 38 |
6 |
2, 8, 15, 26, 33, 42, 47 |
7 |
5, 11, 17, 25, 35, 46, 49 |
8 |
5, 13, 21, 24, 34, 39, 45 |
9 |
6, 14, 19, 22, 31, 39, 43 |
10 |
1, 14, 16, 23, 29, 42, 49 |
11 |
4, 10, 18, 24, 30, 37, 38 |
12 |
3, 8, 20, 27, 33, 37, 41 |
13 |
7, 13, 21, 26, 32, 40, 45 |
14 |
6, 12, 20, 23, 30, 44, 48 |
Общие закономерности химических процессов Энергетика (термодинамика) химических процессов.
Термодинамика изучает законы перехода различных видов энергии. При химических реакциях эти изменения сопровождаются поглощением или выделением энергии в виде теплоты. Реакции, которые сопровождаются поглощением теплоты, называются эндотермическими, а реакции, сопровождающиеся выделением теплоты - экзотермическими.
Каждая система при постоянных физических условиях обладает определенным запасом энергии, называемым внутренней энергией системы /U/. Она состоит из энергии движения и местоположения, молекул, атомов, ядер и электронов, а также энергии, обусловленной силами притяжения и отталкивания между ними. Однако внутренняя энергия не включает кинетическую энергию движения системы в целом и потенциальную энергию положения системы в пространстве.
При любом процессе соблюдается закон сохранения энергии. Теплота (q) подведённая к системе, расходуется на изменение внутренней энергии (Δ U) и на совершение работы (А).
q = Δ U + A
При постоянном давлении (это большинство химических процессов) работа – это работа по изменению объёма, т.е. А = p · Δ V, где р - давление в системе, а Δ V- изменение объёма системы (Vкон. - Vнач.)
В этом случае q p = Δ U + p · Δ V
или q p = (Uкон. – Uнач.) + p (Vкон. – Vнач.)
q p = (Uкон. + pVкон.) – (Uнач. + р Vнач.)
Сумму U + pV обозначают через H и называют энтальпией. Отсюда теплота реакции (тепловой эффект) при постоянном давлении равна изменению энтальпии системы:
q p = Hкон. – Hнач. = Δ Н
Энтальпия
– термодинамическая функция состояния
системы, поэтому абсолютное значение
энтальпии системы определить невозможно
и рассчитывают только
изменение энтальпии (Δ
Н). В
термохимических
расчётах
энтальпия всегда выражается через Δ
Н.
Для сравнения энтальпии (тепловых
эффектов) различных процессов значения
этих величин приводят к одинаковым
условиям, и в таблицах представлены
стандартные
значения энтальпии
(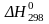 ).
В качестве
стандартных условий выбраны:
).
В качестве
стандартных условий выбраны:
температура 298 К (25 0С)
давление 101,3 кПа (1 атм).
ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ПРОСТЫХ ВЕЩЕСТВ принимается равной нулю, если их агрегатные состояния и модификации при стандартных условиях устойчивы.
Например: графита/тв/ = 0,0 кДж/моль
алмаза/тв/ = 1,9 кДж/моль
ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ СЛОЖНОГО ВЕЩЕСТВА равна энтальпии реакции образования одного моль этого вещества из простых веществ.
Пример 1. Энтальпия образования воды:
2H2(г) + O2(г) =2H2O(г) = - 484кДж.
Отсюда следует, что энтальпия образования воды в газовой фазе равна - 484кДж : 2моль = -242 кДж/моль
ЭНТАЛЬПИЯ РЕАКЦИИИ рассчитывается из следствия закона Гесса: «Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов».
ΔНр = ∑(n∙ΔH)прод. - ∑(n∙ΔH) исх.,
где n – число молей.
Пример 2. Рассчитать тепловой эффект реакции. Указать эндо- или экзотермическая реакция при стандартных условиях.
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г)
Число молей,n 4 5 4 6
Энтальпия, -46,0 0 +91,0 -242,0
∆Н0реакции = [4(+91)+6(-242)]-[4(-46)+5·0]= -904кДж.
Так как ∆ Н< О, данный процесс сопровождается выделением тепла, т.е. является экзотермическим.
Термодинамика устанавливает также направление самопроизвольного протекания процессов в данных условиях. При выяснении природы самопроизвольного протекания реакции было установлено, что самопроизвольные реакции сопровождаются экзотермическим эффектом (∆Н<Ο). Однако связь между снижением энтальпии системы и самопроизвольностью протекания процесса является недостаточным фактором.
Другим фактором определения самопроизвольности протекания процессов является термодинамическая функция называемая энтропией (S). Энтропия является мерой упорядоченности состояния системы. В ходе химической реакции энтропия системы изменяется. Это изменение называется энтропией реакции.
ЭНТРОПИЯ РЕАКЦИИ также рассчитывается по следствию закона Гесса.
∆Sp = ∑ (n · S) прод.— ∑ (n ∙ S) исх.
Пример 3. Рассчитать изменения энтропии системы при реакции в стандартных условиях.
N2(г) + О2(г) = 2NO(г)
Число молей, n 1 1 2
Энтропия
 192 205 211
192 205 211
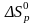 = 2 · 211—(1 · 192 + 1·205) =14 Дж/моль. К
= 2 · 211—(1 · 192 + 1·205) =14 Дж/моль. К
Все процессы, которые протекают с уменьшением порядка системы, сопровождаются увеличением энтропии и наоборот. Самопроизвольно протекают процессы, идущие с увеличением энтропии. Для процессов протекающих в изобарно - изотермических условиях (p = const, T = const) движущей силой самопроизвольного процесса является стремление системы перейти в состояние с наименьшей энтальпией (энтальпийный фактор), либо с увеличением энтропии (энтропийный фактор). Устойчивому состоянию системы соответствует равенство этих факторов.
∆Н = Т ∙ ∆S
Термодинамическая функция, показывающая насколько система в данном состоянии отклонилась от равновесного, называется энергией Гиббса (G).
∆G = ∆Н − Т ∙ ∆S
Если: ∆G < 0, процесс может протекать самопроизвольно в прямом направлении;
∆G = 0, процесс в состоянии равновесия;
∆G > 0, процесс самопроизвольно в прямом направлении
проходить не может.
Из соотношения ∆G = ∆Н − Т ∙ ∆S видно, что самопроизвольно могут протекать процессы:
экзотермические: (∆Н < 0). Для которых: ∆S > 0.
эндотермические: ( ∆Н > 0). Для которых: ∆S > 0, но /Т·∆S/>/∆Н/,т.е. при высоких температурах.
ЭНЕРГИЯ ГИББСА РЕАКЦИИ также рассчитывается по следствию закона Гесса.
∆Gp = ∑ (n · ∆G) прод.— ∑ (n ∙ ∆G) исх.
Пример 4.Указать возможность самопроизвольного протекания реакции при стандартных условиях. СО2(г) +С(графит) = 2СО(г)
Число молей, n 1 1 2
Энергия Гиббса,
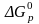 -394 0 -137
-394 0 -137
= [ 2 · (-137)] − [1 · (-394) + 1 · 0 ] = + 120 кДж/моль
Так как > 0, в данных условиях процесс невозможен.
