
- •Общая характеристика химических соединений и их классификация.
- •24.02.2010Г. Технология тонкого неорганического синтеза. Лекция 2. Основные понятия и определения.
- •24.03.2010Г. Технология тонкого неорганического синтеза. Лекция 3. Способы химического осаждения и их характеристика.
- •Способы химического осаждения.
- •07.04.2010Г. Технология тонкого неорганического синтеза. Лекция 4.
- •21.04.2010Г. Технология тонкого неорганического синтеза. Лекция 5. Гомогенные методы химического осаждения.
- •Осаждение под повышенным давлением (гетермальный синтез).
- •05.05.2010Г. Технология тонкого неорганического синтеза. Лекция 6.
- •Образование химических осадков.
- •19.05.2010Г. Технология тонкого неорганического синтеза. Лекция 7.
- •08.09.2010Г. Технология тонкого неорганического синтеза. Лекция 1. Образование осадка.
- •Полнота осаждения. Влияние факторов на степень осаждения твердой фазы.
- •21.09.2010Г. Технология тонкого неорганического синтеза. Лекция 2.
- •Вторичные химические взаимодействия при контакте твердой фазы с жидкой фазой.
- •Старение осадка.
- •Основные закономерности осаждения химических осадков.
- •05.10.2010Г. Технология тонкого неорганического синтеза. Лекция 3.
- •Получение химических соединений с комплексом заданных свойств.
- •Загрязнение химических осадков.
- •19.10.2010Г. Технология тонкого неорганического синтеза. Лекция 4.
- •2.11.2010Г. Технология тонкого неорганического синтеза. Лекция 5
- •Влияние внешнего загрязнения на образования особо чистых веществ.
- •Влияние микропримесей на свойства.
- •Получение неорганических соединений высокотемпературным способом.
- •Получение гидроксидов металлов.
- •16.11.2010Г. Технология тонкого неорганического синтеза. Лекция 6
- •Нитраты металлов как исходное сырье для получения оксидов металлов.
- •Хлориды металлов как исходные реагенты для получения оксидов металлов.
- •Сульфаты металлов как исходные реагенты для получения оксидов металлов.
- •Карбонаты металлов как исходные реагенты для получения оксидов металлов.
- •Использование гидротированных оксидов металлов как исходных реагентов.
- •07.12.2010Г. Технология тонкого неорганического синтеза. Лекция 7 Получение солей высокотемпературным методом.
- •Нанотехнологии.
- •Способы получения.
Образование химических осадков.
Все химические осадки согласно классификации Орманта можно разделить на 4 генетических типа (по кристаллическим осадкам). В основе первых двух типов лежат процессы кристаллизации, не сопровождающиеся одновременно химическими реакциями возникновения кристаллов.
Эти два типа не связаны с протеканием химической реакции.
Первый тип характерен для процессов кристаллизации в однокомпонентных системах. Второй тип – в двухкомпонентных (или поликомпонентных) системах, например, кристаллизация в системе NaCl – H2O. Хлорид натрия не вступает в реакцию с водой.
Третий и четвертый типы отличаются тем, что одновременно с образованием кристаллов идет химическая реакция. Чаще всего химическая реакция предшествует образованию кристаллов. Для третьего типа кристаллизации характерны два вида химического взаимодействия: 1) химическое взаимодействие протекает в растворе; 2) взаимодействие на поверхности кристаллов. Взаимодействие может протекать на любой твердой поверхности.
Четвертый тип характеризуется тем, что кристаллы образуются из аморфного вещества или из кристаллов другого химического вещества. Поливалентные металлы образуют трудно растворимые осадки в рентгеноаморфном состоянии, однако, данные осадки во времени и под действием температуры переходят в кристаллическое состояние. Из аморфного в кристаллическое состояния переходят такие оксиды металлов, как оксид железа, титана, циркония и др. При этом продолжительность перехода зависит от природы катиона. Одни рентгеноаморфные осадки приходят в кристаллическое состояние в течение нескольких часов, другие – суток или лет. Например: CaCl2+NH3=CaCl2*NH3
В сложных системах с осадками переменного состава идет не один, а два последовательных процесса резко отличающиеся друг от друга. Т.е. имеет место образование первичного осадка при взаимодействии исходных компонентов и вторичного осадка в результате межфазного взаимодействия первичного осадка с жидкой фазой. Образование вторичного осадка – типичный процесс, протекающий на межфазовой поверхности, которой является твердая фаза.
19.05.2010Г. Технология тонкого неорганического синтеза. Лекция 7.
Четвертый тип осадка образуется за счет химического превращения вещества, за счет чего формируется кристаллическая структура или за счет перехода вещества из аморфного состояния в кристаллическое. Аморфный тип осадков распространен и особенностью образования кристаллических осадков данного типа является наличие химических и фазовых превращений, в результате которых образуется кристаллическая структура.
Al(NO3)3+NH3+H2O=[Al2O3*nH2O*zNO2] (аморфное соединение).Оно имеет избыточную поверхностную энергию. Эта фаза метастабильна, неупорядоченная структура. Это соединение реакционно способное. При воздействии каких-то факторов во времени происходит упорядочение в структуре и постепенно из нестабильного состояния система переходит в стабильное. Стабильное состояние характеризуется кристаллической структурой. Al(NO3)3+NH3+H2O=[Al2O3*nH2O*zNO2]→Al2O3*nH2O→Al2O3
Формирование моногидрата или тригидрата зависит от условий старения соединений переменного состава (рН среды, температура, концентрация). По такой схеме образуются гидратированные оксиды не только алюминия, но и других поливалентных металлов. По такой схеме получают трудно растворимые соли (бораты, фосфаты и т.д.). Образование кристаллической структуры происходит по всей вероятности по двум механизмам – классическому (раствор - насыщенный раствор – пересыщенный раствор – образование зародышей – рост зародышей) и механизму ориентированного наращивания. Преимущественным является механизм ориентированного наращивания.
Механизм возникновения твердой фазы.
Согласно работам Веймана, образование твердой фазы протекает в две стадии: 1) образование зародыша, 2) рост зародыша. Скорость образования зародыша:
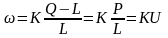 ,
где К – коэффициент уравнения (константа
скорости), Q – масса образовавшейся
твердой фазы в единице реакционного
объема, L – растворимость макрочастицы
в жидкой фазе, Р – абсолютное пересыщение,
U – относительное пересыщение.
,
где К – коэффициент уравнения (константа
скорости), Q – масса образовавшейся
твердой фазы в единице реакционного
объема, L – растворимость макрочастицы
в жидкой фазе, Р – абсолютное пересыщение,
U – относительное пересыщение.
Как только в системе достигается пересыщение той или иной фазы образуется зародыш. При образовании зародышей для системы характерен индукционный период – отрезок времени, в течение которого реакция протекает без видимых изменений. Видимые изменения – наличие поверхности раздела фаз, т.е. образование твердой фазы. При первоначальном взаимодействии компонентов в течение некоторого времени в системе не образуется твердая фаза. При достижении соответствующего соотношения компонентов или температуры, или другого воздействия, возникает твердая фаза, масса которой во времени увеличивается.
При первичном взаимодействии в растворе образуются активные центры, включающие комплексы из агрегатов молекул, Эти комплексы активированные и обладают максимальной потенциальной энергии. Появление раздела связанно с преодолением энергетического барьера. И до тех пор, пока активированные комплексы не смогут преодолеть барьер поверхности раздела фаз не наблюдается. Наступление некоторого критического момента, когда активированные комплексы могут преодолевать барьер, что является образованием твердой фазы.
Кроме того, энергетический процесс, который протекает в системе, связан с дегидратацией ионов, которые имеются в жидкой фазе. Согласно исследованиям, ионы, находящиеся в растворе, имеют гидратные оболочки. Чаще всего выделяют первую и вторую гидратные оболочки. Первая совершает с ионом броуновское движение и связь ион – вода характеризуется определенной энергией связи. Эта связь может оцениваться несколькими десятками кДж/моль. Вторая гидратная оболочка удалена на большее расстояние, и она удерживается за счет электростатических сил. Во время индукционного периода происходит дегидратация ионов и ионы далее участвуют в образовании активированных комплексов. Например, содержание ионов воды в первой и второй гидратных оболочках: Li имеет прочно связанных 6 молекул воды в первой гидратной оболочке, а общее число 10,5; Na – имеет 5,6 молекул в первой гидратной оболочке, Mg – имеет 8 молекул в первой гидратной оболочке и 14 молекул на двух оболочках; Ca – имеет 7,9 на первой оболочке и 13,6 на двух.
Неактивированные комплексы, состоящие из агрегированных молекул, содержит небольшое число ионов. Следовательно, во время индукционного периода в растворе протекает ряд энергетических процессов, которые отличаются по своему тепловому процессу. Упорядочение ионов – процесс экзотермический. Дегидратация – эндотермический процесс. В тот момент, когда появляется свободная энергия, происходит преодоление потенциального барьера и зарождается твердая фаза. Во время индукционного периода жидкая фаза нестабильна. Если рассматривать жидкую фазу с комплексной химии, то в ней происходит образование лабильных комплексов, которые могут менять свой состав и строение. Продолжительность индукционного периода зависит от ряда факторов: 1) от природы среды, т.е. ионов, которые находятся в системе; 2) от параметров систем (температура, концентрация реагентов, рН среды и др.). Для одних систем индукционный период может исчисляться минутами, для других часами или сутками.
Гетерогенное осаждение:
рН

индукционный период
V
Г омогенное осаждение:
тв. фаза

τ, ч
Гетермальный синтез:
к
 рист.
фаза
рист.
фаза
τ, ч
Реакционный гель помещают в автоклав, и результатом является появление кристаллического вещества. При гетермальной обработке происходит формирование индукционного периода – отрезок времени, в течение которой образуется кристаллическая фаза. Скачек исчисляется часами.
При гетермальном синтезе можно варьировать продолжительностью индукционного периода за счет параметров процесса (температуры). Как правило, с увеличением температуры продолжительность индукционного периода сокращается.
