
- •Общая характеристика химических соединений и их классификация.
- •24.02.2010Г. Технология тонкого неорганического синтеза. Лекция 2. Основные понятия и определения.
- •24.03.2010Г. Технология тонкого неорганического синтеза. Лекция 3. Способы химического осаждения и их характеристика.
- •Способы химического осаждения.
- •07.04.2010Г. Технология тонкого неорганического синтеза. Лекция 4.
- •21.04.2010Г. Технология тонкого неорганического синтеза. Лекция 5. Гомогенные методы химического осаждения.
- •Осаждение под повышенным давлением (гетермальный синтез).
- •05.05.2010Г. Технология тонкого неорганического синтеза. Лекция 6.
- •Образование химических осадков.
- •19.05.2010Г. Технология тонкого неорганического синтеза. Лекция 7.
- •08.09.2010Г. Технология тонкого неорганического синтеза. Лекция 1. Образование осадка.
- •Полнота осаждения. Влияние факторов на степень осаждения твердой фазы.
- •21.09.2010Г. Технология тонкого неорганического синтеза. Лекция 2.
- •Вторичные химические взаимодействия при контакте твердой фазы с жидкой фазой.
- •Старение осадка.
- •Основные закономерности осаждения химических осадков.
- •05.10.2010Г. Технология тонкого неорганического синтеза. Лекция 3.
- •Получение химических соединений с комплексом заданных свойств.
- •Загрязнение химических осадков.
- •19.10.2010Г. Технология тонкого неорганического синтеза. Лекция 4.
- •2.11.2010Г. Технология тонкого неорганического синтеза. Лекция 5
- •Влияние внешнего загрязнения на образования особо чистых веществ.
- •Влияние микропримесей на свойства.
- •Получение неорганических соединений высокотемпературным способом.
- •Получение гидроксидов металлов.
- •16.11.2010Г. Технология тонкого неорганического синтеза. Лекция 6
- •Нитраты металлов как исходное сырье для получения оксидов металлов.
- •Хлориды металлов как исходные реагенты для получения оксидов металлов.
- •Сульфаты металлов как исходные реагенты для получения оксидов металлов.
- •Карбонаты металлов как исходные реагенты для получения оксидов металлов.
- •Использование гидротированных оксидов металлов как исходных реагентов.
- •07.12.2010Г. Технология тонкого неорганического синтеза. Лекция 7 Получение солей высокотемпературным методом.
- •Нанотехнологии.
- •Способы получения.
2.11.2010Г. Технология тонкого неорганического синтеза. Лекция 5
Физическая десорбция – дефекты кристаллической структуры, вакансии в узлах решетки, расположенные между элементами решетки, сдвиги и смещения, возникающие при определенных условиях роста кристалла.
Химические микропримеси могут быть разного типа. Микропримеси, которые свободно отдает валентные электроны под воздействием теплового движения. Такие микропримеси сообщают полупроводнику электронный тип проводимости (проводимость n-типа). К числу таких примесей (донорные) относятся фосфор, мышьяк, висмут и другие. Эти примеси обычно характерны для германия и кремния. Второй тип: микропримеси способны присоединять к себе электроны атомов кристаллической решетки основного вещества, такие примеси называются акцепторными. Полупроводники характеризуются дырочной проводимостью или р-типом. Из микропримесей следует выделить бор, алюминий, галлий, индий, титан, а золото, медь, серебро, железо могут проявлять как донорные, так и акцепторные свойства. Общее количество микропримесей можно разделить на три вида: микропримеси, которые влияют на свойства материала; примеси генетического типа; микропримеси элементов с большим кларком. Кларк выражает относительное распространение отдельных химических элементов в земной коре. Этот вид примесей определяется кларком наиболее распространенным и они наиболее трудно удаляются из материала. Данные примеси легко заносятся в материал из окружающей среды. (Кислород, кремний, алюминий, натрий, магний, кальций, железо, калий, углерод, азот, сера, фтор и титан.)
Генетический тип обусловлен происхождением исходного сырья и условиями его последующей переработки. Загрязнение кинетического типа также трудноудалимое. Это связано с тем, что эти микропримеси образую изовалентные и гетеровалентные изоморфные замещения.
Влияние внешнего загрязнения на образования особо чистых веществ.
Внешнее загрязнение – атмосферное, коррозия, диффузия примесей из окружающей среды через стенку аппарата.
Атмосферное загрязнение: в атмосфере находятся оксиды серы, азота, металлов. В США 20 млн. т оксидов серы находятся в воздухе, 30 млн. т – пыли, 1 млн. т – пыльцы растений. Газообразные загрязнения на уровне земли г/м2: СО2 0,4-0,6; СО – 10-4; Cl2 - 2
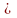 10-6,
CH4
- 9
10-4.
Ежегодно с дождями выпадает 1
108т
серы. Концентрация достигает 22,2мг/л.
Основным источником аммиака и диоксида
азота является почва. Содержание NO2
и NH3
в крупных городах поднимается до
10-г/м3.
Источниками аэрозолей являются океаны.
Аэрозоли содержат мг/кг пыли: Cl2
– 18980, Na
~ 10000, Mg
~ 1000.
10-6,
CH4
- 9
10-4.
Ежегодно с дождями выпадает 1
108т
серы. Концентрация достигает 22,2мг/л.
Основным источником аммиака и диоксида
азота является почва. Содержание NO2
и NH3
в крупных городах поднимается до
10-г/м3.
Источниками аэрозолей являются океаны.
Аэрозоли содержат мг/кг пыли: Cl2
– 18980, Na
~ 10000, Mg
~ 1000.Коррозия: скорость коррозии для нержавеющих сталей 0,5-0,8г/м2ч. Наиболее стойки золото, платина, палладий, иридий – они стойкие в нейтральных средах и температурах не более 2500С. Тантал наиболее стойкий и разрушается только при 200С в 40%-ной плавиковой кислоте, в фосфорной при более 1500С. По стойкости приближается к платине. В качестве материалов используется керамика. Химическая стойкость невысокая. Керамика включает соединения бериллия, магния, марганца, титана, бора и других. Используются эмали, но они тоже не являются химически стойкими.
Область чистых веществ начинается с содержания примесей на уровне 1 10-4-1
10-5 ат. %. Существуют определенные затруднения в определении содержания микропримесей. Получение сверхчистого вещества очень проблематично.
