
- •Общая характеристика химических соединений и их классификация.
- •24.02.2010Г. Технология тонкого неорганического синтеза. Лекция 2. Основные понятия и определения.
- •24.03.2010Г. Технология тонкого неорганического синтеза. Лекция 3. Способы химического осаждения и их характеристика.
- •Способы химического осаждения.
- •07.04.2010Г. Технология тонкого неорганического синтеза. Лекция 4.
- •21.04.2010Г. Технология тонкого неорганического синтеза. Лекция 5. Гомогенные методы химического осаждения.
- •Осаждение под повышенным давлением (гетермальный синтез).
- •05.05.2010Г. Технология тонкого неорганического синтеза. Лекция 6.
- •Образование химических осадков.
- •19.05.2010Г. Технология тонкого неорганического синтеза. Лекция 7.
- •08.09.2010Г. Технология тонкого неорганического синтеза. Лекция 1. Образование осадка.
- •Полнота осаждения. Влияние факторов на степень осаждения твердой фазы.
- •21.09.2010Г. Технология тонкого неорганического синтеза. Лекция 2.
- •Вторичные химические взаимодействия при контакте твердой фазы с жидкой фазой.
- •Старение осадка.
- •Основные закономерности осаждения химических осадков.
- •05.10.2010Г. Технология тонкого неорганического синтеза. Лекция 3.
- •Получение химических соединений с комплексом заданных свойств.
- •Загрязнение химических осадков.
- •19.10.2010Г. Технология тонкого неорганического синтеза. Лекция 4.
- •2.11.2010Г. Технология тонкого неорганического синтеза. Лекция 5
- •Влияние внешнего загрязнения на образования особо чистых веществ.
- •Влияние микропримесей на свойства.
- •Получение неорганических соединений высокотемпературным способом.
- •Получение гидроксидов металлов.
- •16.11.2010Г. Технология тонкого неорганического синтеза. Лекция 6
- •Нитраты металлов как исходное сырье для получения оксидов металлов.
- •Хлориды металлов как исходные реагенты для получения оксидов металлов.
- •Сульфаты металлов как исходные реагенты для получения оксидов металлов.
- •Карбонаты металлов как исходные реагенты для получения оксидов металлов.
- •Использование гидротированных оксидов металлов как исходных реагентов.
- •07.12.2010Г. Технология тонкого неорганического синтеза. Лекция 7 Получение солей высокотемпературным методом.
- •Нанотехнологии.
- •Способы получения.
19.10.2010Г. Технология тонкого неорганического синтеза. Лекция 4.
Виды адсорбции:
Адсорбция потенциал определяющих ионов;
Ионообменная адсорбция;
Молекулярная адсорбция;
Мономолекулярная адсорбция.
Различные виды адсорбции определяются различной солевой природой жидкой фазы, химическим или фазовым составом твердой фазы. Независимо от вида адсорбции существуют общие закономерности, которые сформулированы через закон адсорбции: ион элемента при сколь угодно низкой концентрации хорошо адсорбируется осадком в том случае, если осадок имеет поверхностный заряд противоположный по знаку заряду адсорбируемого элемента, а адсорбируемое соединение трудно растворимо в данной системе или растворителе.
При адсорбции выделяют адсорбент и адсорбат. Адсорбент – твердое вещество, которое поглощает вещество из газообразной или жидкой фазы. Адсорбент в зависимости от химического состава может иметь нейтральную поверхность, отрицательно или положительно заряженную поверхность. Адсорбат – вещество, которое адсорбируется на поверхности адсорбента. Адсорбтив – вещество в жидкой или газовой фазе, которое будет адсорбироваться. Адсорбция – физико-химическое явление, которое может быть вызвано как физическими силами, в частности силами Ван дер Вальса, так и химическими, т.е. валентными связями.
Если между адсорбентом и адсорбатом существуют физические силы, то адсорбция является физической. Если же между ними валентные силы, то возникает хемосорбция и на поверхности адсорбента образуются поверхностные комплексы или химические соединения. При загрязнении химических осадков могут иметь место процессы, как физической сорбции, так и хемосорбции. Физическое загрязнение удаляется с помощью промывки осадка, а хемосорбированные остаются в составе осадка и тем самым изменяют его химический состав и свойства.
Потенциал определяющая адсорбция: при адсорбции примесей осадком, адсорбированные ионы передают твердой фазе свой заряд и, следовательно, эти ионы являются потенциал определяющими. Адсорбция потенциал определяющих ионов осадком зависит от их концентрации в растворе. Существует эмпирическое уравнение, где показано изменение потенциал определяющих ионов на поверхности осадка от концентрации этих ионов в растворе.
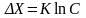
Х – масса потенциал определяющих ионов на поверхности осадка,
С – концентрация этих ионов в растворе,
К – константа.
Ионообменная адсорбция: может иметь место при старении осадка под воздействием жидкой фазы. Она характерна в том случае, если осадок не имеет общих ионов с жидкой фазой. В данном случае происходит обмен ионами между жидкой и твердой фазами, и образовавшиеся соединения адсорбируются на твердой фазе.
Молекулярная адсорбция – тип адсорбции, характеризующийся взаимодействием реагентов в жидкой фазе в эквивалентных количествах с последующей адсорбцией на поверхности осадка.
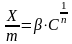
Х/m – количество адсорбированного вещества по отношению к единице массы осадка,
β, n – постоянные значения,
С – концентрация.
Концентрация влияет на химическое количество адсорбируемого вещества на поверхности.
Мономолекулярная адсорбция – частный случай молекулярной адсорбции. В этом случае адсорбция не ведет к образованию на поверхности осадка нескольких слоев и при повышении концентрации происходит создание насыщенного мономолекулярного слоя. Этот вид адсорбции описывается изотермой адсорбции Лэнгмюра (уравнение Лэнгмюра).
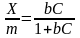
С – концентрация,
b – адсорбционный коэффициент, который зависит от температуры.

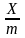
С
Кроме адсорбции на поверхности осадка может протекать окклюзия – физико-химическое явление, которое отличается по своей сути от адсорбции. Оно включает два независимых явления: 1) образование твердых растворов, 2) захват ионов осадком.
Твердые растворы – кристаллическая фаза переменного состава, в которой соотношение между компонентами может изменяться, при этом однородность не нарушается. По дисперсности твердые растворы представляю собой непрерывный ряд и могут изменяться от молекулярных растворов до грубо дисперсий.
Осадки, получаемые химическим осаждением разнообразны по химическому составу и свойствам, в зависимости от целевого назначения их классифицируют с точки зрения наличия примесей в осадке.
По наличию примеси выделяют технические продукты, продукты реактивной квалификации и особо чистые вещества.
Особо чистые вещества: используются для специальных целей (создание люминофоров, полупроводников, проводников, магнитных поверхностей и т.д.).
К
группе особо чистых веществ относятся
вещества, у которых парциальная мольная
энтальпия, коэффициент активности,
внутренняя энергия и объем не зависят
от концентрации примесей, а парциальная
мольная энтропия при уменьшении
концентрации одной примеси уменьшается
на величину равную
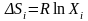 .
.
Понятие химическая примесь объединяет поверхностно адсорбированные инородные вещества, избыток или недостаток одного из компонентов вещества, замену в кристаллической решетке атома или иона другим элементом, посторонние атомы, ионы или молекулы, находящиеся внутри ячеек кристаллической решетки или между ними и другие модификации, и изотопы основного вещества.
При оценке качества особо чистого вещества правильно говорить о микропримеси. Наряду с химическими микропримесями имеются и физические примеси или различные структурные дефекты кристаллической решетки. Они могут оказывать на свойства готовых изделий такое же воздействие как химические микропримеси Практически, монокристаллы особо чистого вещества никогда не имеют идеальной кристаллической решетки. В реальной решетке можно всегда обнаружить то или иное количество дефектов решетки, вызываемых чисто тепловым движением атомов. К числу таких дефектов относятся и пустоты незаполненные атомами и, так называемые, межузловые атомы, расположенные между элементами нормальной решетки.
