
- •Кинетика реакции гидролиза сложного эфира в щелочной среде
- •1. Теоретическое введение
- •1.1. Кинетика и механизм реакции
- •1.2. Использование метода электропроводности для изучения кинетики реакции щелочного гидролиза сложного эфира
- •2. Экспериментальная часть
- •2.1. Приборы и оборудование
- •2.2. Проведение экспериментов
- •3. Запись и обработка экспериментальных результатов
- •4. Представление результатов работы
- •Литература
Кинетика реакции гидролиза сложного эфира в щелочной среде
1. Теоретическое введение
1.1. Кинетика и механизм реакции
Гидролиз сложного эфира этилацетата в щелочной среде является практически необратимым и описывается уравнением:
СН3СООС2Н5 + ОН– = СН3СОО– + С2Н5ОН.
Механизм реакции представляет собой совокупность следующих стадий:
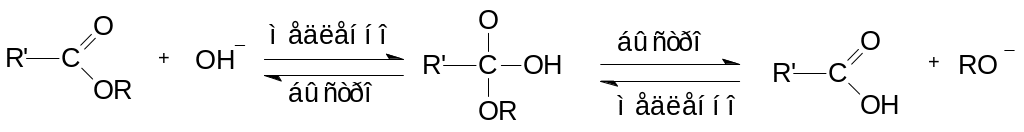

Лимитирующей стадией является образование тетраэдрического интермедиата. Равновесие на последней стадии устанавливается очень быстро и существенно смещено вправо.
Упрощённый механизм, включающий только кинетически значимые стадии, имеет вид
 (1)
(1)
Тетраэдрический интермедиат является весьма неустойчивым, имеет малое время жизни и быстро разлагается. Применяя для него квазистационарное приближение, получаем выражение скорости реакции
![]() , (2)
, (2)
где х – концентрация продукта реакции (карбоксилат-иона или спирта), k1, k2, k3 – константы скорости стадий механизма (1).
Согласно выражению (2), полученному исходя из механизма (1), реакция щелочного гидролиза этилацетата имеет суммарный второй порядок: первый по сложному эфиру и первый по ОН–. Этот вывод согласуется с результатами экспериментальных исследований. Наблюдаемая (эффективная) константа скорости реакции k определяется соотношением
![]()
Обозначим исходные концентрации СН3СООС2Н5 и ОН– a и b соответственно. С использованием величины х текущие концентрации участников реакции можно выразить следующим образом:
[СН3СООС2Н5] = a – x, [ОН–] = b – x,
[СН3СОО–] = x, [С2Н5ОН] = x, (3)
и записать кинетическое уравнение (2) в виде
![]() (4)
(4)
Если a b, решение дифференциального уравнения (4) при начальном условии x(t = 0) = 0 имеет вид
![]()
или

В координатах![]()
t
кинетическая кривая представляет собой
прямую линию, тангенс угла наклона
которой равен наблюдаемой константе
скорости реакции k.
t
кинетическая кривая представляет собой
прямую линию, тангенс угла наклона
которой равен наблюдаемой константе
скорости реакции k.
1.2. Использование метода электропроводности для изучения кинетики реакции щелочного гидролиза сложного эфира
Если в ходе реакции происходит образование или расходование электролита, то за ходом такой реакции можно следить, измеряя электропроводность (или электрическое сопротивление) реакционного раствора. Рассмотрим, каким образом с помощью измерения электропроводности можно получить кинетические кривые участников реакции гидролиза сложного эфира (этилацетата) в щелочной среде (водный раствор гидроксида натрия).
Удельная электропроводность , См/см, реакционного раствора равна сумме вкладов ионов Na+, ОН– и СН3СОО–:
![]() (5)
(5)
где [Na+], [ОН–], [СН3СОО–] – концентрации, моль/л, λNa+, λОН–, λСН3СОО– – эквивалентные электропроводности ионов, См·см2/моль. Если суммарная концентрация ионов невелика, то можно считать, что эквивалентные электропроводности ионов λi постоянны и равны эквивалентным электропроводностям в бесконечно разбавленном растворе λ°i. Тогда изменение удельной электропроводимости раствора обусловлено лишь изменением концентрации ионов за счёт реакции.
Запишем стехиометрическое уравнение реакции с учётом всех ионов, присутствующих в реакционном растворе:
СН3СООС2Н5 + Na+ + ОН– = СН3СОО– + Na+ + С2Н5ОН.
При использовании введённых в предыдущем разделе обозначений концентрации ионов равны
[Na+] = b, [ОН–] = b – x, [СН3СОО–] = x.
Подставляя эти выражения концентраций в соотношение (5), получим выражение текущей электропроводности реакционного раствора
![]()
![]() (6)
(6)
Запишем выражения электропроводностей реакционного раствора в начальный момент времени 0 (в растворе присутствуют только исходные вещества СН3СООС2Н5 и NaОН) и по завершении реакции ∞ (в растворе содержится непрореагировавший этилацетат и продукты С2Н5ОН и СН3СООNa):
![]() (7)
(7)
![]()
Разность электропроводностей растворов равна
![]() (8)
(8)
Подставляя соотношения (7–8) в выражение (6), получаем
![]() (9)
(9)
и получаем для величины x выражение
![]()
В эксперименте непосредственно измеряют электрическое сопротивление R раствора, а удельную электропроводность определяют с помощью соотношения
![]() ,
,
где K – постоянная ячейки. Выражая в уравнении (9) удельные электропроводности через сопротивления, получаем
![]() (10)
(10)
где R – текущее сопротивление реакционного раствора, R0 – сопротивление реакционного раствора в начальный момент времени, R∞ – сопротивление по окончании реакции. Таким образом, измеряя электрическое сопротивление раствора в течение всего времени реакции, можно определить величину х и с помощью соотношений (3) найти концентрации всех участников реакции в любой момент времени.
