
- •Г.О.Сіренко, о.В.Кузишин, л.В.Базюк
- •Затверджено
- •Лекція 2
- •. Термодинамічні системи та їх класифікація
- •2.2. Ґаз і па́ра. Ідеальний, неідеальний та реальний ґази
- •3. Ідеальний та неідеальний ґази
- •Параметри і функції термодинамічного стану
- •2.3.1.Загальні означення
- •Термодинамічні параметри стану та їх розмірности
- •2. Об’єм. Питомий об’єм
- •3. Кількість речовини
- •Внутрішня енергія
- •2.3.4. Ентальпія
- •2.3.5. Ентропія
- •4. Абсолютне значення ентропії
- •6. Для необоротніх процесів
- •2.3.6. Класифікація параметрів термодинамічного стану
4. Абсолютне значення ентропії
![]() (2.34)
(2.34)
визначається з точністю до сталої інтегрування со. Різниця ентропії системи у двох довільних станах а і b, заданих, наприклад, значеннями Т і V, дорівнює:
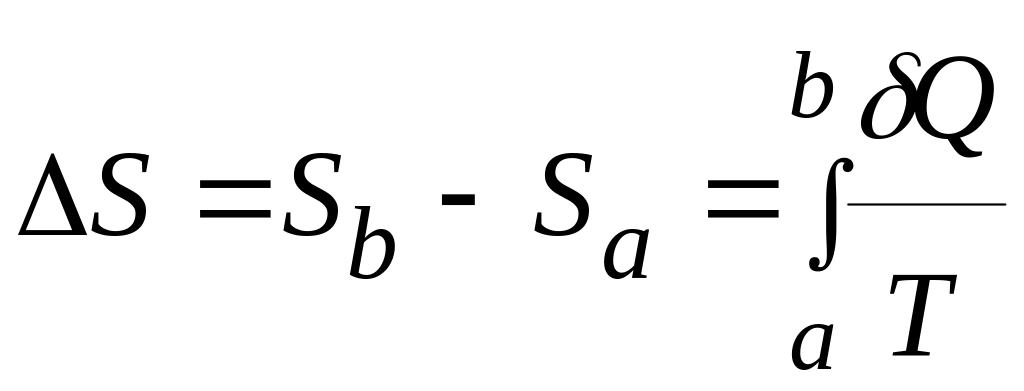 (2.35)
(2.35)
(інтегральне визначення ентропії).
Для оборотнього адіабатного процесу (δQ = 0) функція стану S залишається сталою Sb = Sa, то такий процес називається ізоентропним.
5. Ентропія збільшується при переході речовини у стан з більшою енергією:
S пари (ґ) > S (P) > S (T) ; (2.36)
наприклад, для води при стандартних умовах t=25°С; р°=0,101325 МПа; n°=1 моль:
![]() (т)
= 39,3
(т)
= 39,3![]() ;
(р) = 70,0
;
(ґ) = 188,7
;
;
(р) = 70,0
;
(ґ) = 188,7
;
ΔS(перегону)>ΔS(пароутворення)>>ΔS(топлення)>ΔS(поліморфного перетворення) (2.37)
Чим вища твердість речовини, тим менша його ентропія:
S(графіт) > S(алмаз) (2.38)
Карбіди, бориди і інші тверді речовини характеризуються малою ентропією. Зростання ступеня дисперсності системи також приводить до деякого збільшення її ентропії.
Ентропія аморфного тіла більше кристалічного:
S(аморф.) > S(крист.) (2.39)
Ентропія зростає по мірі ускладнення молекули речовини:
S (N2O5) > S (N2O3) > S (N2O); (2.40)
наприклад, при стандартних умовах для (ґ):
(СО) = 197,4 ; (СО2) = 213,0 .
При однаковій молекулярній масі ентропія розгалужених вуглеводнів менша за нерозгалужених, наприклад, ентропія циклоалкену менша за ентропію алкену:
S(алкен) > S(циклоалкен) (2.41)
Ентропія простих речовин і сполук (наприклад, хлоридів АСln), а також її зміна при топленні і пароутворенні є періодичною функцією порядкового номера відповідного елементу.
У сукупности речовин – аналогів, наприклад АСl4 (ґаз), де А ≡ С, Si, Ge, Sn, Pb), ентропія змінюється закономірно.
Спорідненість речовин (N2 та CO; CdCl2 та ZnCl2; Ag2Se та Ag2Te; BaCO3 та BaSiO3; PbWO4 та PbMoO4) виявляється у близькости їх ентропій.
Закономірности зміни ентропії в рядах подібних речовин, обумовлені різницями їх будови і складу. Чим менше упорядкована речовина, тим більше її ентропія. Ентропія системи зростає зі збільшенням температури.
6. Для необоротніх процесів
ΔS
=
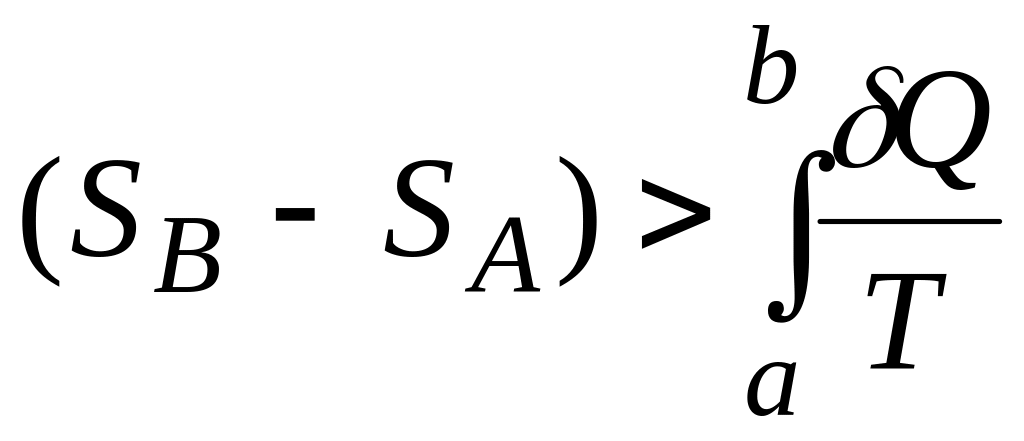 ,
(2.42)
,
(2.42)
тому ентропія адіабатно ізольованої системи може лише зростати:
ΔS > 0.
2.3.6. Класифікація параметрів термодинамічного стану
1. Параметри р, V, T називають основними, бо через них можна визначити решту параметрів і функцій.
Разом з тим параметри р, V, T називають термічними, а U, H, S – калоричними параметрами термодинамічного стану.
2. У теплових розрахунках для термічних параметрів (р, V, T) термодинамічного стану характерні їх абсолютні числові значення, для калоричних параметрів (U, H, S), а також для спеціальних функцій (F, G) важливі їх зміни в термодинамічних процесах. Розрахунок зводиться до визначення відносних значень цих величин і виконується відносно так званого нульового стану.
3. Нульовим станом називається довільно вибраний стан тіла. Для якого значення будь-якої функції (або кількох функцій) стану вважається рівним нулю.
4. Ознаки, які не можуть бути однаковими для усієї системи і окремих її частин, називаються екстенсивними.
Ознаки, які можуть бути однаковими для усієї системи і її окремих частин, називаються інтенсивними. До них відносяться густина ρ, питома вага γ, температура Т, тиск р, хемічний склад, діелектрична стала, коефіцієнт заломлення світла, тощо.
Параметри р, Т – називаються інтенсивними, що не залежать від кількости речовини (наприклад, маси тіла), а V, U, H, S – називаються екстенсивними параметрами, що залежать від кількости речовин (маси тіла) (їх питомі величини v, u, h, s – стають інтенсивними).
