
- •Часть 1.
- •1. Классификация поверхностно-активных веществ, методы синтеза и основные свойства.
- •1.1. Классификация пав по химическому строению и методы их синтеза.
- •1.1.1. Анионные пав
- •1.1.2. Катионные пав
- •1.1.3. Амфотерные пав
- •1.1.4. Неионогенные пав.
- •1.1.5. Фторуглеродные пав.
- •1.2. Классификация пав по физико-химическому механизму действия на поверхности раздела фаз.
- •1.3. Основные свойcтва пав.
- •1.3.1. Поведение пав на границе раствор – воздух. Поверхностная активность.
- •1.3.2. Поверхностные явления и адсорбция. Уравнения адсорбции и соотношения между ними.
- •1.3.3. Построение изотермы адсорбции и определение характеристик поверхностного слоя пав.
- •2. Влияние различных факторов на физико-химические свойства мицеллярных растворов пав.
- •2.1. Мицеллообразование в растворах пав
- •2.2. Методы определения ккм.
- •2.3. Влияние различных факторов на величину ккм.
- •2.4. Две модели мицеллообразования.
- •2.4.1. Двухфазная (псевдофазная) модель мицеллообразования.
- •2.4.2. Мицеллообразование как химическое равновесие.
- •2.5. Гидрофобные взаимодействия. Термодинамика мицеллообразования в водной среде.
- •2.6. Зависимость растворимости ионогенных пав в воде от температуры
- •2.7. Влияние температуры на растворимость неионогенных пав.
- •2.8. Физико-химические свойства смесей пав.
- •2.9. Мицеллообразования в неводных средах.
- •2.10. Оценка дифильных свойств пав.
- •3. Структурные превращения в растворах пав.
- •3.1. Строение мицелл пав
- •3.2. Роль жидких кристаллов в живом организме
- •3.3. Полиморфные превращения в растворах пав.
- •3.4. Изучение формы и размеров мицелл в растворах пав вблизи ккм2
- •3.5. Физико – химические свойства молекул пав в области перехода сферических мицелл в несферические
- •3.5.1. Применение метода спинового зонда для изучения строения мицелл
- •3.5.2. Влияние асимметризации сферических мицелл на степень гидратации молекул пав в мицелле
- •3.5.3. Зависимость степени ионизации молекул ионных пав в мицелле и ζ – потенциала мицелл от их формы.
- •3.6. Мицеллярные переходы в растворах пав выше ккм2
- •3.7. Регулирование процессов перестройки мицелл
- •3.7.1. Влияние строения алкильного радикала на структуру мицелл в их водных растворах
- •3.7.2. Влияние природы противоиона на ккм2 пав
- •3.7.3. Влияние природы электролита на структуру мицелл в растворах пав
- •3.8. Физико – химические основы применения растворов с несферическими мицеллярными структурами
- •1. Классификация поверхностно-активных веществ, методы синтеза и основные свойства. 4
- •2. Влияние различных факторов на физико-химические свойства мицеллярных растворов пав. 24
- •3. Структурные превращения в растворах пав. 51
Федеральное агентство по образованию
Московская государственная академия тонкой химической технологии им. М. В. Ломоносова
Кафедра коллоидной химии
Буканова Е. Ф.
Коллоидная химия ПАВ
Часть 1.
Мицеллообразование в растворах ПАВ.
Учебное пособие
Москва 2006
ББК 24.6
УДК 541.183
Буканова Е.Ф.
Коллоидная химия ПАВ. Часть 1. Мицеллообразование в растворах ПАВ.
Учебное пособие
М.: МИТХТ им. М.В. Ломоносова, 2006
Данное учебное пособие соответствует программе лекционного курса «Коллоидная химия ПАВ» для студентов 5 курса магистратуры по направлению 510508 «Коллоидная химия». В нем рассмотрена классификация ПАВ, методы из синтеза, закономерности мицеллообразования ПАВ и структурные превращения в растворах ПАВ.
Утверждено Библиотечно-издательской комиссией МИТХТ в качестве учебного пособия.
© МИТХТ им. М.В. Ломоносова, 2006
1. Классификация поверхностно-активных веществ, методы синтеза и основные свойства.
В соответствии с рекомендациями Международной комиссии по терминологии международного комитета по ПАВ понятию «поверхностно-активное вещество» дается следующее определение: «Вещество, способное из раствора (истинного или коллоидного) в жидкой среде адсорбироваться на поверхности раздела фаз [жидкость – газ (пар), жидкость – жидкость, жидкость – твердое тело] с соответствующим понижением свободной энергии (поверхностного натяжения) на этой поверхности. Для типичных ПАВ характерно определенное дифильное строение их молекул. Вещество, поверхностно-активное на одной границе раздела, на другой границе может быть инактивным (неспособным к адсорбции)».
Дифильным называется соединение, молекула которого состоит из двух асимметрично расположенных частей, резко различающихся по молекулярной природе и свойствам, полярной группы и неполярного (или слабо полярного) углеводородного радикала.
Полярная группа ( -ОН, -NH2, -СООН, -ОSO3Na , -SO3Na и др.) служит носителем дипольного момента и проявляет способность к гидратации, т.е. сообщает молекуле гидрофильные свойства.
Углеводородный радикал (в простейшем случае прямая насыщенная алкильная цепочка) имеет дипольный момент, равный или близкий к нулю, и проявляет сродство к близким по полярности фазам – углеводородам и другим нерастворимым или слаборастворимым в воде органическим соединениям (маслам).
Таковыми являются, например, жирные спирты и амины, карбоновые кислоты и их соли, разнообразные по составу и строению синтетические ПАВ.
1.1. Классификация пав по химическому строению и методы их синтеза.
Современная классификация ПАВ основана на терминологии, принятой на 3-ем международном конгрессе по ПАВ и рекомендованной международной организацией по стандартизации (ISO) в 1960 г. Основу классификации составляет химическая структура соединений, что позволяет выделить 4 основных класса ПАВ: анионоактивные, катионоактивные, амфотерные и неионогенные Представители каждого из этих классов различаются не только химическим строением, но и основными физико –химическими свойствами.
1.1.1. Анионные пав
Анионными ПАВ (АПАВ) называют вещества, содержащие в молекуле гидрофобную часть и одну или несколько полярных групп и образующие при диссоциации в водном растворе отрицательно заряженные длинноцепочечные органических ионы, определяющие их поверхностную активность, и гидратированные катионы, например, гидратированный катион щелочного металла или аммония:
С12Н25ОSO3Na
![]() С12Н25ОSO3-
+ Na+
С12Н25ОSO3-
+ Na+
К ним относят большинство традиционных ПАВ, в том числе и жировое мыло. Гидрофобная часть обычно представлена предельными, непредельными алифатическими и алкилароматическими цепями. Гидрофильность молекулы обусловлена наличием функциональных групп -СОО(Н, Me), —OSO2O(H, Me), —SO3(Н, Me). Разнообразие свойств различных анионных ПАВ объясняется пространственным строением гидрофобной части и наличием промежуточных функциональных групп. Катион в анионных ПАВ может быть не только водородом или металлом, но и органическим основанием. Часто для этих целей применяют ди- и триэтаноламины.
Анионные ПАВ можно разделить на шесть основных групп :
Соли карбоновых кислот –( мыла) RCOO- Me+, где R – органический радикал С8 – С20; Ме+ - Na+ (в твердых мылах), К+ или NH4+ (в жидких мылах).
Первичные и вторичные алкилсульфаты, алкилфенилэтилсульфаты, алкилциклогексилэтилсульфаты и т. д. ROSO3- Ме+ , ( R - С10 – С18 ).
Алкил- и алкиларилсульфонаты, сульфонаты сложных эфиров моно- и дикарбоновых кислот, олефин-сульфонаты RArSO3- Me+, ( R - С10 – С20 ).
Сульфоэтоксилаты спиртов, карбоксиэтоксилаты спиртов, сульфоэтоксилаты карбоновых кислот, сульфоэтоксилаты алкилфенилэтиловых спиртов, диметаллические соли сульфоянтарной кислоты, соли сульфатов непредельных кислот (R(C2H4O)mOSO3- Me+), ( R обычно С10 – С18 ).
Азотсодержащие ПАВ. Они характеризуются тем, что атом водорода при азоте в амидной форме имеет нейтральную реакцию. К ним относят: амидосульфонаты, амиды сульфокарбоновых кислот, амидосульфаты, амидокарбоксилаты, вещества с карбоксильной и сульфогруппой типа RCONHR'OOCR", (SO3Me)COOMe. Вместо амидной группы во многих этих веществах может быть также сульфаниламидная группа, например RArSO2NHCH2CH2SO3Me.
Соединения с другими гидрофобными и гидрофильными группами: соли перфторированных карбоновых кислот, перфторированных сульфоацетатов, моно- и диалкилфосфатов и фосфонатов.
Соли карбоновых кислот (мыла)
Водорастворимые соли алифатических кислот являются старейшим типом анионных ПАВ из используемых человечеством. Технология мыла берет свое начало в средние века, и сейчас уже трудно установить, кто был ее родоначальником. Натриевые мыла, полученные из кислот кокосового, пальмового, пальмоядрового масел, говьжьего и свиного жира, являются основой туалетного мыла. В некоторые его сорта вводят также соли дистиллированных синтетических карбоновых кислот фракции С10 – С16, соли жирных кислот дезодорированного и осветвленного таллового масла, канифоли, гидрогенизатов арахисового,хлопкового, оливкового, рапсового, касторового и подсолнечного масел. В рецептуры жидких мыл и некоторых шампуней вводят калиевые, смешанные калий-натриевые, три- и моноэтаноламиновые соли алифатических кислот. Их получают щелочным расщеплением триглицеридов в автоклавах под давлением и при повыщенной температуре. Синтетические жирные кислоты получают каталитическим окислением парафина.
Суммарная реакция омыления нейтральных жиров выражается уравнением:
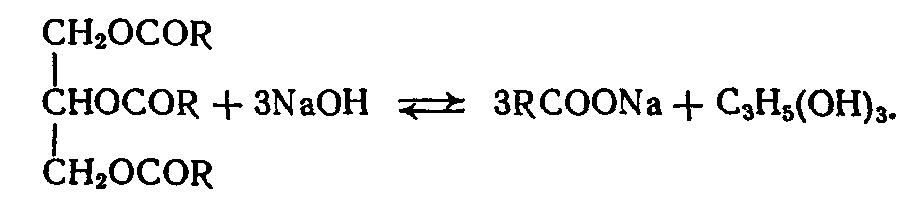
Вначале, поскольку жиры не растворяются в щелочи, скорость реакций небольшая, а при содержании в реакционной массе 20 % мыла значительно возрастает. Это обусловлено гомогенизацией реакционной среды вследствие образования эмульсии.
Первичные алкилсульфаты и алкилэтоксисульфаты .
Натриевые и триэтаноламиновые соли сульфоэфиров первичных спиртов и алкилэтоксисульфаты являются важнейшими представителями синтетических ПАВ. Натриевые соли — отличные моющие вещества массового назначения. Триэтаноламиновые соли алкилсульфатов и алкилэтоксисульфаты составляют основу для приготовления различных шампуней, пенных препаратов для ванн и жидких мыл. Натриевые соли сульфоэфиров первичных спиртов термически стабильны, порошки их негигроскопичны и в водоемах легко подвергаются биохимическому окислению.
Получение первичных алкилсульфатов и алкилэтоксисульфатов осуществляют путем сульфоэтерификации высших алифатических спиртов и их этоксилатов различными способами. В качестве сульфатирующих агентов используют концентрированные серную и хлорсульфоновую кислоты, олеум, газообразный серный ангидрид, комплексы триоксида серы с диоксаном или пиридином и др.
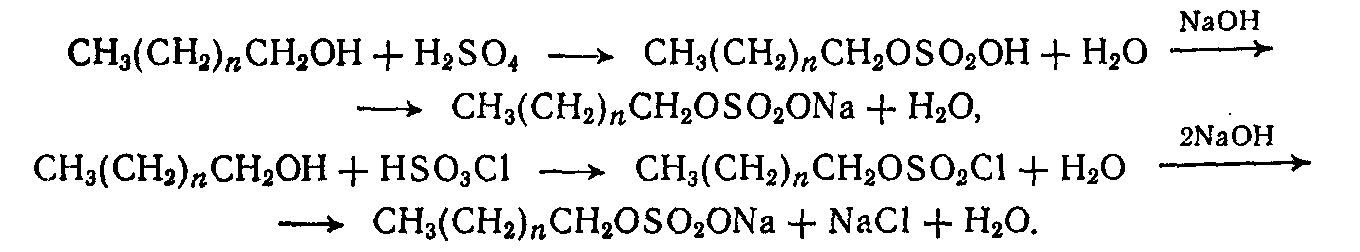
R(ОС2Н4)mOH
+ SO3
![]() R(ОС2Н4)mOSO3H
R(ОС2Н4)mOSO3H![]() R(ОС2Н4)mOSO3Na
R(ОС2Н4)mOSO3Na
Cульфатирование ведут в течение 1ч при 30 - 40°С. Повышение температуры и увеличение продолжительности контакта с сульфатирующим агентом сопровождается рядом нежелательных реакций.
Алкиларилсульфонаты
Алкиларилсульфонаты представляют собой продукт сульфирования алкилароматических углеводородов. В качестве ПАВ получили развитие моноалкилбензолсульфонаты, диалкилбензолсульфонаты, моноалкилнафталинсульфонаты и диалкилнафталинсульфонаты. Моноалкилбензолсульфонаты общей формулой
![]()
широко распространенные ПАВ. Они обладают термической стойкостью, негигроскопичностью и хорошими коллоидно-химическими свойствами. Для их производства применяют доступное сырье и несложные процессы переработки. Они являются самым дешевым и лучшим компонентом современных моющих средств.
Коллоидно-химические и санитарно-гигиенические свойства алкиларилсульфонатов обусловлены строением алкильной цепи и местом присоединения ее к бензольному ядру. Лучшими показателями обладают вещества с прямоцепочечной алкильной цепью, присоединенной к бензольному ядру крайними атомами углерода. Эти соединения обладают достаточно высокой биоразлагаемостью.
Синтез алкиларилсульфонатов состоит из двух стадий: получение алкилароматических углеводородов и сульфирование их в ядро. Оба процесса имеют множество вариантов и обусловливают показатели качества конечного продукта.
Алкилирование бензола осуществляют хлоралканами или алкенами. Хлоралканы получают путем хлорирования фракций парафиновых углеводородов, содержащих от 8 до 14 атомов углерода. Олефиновые углеводороды с таким же содержанием углеродных атомов получают путем термического крекинга твердых парафинов:
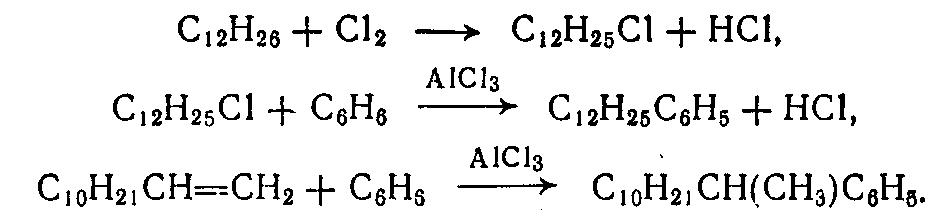
Сульфирование алкилароматических углеводородов может быть осуществлено олеумом, триоксидом серы или хлорсульфоновой кислотой.
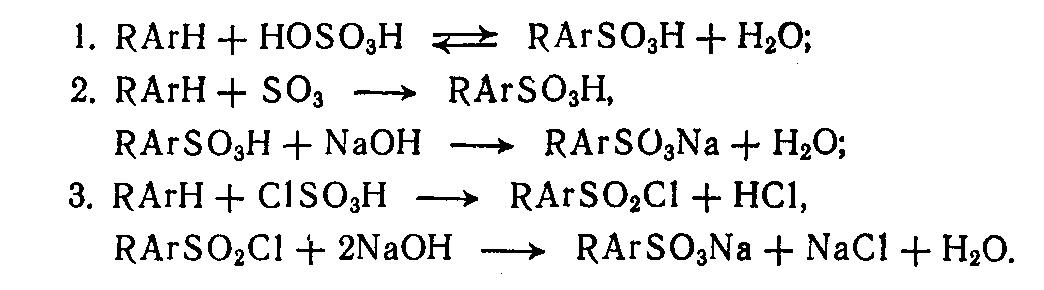
Из представленных способов более предпочтительным является второй. Преимущество его в том, что сульфирование идет количественно, отпадает необходимость разбавления сульфомассы водой и отделения серной кислоты. Кроме того, легко организовать съем теплоты, выделяющейся при реакции сульфирования: диоксид серы, испаряясь, уносит с собой теплоту. Это позволяет вести процесс сульфирования при любой заданной температуре и избежать местных перегревов сульфопродукта .
Алкилсульфонаты
Алкилсульфонаты обычно получают в виде смесей первичных и вторичных производных: RSO3Na и R'R''CHSO3Na. Существенный недостаток алкилсульфонатов - гигроскопичность, поэтому их применяют лишь в композициях жидких средств различного назначения. Классический способ синтеза алкилсульфонатов основан на взаимодействии алкилгалогенида с cульфитом натрия или аммония:
![]()
Этот синтез легко идет с низкомолекулярными алкилами. Для получения алкилсульфонатов с длиной цепи C8 – C18 лучшие результаты дает взаимодействие алкилгалогенидов с гидросульфитом натрия в присутствии пероксидных соединений:
![]()
Соли полуэфиров сульфоянтарной кислоты (сульфосукцииаты)
Сульфосукцинаты получают этерификацицией гидроксидсодержащего сырья малеиновым ангидридом с последующим сульфированием малеината солью сернистой кислоты:
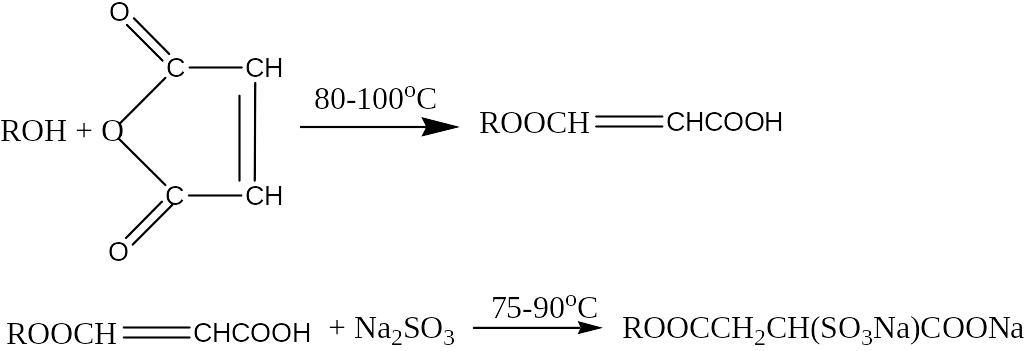
Анионные ПАВ используются как смачиватели, эмульгаторы, основные компоненты моющих средств (детергенты), пенообразователи; они являются главными мицеллообразующими поверхностно-активными веществами с наибольшим объемом производства (60% от всех выпускаемых ПАВ) и ассортиментом. Наиболее активно анионные ПАВ проявляют свои свойства в щелочных средах, хотя могут использоваться и в кислых средах, например при обработке металлов кислотами для снятия окисной пленки.
