
Особливості хімії дигалогеналканів
Дигалогеналкани містять у своєму складі два атоми галогену. Атоми галогенів можуть знаходитись біля того самого атома Карбону (гемінальні дигалогеналкани), біля сусідніх атомів вуглецю (віцинальні дигалогеналкани) або розділені декількома карбон-карбоновими зв’язками.
Добувають їх приєднанням галогеноводнів до алкінів (утворюються гемінальні дигалогеналкани), приєднанням галогенів до алкенів (утворюються віцинальні дигалогеналкани
Хімічні властивості дигалогеналканів аналогічні властивостям моногалогеналканів. Вони вступають у різні реакції нуклеофільного заміщення та відщеплення, властиві галогеналканам.
При лужному гідролізі з віцинальних похідних утворюються гліколі:
СН3−СН(СІ)−СН2(СІ) + NaOH СН3−СН(OH)−СН2(OH) + NaCI.
1,2-дихлорпропан пропіленгліколь
В цих умовах гемінальні похідні утворюють спирти або кетони:
СН3—СН(СІ2) + NaOH СН3—СН=O + NaCI + Н2О;
дихлоретан ацетальдегід
СН3−СН(СІ2)−СН3 + NaOH СН3−СO −СН3 + NaCI + Н2О.
1,2-дихлорпропан ацетон
У присутності спиртових розчинів лугів при нагріванні гемінальні та віцинальні дигалогеналкани піддаються елімінуванню з утворенням алкінів:
С Н3—СН(СІ)—СН2(СІ)
2NaOH,
спирт. р-н
СН3—С
СН
+ NaCl
+ H2O.
Н3—СН(СІ)—СН2(СІ)
2NaOH,
спирт. р-н
СН3—С
СН
+ NaCl
+ H2O.
Особливості хімії галогеналкенів
Галогеналкенами називають похідні алкенів, у яких один або декілька атомів водню заміщені атомами галогенів.
За взаємним розміщенням подвійного зв’язку і атома галогену галогеналкени розділяються на три групи:
1. вінілгалогеніди − сполуки, що містять атом галогену біля Карбону, який утворює подвійний зв’язок:
СН2 = СН−СІ СН3СН = СН−Вг;
хлористий вініл 1-бромпропен
2. алілгалогеніди − сполуки, в яких атом галогену знаходиться в -положенні до карбону, що утворює подвійний зв’язок:
СН2 = СН−СН2−СІ;
хлористий аліл
3. сполуки, в яких атом галогену і атом вуглецю, що утворює подвійний зв'язок, розділені двома та більше простими карбоновими зв’язками:
СН2 = СН−СН2−СН2−Вг
4-бромбутен-1
Хімічні властивості галогеналкенів зумовлені наявністю в їх структурі двох угруповань: −С=С− −С − НаІ. По подвійному зв’язку вони здатні вступати в реакції, характерні для алкенів (приєднання, полімеризація та ін.,), а по зв’язку С − НаІ − в реакції заміщення та відщеплення. Реакційна здатність галогеналкенів залежить від взаємного розміщення атома галогену та подвійного зв’язку в молекулі.
Галогеналкени, що містять атом галогену біля Карбону, який утворює подвійний зв’язок (вінілгалогеніди), внаслідок взаємного впливу зазначених угруповань характеризуються низькою реакційною здатністю зв’язку С −НаІ і подвійного зв’язку. Атом галогену в цих сполуках малорухливий і мало заміщується на інші атоми та групи. Реакції приєднання за місцем розриву подвійного зв’язку також ідуть важче, ніж, наприклад, в етилені.
П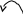 ричиною
низької реакційної здатності зв’язку
С−НаІ є спряження неподіленої пари
електронів атома галогену з -електронами
подвійного зв’язку (атом галогену
виявляє + М
−ефект):
ричиною
низької реакційної здатності зв’язку
С−НаІ є спряження неподіленої пари
електронів атома галогену з -електронами
подвійного зв’язку (атом галогену
виявляє + М
−ефект):
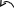 −
∙∙
−
∙∙
CН2 = СН −СІ
У результаті спряження зв’язок С−НаІ вкорочується та стає значно міцнішим, ніж у галогеналканах. Тому реакції нуклеофільного заміщення для вінілгалогенідів у більшості випадків не відбуваються. При звичайній температурі вони практично не ідуть, а при нагріванні проходять побічні процеси відщеплення галогеноводню, приєднання за місцем розриву подвійного зв’язку, полімеризація.
У присутності концентрованих розчинів лугів вінілгалогеніди, що містять атом водню біля вуглецю, який утворює подвійний зв’язок, відщеплюють галогеноводень і перетворюються на алкіни:
СН2 = С(СІ)−СН3 + NаОН СН = С−СН3 +NaCl + H2O.
2-хлорпропен пропін
Поряд з цим у молекулі вінілгалогеніду атом галогену за рахунок сильного негативного індуктивного ефекту зменшує електронну густину подвійного зв’язку і тим самим знижує його реакційну здатність в реакціях електрофільного приєднання. Тому вінілгалогеніди приєднують галогени, галогеноводні та інші електрофїльні реагенти важче, ніж відповідні алкени. Приєднання галогеноводнів проходить за правилом Марковникова:
СН2 = СН− СІ + НСІ СН3− СНСІ2.
хлористий вініл 1,1-дихлоретан
У присутності каталізаторів вінілгалогеніди легко вступають в реакції полімеризації, які знаходять широке застосування у виробництві полімерних матеріалів:
nСН2 = СН−С1 (−CH2−CHCl−)n
полівінілхлорид
На відміну від вінілгалогенідів, у молекулах алілгалогенідів атом галогену виявляє підвищену рухливість. Алілгалогеніди вступають в реакції нуклеофільного заміщення легше, ніж галоген алкани. Заміщення, як правило, відбувається за механізмом SN1.
Висока активність алілгалогенідів у реакціях нуклеофільного заміщення пояснюється їх схильністю до іонізації, оскільки при цьому утворюється досить стійкий алІльний катіон:
+
.CH2− СН− СН2Вг СН2 = СН −СН2 + Вг−
Стабільність алільного катіона зумовлена делокалізацією пози тивного заряду по спряженій системі:
![]() .
.
Внаслідок електроноакцепторного впливу атома галогену, реакційна здатність подвійного зв’язку в алілгалогенідах нижча, ніж у відповідних алкенах, приєднання галогеноводнів іде за правилом Марковникова:
СН2 = СН СН2 С1 + НС1 СН3−СНСІ−СН2СІ.
хлористий аліл
