
- •Генетична дія електромагнітного випромінювання оптичного діапазону
- •Вплив лазерного випромінювання на розвиток кількісних ознак у рослин, після обробки їх іонізуючої радіації
- •Вплив лазерного світла різних довжин хвилі на мутагенну ефективність іонізуючої радіації.
- •Глава 6 Перспектива лазерного мутагенезу для селекції рослин
- •Морфобіологічні характеристики мутантів пшениці і ячменю, отриманих в результаті лазерного мутагенезу
- •Висновок
Вступ
Один з головних джерел успішного вирішення продовольчої програми СРСР - значне збільшення виробництва зерна. Підвищення продуктивності зернових культур нерозривно пов'язане з успіхами селекційної роботи. Все більшого значення набуває селекція сортів, які поєднують високу зернову продуктивність з гарною якістю продукції. Вони повинні стабільно зберігати свої позитивні властивості в будь-яких умовах вирощування.
У цьому зв'язку проблема створення цінного вихідного матеріалу для селекції нових сортів є досить гострою. Наявний у розпорядженні селекціонерів генофонд тієї чи іншої культури повністю не може забезпечити вирішення поставлених завдань, так як інтенсивна селекційна практика в значній мірі вичерпала потенційні можливості більшості сільськогосподарських культур. У сформованій ситуації виникла необхідність розробити нові методи зміни спадковості, які давали б можливість у великому масштабі індукувати мутаційну або рекомбінативну мінливість.
У цьому відношенні експериментальний мутагенез (радіаційний і хімічний) завоював міцні позиції в сучасній генетиці рослин.
До теперішнього часу в арсеналі експериментальної генетики є достатньо мутагенів фізичної та хімічної природи. Іонізуюча радіація і супер-мутагени, на жаль, роблять відносно «грубу» дію на генетичні структури клітини і фізіолого-біохімічні процеси. Це, як правило, призводить до формування мутантів із зниженою життєздатністю, що негативно позначається на використанні їх у селекційному процесі.
Подальше підвищення ефективності цього напрямку пов'язане з розробкою оптимальних умов впливу мутагенами, а також з пошуком ще більш дієвих засобів, що забезпечують індукцію спадкової мінливості рослин.
Науково-технічний прогрес сприяє появі таких засобів. Своєчасне вивчення генетичної ефективності факторів навколишнього середовища - вельми актуальна проблема сучасної науки. До числа таких факторів відноситься лазерне випромінювання. З кожним роком розширюються масштаби застосування лазерів в різних галузях науки і виробництва. Людина в силу своїх професійних обов'язків все частіше і частіше піддається впливу цього нового виду випромінювань. Тому оцінка генетичних наслідків подібних контактів вже сама по собі є важливою науково-технічною проблемою сучасності. Вирішення її здійснюється силами вчених різних наукових напрямків, в тому числі і генетиками. Робота з рослинами передбачає не тільки отримання відповіді на питання про генетичне дії лазерного випромінювання, а й у разі наявності генетичних ефектів використання його в якості мутагенного фактора в селекції.
Експериментальні дані показали, що лазерне випромінювання має мутагенну дію при опроміненні генеративних органів і сухого насіння рослин. Це зумовило формування нового напрямку в експериментальному мутагенезі. Однак, незважаючи на позитивні результати, воно розвивається поки повільно, в зв'язку з тим що механізми дії лазерного випромінювання на біологічні об'єкти досі неясні.
Як буде показано нижче, лазерне випромінювання характеризується комплексом параметрів, і тільки при оптимальному їх поєднанні спостерігаються цитогенетичні та генетичні ефекти.
Генетичні дослідження в даній роботі були проведені із застосуванням не тільки серійних, а й спеціально створених для біологічних експериментів лазерних установок. Зокрема, застосовувалися лазери на барвниках з регульованою довжиною хвилі й інші системи, пристрій і особливості роботи яких наведені в цьому рефераті.
Генетична дія електромагнітного випромінювання оптичного діапазону
Світло відноситься до основних зовнішніх факторів, що визначають процеси життєдіяльності. Найважливіші є фізіологічні з боку біологічної дії світла (фотосинтез, зір та ін.) Вивчаються вже давно. Проблема ж генетичної та еволюційної значимості світла поставлена порівняно недавно. Перші докази мутагенної ефективності ультрафіолетового випромінювання з'явилися в 30-40-і роки . Численні експериментальні дані свідчать про індукуванні ультрафіолетовим випромінюванням мутацій у вірусів, мікроорганізмів, одноклітинних рослин і тварин, а також клітин у культурі тканин вищих рослин і тварин .
Поряд з мутаціями УФ випромінювання викликає різного роду хромосомні аберації (розриви, делеции і транслокації хромосом). Описано три типи спектрів дії фотомутагенезу:
1) чисто нуклеїнових (ДНК) з максимумом при 260-265 нм;
2) чисто білковий з максимумом при 280 нм;
3) змішаний з нуклеїновими і білковими компонентами.
Найчастіше зустрічаються спектри дії першого і третього типів. Для деяких біологічних тест-об'єктів відзначена лінійна залежність між частотою мутацій і дозою опромінення, для інших - зкспоненціальністю. Як правило, ефективність УФ випромінювання нелінійно залежить від його дози: вона знижується при занадто малих або великих дозах. У багатьох мікроорганізмів залежність ставлення числа мутацій до числа клітин які вижили описується кривою наступного типу: зріст - плато (максимум) -падіння. Подібні криві отримані також при опроміненні бактеріофагів, клітин комах і вищих рослин. Іноді, однак, падіння кривої не спостерігається навіть при дуже великих дозах (100-500 Дж / мА) опромінення. Мабуть, слід вважати найбільш обґрунтованим пояснення максимуму взаємодією мутантного ядра з дефектною цитоплазмою (Конєв, Болотовского, 1979).
При мутагенну ефекті, як і при летальному, температура опромінення практично несуттєва, а пострадіаційна важлива. Ефективність мутагенної дії ультрафіолету мало залежить від концентрації кисню в середовищі.
Судячи з спектрами дії, первинні фотофізичні і фотохімічні процеси локалізовані головним чином в самій ДНК, хоча на підставі непрямих даних висловлюється припущення про можливість непрямого мутагенезу через фотоутворення у клітці хімічних мутагенів, модифікують геном.
Так, УФ опромінення субстратів, що використовуються для вирощування бактерій, призводить до підвищення частоти мутацій в бактеріальних культурах. Проте вихід мутантних клітин при цьому завжди нижче, ніж при прямому опроміненні бактерій (Smith, Hanawalt, 1969; Graves, 1980).
Значний внесок у мутагенез вносить основне ушкодження ДНК - утворення піримідинових і насамперед тимінових димарів. До мутацій можуть призводити та інші фотохімічні пошкодження ДНК, такі, як гідратація цитозину з наступною заміною його через стадію оксіметілурацілу в ході реплікації на тимін, зшивання ДНК-білок, що є серйозною перешкодою -для ферментативної реплікації ДНК; фототаумерізація підстав, що приводить до заміни параденін - тимін на гуанін - цитозин і т. д.
В даний час популярна точка зору, що мутабільність клітини визначається не тільки кількістю або природою фотопошкоджень, але й параметрами репаруючих пошкодження систем і в першу чергу системи SOS-репарації.
Для
розуміння механізму фотомутагенезу, а
також для оцінки викладаються далі дані
про генетичну дії лазерного випромінювання
видимої області спектра, великий інтерес
представляють експерименти з вивчення
ефективності короткохвильового оптичного
випромінювання різних довжин хвиль.
Встановлено, що для більшості досліджуваних
біооб'єктів найбільшою мутагенною
ефективністю володіє випромінювання
з ≥260 нм, а в міру збільшення довжини
хвилі вона значно зменшується. Так, при
порівняльному вивченні дії різних
довжин хвиль монохроматичного УФ
випромінювання в діапазоні 260-313 нм на
виживаність диплоїдних фібробластів
людини, виходячи з критерію ЛД = 37%, було
показано, зокрема, що для 265 нм ефективна
доза 30 Дж /
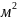 ,
а для 313 нм -1,5-105 Дж /
тобто
випромінювання цієї довжини хвилі було
в 5000 разів менш дієвим, ніж випромінювання
з ≥265 нм.
,
а для 313 нм -1,5-105 Дж /
тобто
випромінювання цієї довжини хвилі було
в 5000 разів менш дієвим, ніж випромінювання
з ≥265 нм.
Аналогічні дані були отримані при порівняльному вивченні ефективності освіти пірамидінових димарів в клітинах китайського хом'ячка під дією УФ випромінювання різних довжин хвиль, де випромінювання з Х = 313 нм за частотою освіти димарів в 5000 разів було менш ефективно, ніж з ≥260 нм. Проводилось також порівняльне вивчення мутагенного дії монохроматичного УФ випромінювання різних довжин хвиль в області 250-405 нм. Найбільш ефективне випромінювання з довжиною хвилі 254 нм, а X- = 405 нм біологічною активністю не володіє . Оптичне випромінювання в спектральної області 300-400 нм називають ультрафіолетовим випромінюванням екологічного діапазону, так як воно є основною частиною короткохвильового діапазону сонячного спектра. Останнім часом посилилася увага до випромінювання генетичних ефектів випромінювання в цій області спектра. Показано цитогенетичну дію монохроматичного випромінювання в ближній УФ області спектру при хронічному опроміненні клітин ссавців в культурі. При експозиції 24 год і щільності потужності
0,2 Вт / спостерігалося невелике збільшення хромосомних перебудов з 0,05 до 0,18% при довжині хвилі 400 нм і відсутність ефекту при дії більш длінно¬волнового випромінювання .
Великий інтерес представляють експерименти з вивчення ефективності короткохвильового оптичного випромінювання різних довжин хвиль. Встановлено, що для більшості досліджуваних біооб'єктів найбільшою мутагенної ефективністю володіє випромінювання з ≥ 260 нм, а в міру збільшення довжини хвилі вона значно зменшується. Так, при порівняльному вивченні дії різних довжин хвиль (виділяються за допомогою монохроматора з випромінювання газорозрядних ламп) монохроматичного УФ випромінювання в діапазоні 260-313 нм на виживаність диплоїдних фібробластів людини, виходячи з критерію ЛД = 37%, було показано, зокрема, що для 265 нм ефективна доза 30 Дж / , а для 313 нм
-1,5-105 Дж / , тобто випромінювання цієї довжини хвилі було в 5000 разів менш дієвим, ніж випромінювання з ≥ 265 нм . Аналогічні дані були отримані при порівняльному вивченні ефективності освіти піримідинових димерів в клітинах китайського хом'ячка під дією УФ випромінювання різних довжин хвиль, де випромінювання з Х = 313 нм за частотою освіти димарів в 5000 разів було менш ефективно, ніж з ≥ 260 нм.
При надійному оптичному екранування статевих клітин вищих рослин і тварин прямий фотомутагенез практично неможливий. Наприклад, при УФ опроміненні дорослих дрозофіл навіть при фокусуванні випромінювання на область розташування статевих органів лише 0,1% квантів біологічно активного випромінювання досягають зародкових клітин. Однак не виключаються й непрямі мутації, викликані фотохімічними продуктами, які переносяться між клітинами організму (хімічний мутагенез). Зазвичай для отримання генетичних змін у вищих організмів доводиться опромінювати їх ізольовані статеві клітини (пилок, сперму і т. Д.).
Дані, отримані в дослідах з кукурудзою, показують, що мутації, викликані УФ світлом, близькі до спонтанно виникають і відрізняються від викликаються іонізуючою радіацією по спектру, по наявності післядії для УФ світла і відсутності кисневого ефекту, характерного для іонізуючої радіації. Між проникаючу здатність випромінювання різної довжини хвилі і їх генетичної ефективністю немає кореляції. Найбільшою проникаючою здатністю володіє довгохвильова частина спектра УФ променів, у той час як короткохвильова найбільш мутагенна. Так, на пилку кукурудзи було показано, що випромінювання з довжиною хвилі 254- 265 нм в 10 разів ефективніше, ніж з 1 = 297 нм, і в 100 разів, ніж з ≥ 302 нм.
Так, в дослідах з кукурудзою пригнічення запліднення спостерігається при опроміненні пилку ультрафіолетом з ≥ 253 нм в дозах порядку 104 Дж / , а при збільшенні дози до 10 -106 Дж / пилок стає повністю стерильним. При запиленні рослин ячменю пилком, облученого ультрафіолетом, було відмічено появу в М2 до 4% хлорофільних і до 2% полустерільних форм. При опроміненні проростків і зародків з'являються поодинокі мутантні рослини в потомстві, зокрема у томатів, квасолі та ін. Є випадки виникнення малого числа мутацій при тривалому УФ опроміненні вегетуючих рослин. Мпостерігається відсутність при ультрафіолетовому мутагенезі
кисневого ефекту і залежність виходу мутацій від температури і вологості опромінюються об'єктів.
Особливий
спосіб індукції мутаційного процесу у
рослин сонячною радіацією застосовувався
в дослідах Морару (1980). Рослини вирощували
в умовах закритого грунту і виносили
на сонце тоді, коли висота його над
горизонтом була не менш 22-27 °. У цей час
у складі сумарної сонячної радіації
переважала енергія випромінювання в
синій і УФ областях над енергією світла
в червоній області спектра. Потужність
випромінювання 0,5 кал /
 -мін,
експозиція опромінення 8-10 год, тривалість
10-90 днів, об'єкт дослідження - м'яка озима
пшениця. Було показано, що при такому
способі впливу сонячним світлом у 2-му
поколінні рослин з'являються змінені
форми, серед яких зустрічаються
морфологічні, хлорофільние та інші
мутації.
-мін,
експозиція опромінення 8-10 год, тривалість
10-90 днів, об'єкт дослідження - м'яка озима
пшениця. Було показано, що при такому
способі впливу сонячним світлом у 2-му
поколінні рослин з'являються змінені
форми, серед яких зустрічаються
морфологічні, хлорофільние та інші
мутації.
Слід підкреслити дуже важливе для подальшого аналізу генетичної ефективності світла обставина, що до появи лазерів достовірних експериментальних даних про збільшення виходу мутацій при дії безперервного оптичного випромінювання як у видимій, так і в ультрафіолетовій області спектра на сухе насіння вищих рослин отримано не було.
З іншого боку, як уже зазначалося, не було даних про яку-небудь значущу мутагенну дію видимого світла з X -400 нм не тільки на вищі організми, а й на ізольовані клітини і мікроорганізми. У цьому зв'язку заслуговує на увагу явище посилення видимим світлом мутагенного дії хімічних сполук у випадку так званого «фотодинамічного ефекту».
Фотодинамічна дія - це необоротне ушкодження світлом біологічних структур і функцій у присутності кисню, сенсибілізовані введеними в клітини або організми хромофорами (наприклад, барвниками). Комбінація барвник + світло + кисень є, як правило, необхідною ознакою цієї реакції. Загальна особливість всіх фотодинамічних барвників - їх здатність до флуоресценції тобто до утримання поглиненої енергії протягом досить тривалого часу (не менше 10 ~ 9 с).
Природа акцептора фотодинамічно активного світла очевидна. Це проникнення в клітку хромофор (барвник). Тому спектри дії фотодинамічного пошкодження і поглинання барвника повинні збігатися, що й спостерігається в експерименті. Барвник виступає в ролі триплетного фотокаталізатора і регенерується в кінці реакції. Окислювальні пошкодження субстрату в реакціях фотодинамічного дії здійснюються високо реактивним синглетним киснем або супероксидним радикалом. Окислювально-відновним перетворенням піддаються практично всі біологічно важливі речовини (амінокислоти, білки, нуклеїнові кислоти і т. д.). У деяких випадках присутність кисню для фотодинамічного ефекту не обов'язково.
Модифікація ДНК псораленом - двоступеневий процес. Спочатку утворюється комплекс між ДНК і псораленом, а потім - ковалентний зв'язок при опроміненні світлом з = 400 нм. Крім фурокумаринів широко вживаються й інші барвники (в основному акридин і тіопіронін). У цих випадках поглинання випромінювання не є причиною посилення комплексу між барвником і субстратом, але веде до перенесення поглиненої енергії від порушеної барвника до вже пов'язаної в молекулі субстрату, викликаючи зміну обох цих сполук.
Цікаво відзначити, що, за деякими даними, при використанні тіопіроніна він переважно впливає на нехромосомной спадковість живої клітини.
Мутації, що є наслідком фотодинамічного дії, спостерігаються у разі барвників, які володіють високою спорідненістю до нуклеїнових кислот і активно комплексується з ними в розчині. Наприклад, акридинові барвники переважно концентруються на хромосомах і викликають їх розриви. При фотодинамічного пошкодженні вірусів спостерігаються розриви полінуклеотидних ланцюга. На цьму рівні більш складно
організованих систем можуть пошкоджуватися як нуклеїнові кислоти, так і білки.
Істотний внесок у фотосенсібілізірованних пошкодження клітин вносять біологічні мембрани.
Даних щодо застосування фотодинамічної дії світла в експериментальному мутагенезі рослин дуже мало.
Останнім часом опубліковані результати експериментальних робіт, присвячених вивченню цитогенетичного і мутагенного дії на рослинні об'єкти потужного імпульсного випромінювання в УФ і видимій області спектра. У цих дослідах використовувався імпульсний (т. Е. Переривчастий) концентроване сонячне світло (ІКСС) і імпульсне випромінювання електричних газорозрядних ламп великої потужності (ІКЕС). Опроміненню піддавалися проростки і сухе насіння рослин. Повідомляється, що під дією ІКСС і ІКЕС спостерігається збільшення частоти хромосомних перебудов в клітинах вівса, кукурудзи і пшениці при опроміненні не тільки проростків, але, хоча і в меншій мірі, сухого насіння даних культур.
Була вивчена можливість отримання вихідного матеріалу для селекції пшениці за допомогою опромінення насіння ІКСС і ІКЕС. Обробці була піддана 1 тис. сортів озимої та ярої пшениці. Ступінь фокусування сонячного світла становила 50-150 крат, експозиція - 20-30 хв, Автори відзначають, що для індукції мутантів ярові тверді пшениці слід опромінювати більш високими дозами, ніж озимі. Ксенонові лампи були більш ефективні в продукуванні позитивних мутантів, ніж сонячне світло. В цілому отримані авторами результати дозволяють зробити висновок про можливість створення за допомогою цього методу вихідного матеріалу для селекції пшениці. Виявлено коротко- стеблові форми у сорту Миронівська 808, по урожаю рівні стандарту, у сорту Безоста 1 - морозо- і зімостійкі форми. Перспективність фотомутагенезу в селекції пшениці доведена. При цьому необхідно розробляти способи індукування мутацій, що змінюють властивості рослин по господарсько цінними ознаками.
Таким чином, узагальнюючи сказане, можна зробити висновок про те, що до появи робіт з вивчення цитогенетичного і мутагенного дії лазерного випромінювання не існувало чітких експериментальних доказів генетичної ефективності видимого світла на рівні як клітини, так і цілого організму. Переходячи до розгляду генетичної ефективності лазерного випромінювання, необхідно відзначити, що робіт, присвячених цьому питанню, мало. Лазери, що випускаються промисловістю, генерують випромінювання в основному у видимій та інфрачервоній областях спектра, які, як вважалося за аналогією зі звичайним світлом, не володіють мутагенною ефективністю і не викликали особливого інтересу у генетиків. Отримання ж ультрафіолетового лазерного випромінювання пов'язане з великими технічними труднощами.
Мабуть, негативну роль у розвитку інтересу до вивчення мутагенного дії ультрафіолетового лазерного випромінювання зіграло і те, що в перших повідомленнях з цього питання не відзначалося жодного його переваги у порівнянні зі звичайним ультрафіолетом. Навіть, навпаки, є роботи, в яких йдеться про порівняно малої цитогенетичної ефективності лазерного ультрафіолету. Так, в дослідах з культурою клітин китайського хом'ячка застосовувалося випромінювання четвертої гармоніки неодимового лазера (А = 265 нм) з вихідною потужністю 120-300 кВт. При дозі опромінення 23
Дж / спостерігається падіння мітотичної активності клітин в 2 рази в порівнянні з контролем вже через добу. При дозі 115 Дж / спостерігалося збільшення хромосомних перебудов в клітинах. У наступні дні мітотична активність опромінених клітин відновлювалася до контрольного рівня. Це означає, що звичайний ультрафіолет - більш ефективний мутаген, ніж наносекундний лазерний ультрафіолет тієї ж енергії.
Вивчалася порівняльна дія випромінювання ультрафіолетового лазера і бактерицидної лампи на проростки скерда болотної. У дослідах використовувалися четверта гармоніка (≥265 нм) лазера на алюмінієво-ітрієвому гранаті і лампа БУВ-30. Було показано, що вихід хромосомних порушень залежав як від енергії, так і від потужності лазерного випромінювання. Найбільш високим (37%) він був у перші години після опромінення. Цитогенетична ефективність випромінювання лазера приблизно на порядок вище, ніж ультрафіолетової лампи .
Для остаточної відповіді на це питання необхідні дослідження різних сторін біологічної дії лазерного ультрафіолетового випромінювання. Є роботи про вплив потужного імпульсного лазерного випромінювання з довжиною хвилі 265 нм на виживаність різних клітинних штамів в культурі тканин, на ультраструктурні зміни в клітинах диплоїдних фібробластів людини, на активність ключових ферментів метаболізму та інші біологічні об'єкти. При вивченні дії ультрафіолетового лазерного випромінювання на структуру ізольованою ДНК в розчині і ДНК вірусів і бактерій виявлено, що відмінності в ефективності звичайного і лазерного ультрафіолету обумовлені нелінійними оптичними процесами, які проявляються за певних щільностях потужності імпульсного лазерного випромінювання
З'явилися перші відомості про генетичну ефективності лазерного випромінювання в ближній УФ області спектру (300-400 нм). Наприклад, вивчалася цитогенетична дію імпульсного частотного лазера з довжиною хвилі = 337 нм. Було показано, що вихід хромосомних перебудов в клітинах насіння буряка підвищується з 4,3% у контролі до 9,8 і 11,6% при експозиції опромінення 10 і 15 хв відповідно.
Також застосовувався азотний лазер (337 нм) для отримання мутацій у сільськогосподарських рослин. Описана індукція спадково змінених форм кукурудзи при опроміненні її пилку. Робиться висновок про можливість використання ультрафіолетового лазерного випромінювання для індукції мутантних форм кукурудзи з господарсько цінними ознаками.
Вивчалася можливість отримання змінених по врожайності і вмісту білка форм культивованих грибів під впливом ультрафіолетового випромінювання лампи і азотного лазера (А = 337 нм). При дозі лазерного опромінення 4,8
Дж / були отримані високоврожайні спадково змінені форми грибів.
Перш ніж перейти до найцікавішого з точки зору теорії і практики мутагенезу питання про генетичну ефективності лазерного випромінювання видимій області спектра, необхідно розглянути ті біологічні ефекти, які випливають з можливості фокусувати лазерне випромінювання на дуже маленьку площу, розмірну ультрачтруктулі клітини, завдяки високому ступеню спрямованості та паралельності лазерного променя. Будемо розглядати дію сильно сфокусованим за допомогою мікроскопа лазерним випромінюванням.
Випромінювання лазера може бути сконцентровано, згідно з теоретичними розрахунками, в пучок діаметром, рівним 1/2 довжини хвилі випромінюваного світла. Дана методика дозволяє досягти високої щільності енергії та вибірковості дії лазерного випромінювання .
У дослідах мікрооблучення клітин саламандри в культурі тканин застосовували систему, що складається з аргонового лазера (488 нм, потужність 1,5 Вт в імпульсі і тривалість 25 мкс). Випромінювання лазера фокусувалася через фазовоконтрастну іммерсійну систему фотомікроскопа Цейс.
Мікропромінь певних ділянок хромосом ядерець клітин викликає блокування мітозу на стадії профази.
При мікрооблученні великих акроцентричних хромосом клітин вплив здійснювали світлом аргонового лазера з довжиною хвилі випромінювання 488 та 514 нм і випромінюванням лазера на органічних барвниках 440-460 нм. Щільність енергії в сфокусоване точці змінювалася від 50 до
1000
мкДж /
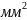 .
Поріг ушкодження для хромосом, пофарбованих
акридиновим помаранчевим, дорівнював
50 мкДж /
,
а для нефарбованих хромосом - 500 мкДж /
мм2. Аналіз пошкоджень був зроблений за
допомогою світлового та електронного
мікроскопа. Діаметр їх був набагато
менше діаметра пучка, що, на думку
авторів, говорить про високу регенераційної
здатності клітини.
.
Поріг ушкодження для хромосом, пофарбованих
акридиновим помаранчевим, дорівнював
50 мкДж /
,
а для нефарбованих хромосом - 500 мкДж /
мм2. Аналіз пошкоджень був зроблений за
допомогою світлового та електронного
мікроскопа. Діаметр їх був набагато
менше діаметра пучка, що, на думку
авторів, говорить про високу регенераційної
здатності клітини.
Проводили клонування клітини Поторові, в якій за допомогою мікропроменя аргонового лазера (514 нм) було проведено відсікання сегмента в однієї з хромосом. З даної клітини отримано потомство в 300 клітин. Висновок, що при уточненні параметрів мікрооблучення дана методика може бути застосована для картування генів і отримання нових генетичних маркерів.В інших роботах підкреслюється, що мікрооблучення хромосом перспективно для дослідження їх структури, функції і стабільності. Опромінення мікропроменем лазера області центромери хромосоми може бути використано для селективного видалення цілих хромосом з ділиться клітини.
Треба сказати, що поряд з певними перевагами використання лазерного мікрооблучення в цитогенетичних дослідженнях має і ряд недоліків. Вони полягають у великих технічних труднощах проведення таких дослідів, в пошкодженні, крім хромосом, інших клітинних ультраструктур, що ускладнює інтерпретацію результатів, і в неможливості використання отриманих даних для реальної оцінки цитогенетичної ефективності лазерного випромінювання різних параметрів.
Крім спрямованості іншою особливістю лазерного випромінювання в порівнянні зі звичайним світлом є величезна потужність імпульсу для лазерів, що працюють в імпульсному режимі. Відомості про різні морфологічних пошкодженнях тваринних і рослинних клітин під дією потужного імпульсного лазерного випромінювання численні. Даних же про цитогенетичну дії імпульсного лазерного випромінювання видимій області спектра практично не було. Досліди з мікрооблученням клітини можна брати до уваги, бо там було відсутнє дію власне світла, його ефект цілком можна уподібнити до дії мікроголки.
Використовувався
лазер в режимі вільної генерації з
тривалістю імпульсу 10 ~ 3 с. Зразок об'ємом
1
 опромінювали в скляній посудині з
проміжком в 2 хв при щільності енергії
випромінювання 300, 600 і 1200 Дж /
.
Аналізували хромосомні перебудови на
стадії метафази. Спонтанні аберації
зустрічалися в 2% клітин. Через 24 год
після опромінення при дозі 600 і 1200 Дж /
частота перебудов хромосом в клітинах
збільшувалася до 5,2 і 28% відповідно, а
через 48 год становила 3,9 і 16% відповідно.
Випромінювання лазера порушує процеси
репарації в клітині, що може відбуватися
за рахунок вільних радикалів, ударних
і теплових ефектів, що виникають при
опромінювали в скляній посудині з
проміжком в 2 хв при щільності енергії
випромінювання 300, 600 і 1200 Дж /
.
Аналізували хромосомні перебудови на
стадії метафази. Спонтанні аберації
зустрічалися в 2% клітин. Через 24 год
після опромінення при дозі 600 і 1200 Дж /
частота перебудов хромосом в клітинах
збільшувалася до 5,2 і 28% відповідно, а
через 48 год становила 3,9 і 16% відповідно.
Випромінювання лазера порушує процеси
репарації в клітині, що може відбуватися
за рахунок вільних радикалів, ударних
і теплових ефектів, що виникають при
дії потужного імпульсного випромінювання .
Найбільший інтерес викликають факти, що свідчать про цитогенетичну дію безперервного, в тому числі низькоинтенсивного лазерного випромінювання видимої області спектра, тепловими та ударними ефектами якого при впливі на біологічний об'єкт можна знехтувати. Слід зазначити роботи радянських дослідників, опубліковані в кінці 60-х - початку 70-х років. Було показано, що вплив неперервного випромінювання газових лазерів з довжинами хвиль 488, 568 і 632 нм на проростки цибулі призводить до більш ніж дворазового збільшення частоти хромосомних порушень в клітинах меристеми.
При впливі низькоінтенсивнорго лазерного випромінюванням з X - 632 нм на пилок спостерігалося збільшення частоти хромосомних порушень.Мусаєв та ін. (1971) в якості об'єкта дослідження використовували проростки томатів з довжиною корінця 4 мм. Експозиція опромінення 5, 15, 30 і 45 хв. У міру її збільшення підвищувався відсоток хромосомних перебудов в порівнянні з контролем і досяг 13,6% при опроміненні протягом 45 хв (у контролі - 3,4%) при обробці 5 хв - 5,1%, 15 хв - 9,2% , 30 хв - 12,4%). Повідомлення про цитогенетичну дію лазерного світла на рослинні клітини, що з'явилися під час виконання цієї роботи, будуть розглянуті при обговоренні експериментального матеріалу.
Якщо мутагенну дію імпульсного лазерного випромінювання можна пояснити особливостями взаємодії дуже потужного випромінювання з біологічними структурами, то факти мутагенної ефективності низькоінтенсивного лазерного випромінювання видимій області спектра досить несподівані. Такі факти почали накопичуватися приблизно з середини 70-х років. Спочатку відзначалися випадки виникнення у варіантах опромінення насіння світлом гелій-неонового лазера (633 нм) одиничних мутантних форм, наприклад, у таких культур, як томати., гвоздика та ін.
Потім почали з'являтися повідомлення про можливість отримання під дією лазерного світла мутантних форм сільськогосподарських культур з цінними господарськими ознаками. Так, вивчалася дія низькоінтенсивного випромінювання на кукурудзу. Джерелом опромінення насіння служив гелій-неоновий лазер ОКТ-12 (Х = 633 нм, щільність потужності
0,02 мВт / , експозиція опромінення 0,5; 1; 2; 4 год). У другому поколінні (102 сім'ї) було виділено 7 нових генотипів із зміною всього габітусу рослин і ознаками структури качана. Крім цього, з 102 досліджуваних сімей Мг виділено 23 скоростиглі, що дозрівають на 5-8 днів раніше вихідних форм. Таким чином, складається думка про можливість мутагенної ефективності лазерного випромінювання видимої області спектра.
До теперішнього часу літературні дані про різні мутації, індукованих лазерним випромінюванням у різних сільськогосподарських культур, численні. У більшості робіт використовувався гелій-неоновий лазер з довжиною хвилі в червоній області спектра. Так, у кукурудзи в результаті такого опромінення насіння і пилку були отримані мутаційні зміни по скоростиглості, якості зерна, підвищенню врожайності, збільшенню кількості пилку в волотях.
Показано, що лазерне випромінювання викликає досить високу частоту і широкий спектр мінливості у гречки. При цьому виникали мутації зі зміненим габітусом рослин, формою суцвіття і вегетаційним періодом. Причому зменшення експозиції (60-120 хв) сприяло появі форм з подовженим вегетаційним періодом, а збільшення її до 180-240 хв - появі скоростиглих форм. Господарсько цінні мутанти отримані під дією випромінювання з довжиною хвилі 632,8 нм при експозиції 60 хв і 337,1 нм - 30 хв.
Вивчення генетичної дії імпульсного і безперервного лазерного випромінювання різних довжин хвиль переважно видимого діапазону спектра на біологічних об'єктах, що необхідно для загальної його оцінки і має велике практичне значення, зокрема для вироблення науково обґрунтованих норм техніки безпеки при роботі з лазерними установками.
Дослідження мутагенної дії лазерного випромінювання, в тому числі низкоінтенсивного світла на сільськогосподарські рослини для оцінки перспектив застосування цього нового мутагену в селекції та інших прикладних областях генетики.
Аналіз закономірностей генетичної мінлмвості рослин при впливі випромінювання на насіння, генеративну систему і цілісний організм, що необхідно для розкриття механізму цього нового явища в фото-біологіі та генетиці.
Ці завдання взаємопов'язані з фундаментальними проблемами пізнання закономірностей регуляції біологічних процесів і розробки на цій основі нових ефективних способів раціонального використання ресурсів рослинного і тваринного світу на благо людини.
