
- •Передмова
- •Загальні методичні рекомендації
- •Програма курсу
- •1 Основні поняття і закони хімії
- •Контрольні завдання
- •2 Будова атома. Періодичний закон і періодична система елементів
- •Контрольні завдання
- •3 Основні класи неорганічних сполук
- •Хімічні властивості кислотних оксидів
- •Хімічні властивості амфотерних оксидів
- •Номенклатура основ
- •Хімічні властивості основ
- •Кислоти
- •Номенклатура кислот
- •Назви оксигеновмісних кислот
- •Хімічні властивості кислот
- •Хімічні властивості солей
- •Контрольні завдання
- •4 Хімічний зв'язок. Будова молекул і кристалів
- •Контрольні завдання
- •5 Комплексні (координаційні) сполуки
- •Контрольні завдання
- •6 Окисно-відновні процеси
- •Контрольні завдання
- •7 Хімічна кінетика. Хімічна рівновага
- •Контрольні завдання
- •8 Розчини. Гідроліз солей
- •Способи виразу складу розчинів
- •1 Гідроліз солей іі типу
- •2 Гідроліз солей ііі типу
- •3 Гідроліз солей іv типу
- •Контрольні завдання
- •9 Хімічні властивості металів. Основи електрохімії
- •Електродні потенціали. Гальванічний елемент
- •Електроліз
- •1 Електроліз розплавів
- •2 Електроліз водних розчинів солей
- •Катодні процеси
- •Анодні процеси
- •Електроліз з активним анодом
- •Лабораторна робота № 1 Класи неорганічних сполук Хід роботи
- •1 Кислотні оксиди
- •2 Основні оксиди
- •3 Амфотерні оксиди
- •4 Гідрати оксидів
- •Лабораторна робота №2 Окисно-відновні реакції Хід роботи
- •Лабораторна робота № 3 Гідроліз солей Хід роботи
- •Лабораторна робота № 4 Хімічні та електрохімічні властивості металів Хід роботи
- •4 Електроліз водного розчину натрій хлориду
- •Перелік рекомендованих джерел
- •Класифікація електролітів
4 Хімічний зв'язок. Будова молекул і кристалів
Хімічний зв'язок – це результат взаємодії атомів, що обумовлює стійкість молекул або кристалів і супроводжується зменшенням енергії системи.
За електронною теорією валентності хімічний зв'язок утворюється внаслідок перерозподілу валентних електронів, у результаті чого виникає стійка електронна конфігурація благородного газу (октет) (Коссель) завдяки утворенню йонів або утворенню спільних електронних пар (Льюїс). Наприклад, льюїсова схема утворення молекули водню і молекули хлороводню:
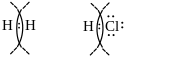
Хімічний зв'язок характеризується енергією і довжиною. Звичайно він зображується рисками , що сполучає атоми, які взаємодіють між собою. Кожна риска еквівалентна узагальненій парі електронів: Н-Н, Cl-Cl, N≡N, H-F.
У сполуках, що містять більше, ніж два атоми, важливою характеристикою є валентний кут, утворений хімічними зв'язками в молекулі і відображає її геометрію.
Типи хімічного зв’язку
Ковалентний зв'язок - хімічний зв'язок, що виникає за рахунок усуспільнення електронної пари за обмінним механізмом, коли кожен з атомів постачає по одному електрону, або за донорно-акцепторним механізмом, якщо електронна пара передається у спільне користування одним атомом (донором) іншому атому (акцептору). Розрізняють ковалентний неполярний та полярний зв'язок.
Йонний зв'язок - окремий випадок ковалентного, коли спільна електронна пара повністю належить більш електронегативному атому.
Металічний зв'язок виникає в результаті часткової делокалізації валентних електронів, які досить вільно рухаються в гратці металів, електростатично взаємодіючи з позитивно зарядженими йонами.
Згідно з методом валентних зв’язків (МВС) хімічний зв'язок утворюється при перекриванні орбіталей, на яких розміщуються валентні електрони. При цьому можливі наступні способи перекривання деяких орбіталей:

Такий спосіб перекривання називається σ-зв’язком - область перекривання лежить на лінії, яка з’єднує центри атомів.
Інший спосіб перекривання орбіталей,

який називається π-зв’язком - область перекривання лежить по обидві сторони від лінії, яка з’єднує центри атомів.
Для пояснення рівноцінності зв’язків у молекулах, для яких перекриваються нерівноцінні s-s та s-p-орбіталі, введено поняття про sp-, sp2-, sp3-гібридизацію.
У молекулі BeCl2 хімічні зв’язки утворюються внаслідок перекривання двох гібридних орбіталей атома Берилію та орбіталей атомів Хлору. Такий тип гібридизації називають sp-гібридизацією. Розглянемо схему перекривання орбіталей у молекулі BeCl2.
Електронна формула берилію – 4Be …2s2,
Розподіл електронів зовнішнього енергетичного рівня по квантових комірках:

У даному стані, який називається незбудженим, валентність берилію рівна нулю, тобто немає неспарених електронів, здатних утворювати хімічні зв’язки. У сполуках берилій двовалентний внаслідок можливості розпаровування s-електронів зовнішнього енергетичного рівня і розміщення їх на р-орбіталі.
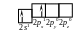
Розпаровування відбувається завдяки енергії, яка виділяється при хімічній взаємодії берилію, атом останнього переходить у так званий „збуджений стан“. Отже, збудження атомів – це розпаровування електронів у межах одного енергетичного рівня. Встановлено, що хімічні зв’язки, які утворюються завдяки цим двом електронам на відповідних орбіталях – рівноцінні. Це означає, що відбувається вирівнювання хвильових функцій 2s- і 2р-орбіталей. Замість індивідуальних s- та р-орбіталей виникають дві однакові орбіталі – гібридні орбіталі, які в просторі мають форму несиметричних вісімок і розташовуються під кутом 180° одна відносно одної.
Схематично процес sp-гібридизації показаний нижче:

Гібридні орбіталі відрізняються від вихідних як за формою, так і за запасом енергії.
Електронну формулу зовнішнього енергетичного рівня атома Хлору записують таким чином:
17Cl...3s23px13py23pz2

Валентним є 3px1-електрон. Хімічні зв’язки утворюються завдяки перекривання двох sр-гібридних орбіталей атома Берилію та 3рх-орбіталей атомів Хлору.
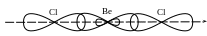

У молекулі BСl3 зв’язки утворюються при перекриванні трьох гібридизованих орбіталей атома Бору, з орбіталями атомів Хлору. Електронна формула Бору – 5B 1s22s22p1, розподіл електронів зовнішнього енергетичного рівня по квантових комірках:
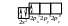
Валентність атома Бору в незбудженому стані рівна одиниці (за кількістю неспарених електронів). Внаслідок розпаровування електронів розподіл електронів по квантових комірках для атома Бору у збудженому стані записується так:
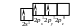
У результаті Бор стає тривалентним. Відомо, що валентні орбіталі є рівноцінними внаслідок процесу sp2-гібридизації, які умовно зображають у вигляді несиметричних вісімок, розміщених у просторі під кутом 120°.
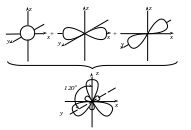
Хімічні зв’язки у молекулі BCl3 утворюються внаслідок перекривання sp2-гібридних орбіталей атома Бору та 3px-орбіталей атомів Хлору.

У молекулі СН4 зв’язки утворюються при перекриванні чотирьох гібридизованих орбіталей атома Карбону з s-орбіталями атомів Гідрогену. Такий тип гібридизації називають sp3-гібридизацією.
Скорочена електронна формула атома Карбону:
6C ...2s22p2,
розподіл електронів по квантових комірках:

Валентність Карбону в такому стані рівна двом, але при збудженні атома відбувається розпаровування електронів згідно зі схеми:

і валентність його дорівнює чотирьом. На практиці встановлено, що всі чотири орбіталі є рівноцінними внаслідок їх гібридизації і утворення чотирьох нових sp3-гібридних орбіталей:
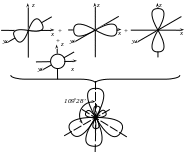
Хімічні зв’язки в CH4 утворюються внаслідок перекривання sp3-гібридних орбіталей атома Карбону та s-орбіталей атомів Гідрогену:
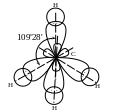
Тверді речовини, як правило, мають кристалічну будову. Вона характеризується правильним розміщенням частинок у чітко визначених точках простору. При уявному з’єднанні цих точок прямими лініями, що перетинаються, утворюється просторовий каркас, який називають кристалічною граткою. Точки, в яких розміщені частинки, називаються вузлами кристалічної гратки. У вузлах гратки можуть розміщуватись йони, атоми або молекули. Залежно від виду частинок і характеру зв’язку між ними розрізняють чотири типи кристалічних граток: йонні, атомні, молекулярні й металічні.
