
- •Передмова
- •Загальні методичні рекомендації
- •Програма курсу
- •1 Основні поняття і закони хімії
- •Контрольні завдання
- •2 Будова атома. Періодичний закон і періодична система елементів
- •Контрольні завдання
- •3 Основні класи неорганічних сполук
- •Хімічні властивості кислотних оксидів
- •Хімічні властивості амфотерних оксидів
- •Номенклатура основ
- •Хімічні властивості основ
- •Кислоти
- •Номенклатура кислот
- •Назви оксигеновмісних кислот
- •Хімічні властивості кислот
- •Хімічні властивості солей
- •Контрольні завдання
- •4 Хімічний зв'язок. Будова молекул і кристалів
- •Контрольні завдання
- •5 Комплексні (координаційні) сполуки
- •Контрольні завдання
- •6 Окисно-відновні процеси
- •Контрольні завдання
- •7 Хімічна кінетика. Хімічна рівновага
- •Контрольні завдання
- •8 Розчини. Гідроліз солей
- •Способи виразу складу розчинів
- •1 Гідроліз солей іі типу
- •2 Гідроліз солей ііі типу
- •3 Гідроліз солей іv типу
- •Контрольні завдання
- •9 Хімічні властивості металів. Основи електрохімії
- •Електродні потенціали. Гальванічний елемент
- •Електроліз
- •1 Електроліз розплавів
- •2 Електроліз водних розчинів солей
- •Катодні процеси
- •Анодні процеси
- •Електроліз з активним анодом
- •Лабораторна робота № 1 Класи неорганічних сполук Хід роботи
- •1 Кислотні оксиди
- •2 Основні оксиди
- •3 Амфотерні оксиди
- •4 Гідрати оксидів
- •Лабораторна робота №2 Окисно-відновні реакції Хід роботи
- •Лабораторна робота № 3 Гідроліз солей Хід роботи
- •Лабораторна робота № 4 Хімічні та електрохімічні властивості металів Хід роботи
- •4 Електроліз водного розчину натрій хлориду
- •Перелік рекомендованих джерел
- •Класифікація електролітів
1 Гідроліз солей іі типу
Кількість стадій гідролізу лімітується зарядом йону слабкого електроліту (катіону), який утворюється при дисоціації солі:

Перша стадія.
ZnCl2 + H2O ↔ ZnOHCl + HCl,
Zn2+ + 2Cl– + H2O ↔ ZnOH+ + Cl– + H+ + Cl–,
Zn2+ + H2O ↔ ZnOH+ + H+.
Друга стадія.
ZnOHCl + H2O ↔ Zn(OH)2 + HCl,
ZnOH+ + Cl– + H2O ↔ Zn(OH)2 + H+ + Cl–,
ZnOH+ + H2O ↔ Zn(OH)2 + H+.
Надлишок йонів Н+, що утворюється під час реакції зумовлює кислу реакцію середовища (рН < 7).
Кількість стадій гідролізу дорівнює кислотності слабкої основи.
2 Гідроліз солей ііі типу
Кількість стадій гідролізу лімітується зарядом йону слабкого електроліту (аніону), який утворюється при дисоціації солі:

Перша стадія.
Na2CO3 + H2O ↔ NaHCO3 + NaOH,
2Na+ + CO32– + H2O ↔ Na+ + HCO3– + Na+ + OH–,
CO32– + H2O ↔ HCO3– + OH–.
Друга стадія.
NaHCO3 + H2O ↔ H2CO3 + NaOH,
Na+ + HCO3– + H2O ↔ H2CO3– + Na+ + OH–,
HCO3– + H2O ↔ H2CO3 + OH–.
Надлишок йонів OН–, що утворюється під час реакції зумовлює лужну реакцію середовища (рН > 7).
Кількість стадій гідролізу дорівнює основності слабкої кислоти.
3 Гідроліз солей іv типу
Гідроліз солей ІV типу проходить в одну стадію незалежно від заряду катіону чи аніону.
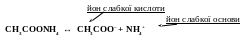
CH3COONH4 + H2O = CH3COOH + NH4OH,
CH3COO– + NH4+ + H2O = CH3COOH + NH4OH.
Гідроліз солей цього типу проходить повністю або майже повністю і записується в одну стадію, незалежно від кислотності слабкої основи чи основності слабкої кислоти. Середовище можна вважати близьким до нейтрального (рН ≈ 7).
Приклади розв’язку задач
Приклад 1. У 50 г розчину міститься 2,5 г калій гідроксиду KОН. Обчисліть масову частку KОН.
Д а н о: m (KOН) = 2,5 г mр–ну = 50 г |
Р о з в’ я з о к: Використовуючи формулу для визначення масової частки
|
В и з н а ч и т и: ω (KOН) – ? |
|
визначаємо масову
частку KОН:
|
|
В і д п о в і д ь: ω (KOН) = 5 %. |
|
Приклад 2. Визначте молярну концентрацію розчину сульфатної кислоти, якщо в 100 мл цього розчину міститься 4,904 г H2SO4.
Д а н о: Vр–ну = 100 мл = 0,1 л m (H2SO4) = 4,904 г |
Р о з в’ я з о к: Мольна маса H2SO4 М (H2SO4) = 98 г/моль. За формулою ν = т / М визначимо кількість моль H2SO4: |
В и з н а ч и т и: См – ? |
|
Знаходимо молярну концентрацію 100 мл (0,1 л) розчину сульфатної кислоти:
|
|
В і д п о в і д ь: См = 0,5 моль/дм3 |
|
Приклад 3. Обчисліть молярну концентрацію 15 %–го розчину сульфатної кислоти (ρ = 1,10 г/см3).
Д а н о: ρр–ну = 1,10 г/см3 ωр–ну = 15 % |
Р о з в’ я з о к: Молярну
концентрацію розчину визначаємо
за формулою:
|
В и з н а ч и т и: См (H2SO4) – ? |
|
Знаючи, що ν =
тр.р./М, а
Молярна маса М(H2SO4) = 98 г/моль.
Виходячи з формули
Підставивши значення у вищевиведену формулу, отримаємо:
|
|
Відповідь: См (H2SO4) = 1,6837 моль/дм3. |
|
Приклад 4. В якому співвідношенні за масою необхідно змішати 14 %-ний і 56 %-ний розчини сульфатної кислоти, щоб приготувати 20 %-ний розчин?
Р о з в’ я з о к: Користуючись правилом хреста, складемо схему:
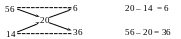
Кожна різниця показує масові частки того розчину, масова частка якого написана на тій самій горизонтальній стрічці. Отже, для приготування 20%-го розчину необхідно взяти 6 масових частин 56 %-го і 36 масових частин 14 %-го розчину.
Відповідь: 6 мас. ч. 56 %-го і 36 мас. ч. 14 %-го розчинів.
Приклад 5. Визначити рН 0,03 М розчину НСl.
Розв’язок: Сильні кислоти дисоціюють у водних розчинах повністю і концентрація йонів Гідрогену рівна концентрації кислоти:
НСl ↔ Н+ + Cl–
[НСl] = 0,03 М і, відповідно [Н+] = 0,03 М.
Звідки:
рН = – lg [Н+] = – lg 3∙10–2 = 2 – lg 3 = 1,5.
Відповідь: Для 0,03 М розчину НСl рН = 1,5.
Приклад 6. Визначити рН 0,01 М розчину NaOH.
Розв’язок: NaOH – сильна основа.
NaOH ↔ Na+ + OH–
[NaOH] = 0,01 М і, відповідно [OН–] = 0,01 М.
Отже, рОН = – lg [ОН–] = – lg 10–2 = 2
Враховуючи, що рН + рOH = 14, одержимо
рН = 14 – рОН = 14 – 2 = 12.
Відповідь: Для 0,01 М розчину NaOH рН = 12.
