
- •Продовження таблиці 1
- •Контрольні питання
- •1.2 Будова атома
- •Контрольні питання
- •Контрольні питання
- •1.4 Хімічна спорідненість
- •Контрольні питання
- •Чи є можливою ця реакція при стандартних умовах?
- •1.5 Хімічна кінетика і рівновага
- •Контрольні питання
- •1 Окислення сірки і її діоксиду протікає за рівняннями:
- •1.6 Способи вираження концентрації розчину
- •Контрольні питання
- •1.7 Іонно-молекулярні (іонні) реакції обміну
- •Контрольні питання
- •1.8 Гідроліз солей
- •Контрольні питання
- •Контрольне завдання № 2
- •2.1 Окисно-відновні реакції
- •Контрольні питання
- •2.2 Електродні потенціали та електрорушійні сили
- •Контрольні питання
- •2.3 Електроліз
- •Контрольні питання
- •2.4 Корозія металів
- •Контрольні питання
- •2.5 Твердість води і методи її усунення
- •Контрольні питання
- •2.6 Органічні сполуки. Полімери Контрольні питання
- •Список літератури
- •Додаток а
Українська Державна Академія Залізничного Транспорту
Методичні вказівки та завдання до контрольних робіт з хімії
(для студентів технічних спеціальностей безвідривної форми навчання)
Харків 2002 р.
Методичні вказівки та завдання до контрольних робіт з хімії розглянуто та рекомендовано до друку на засіданні кафедри «Охорона праці та довкілля» 26 червня 2002 р., протокол №13.
Укладачі:
проф. Шапка О.В.,
доц. Костиркін О.В.,
асистенти Коваленко Т.О.,
Кисельова С.О.,
викл. Цебро В.А.(ХТЗТ)
Рецензент
проф. Плугін А.М.
1 Загальні вказівки
Хімія – це наука про перетворення речовин. Вона вивчає склад і будову речовин, залежність властивостей речовин від їх складу й будови, умови й шляхи перетворень одних речовин в інші.
В курсі “Хімія” студенти заочної форми навчання залізничних спеціальностей вивчають основи хімії, хімічні процеси та властивості речовин, що мають застосування на залізничному транспорті. Мова йде про чорні та кольорові метали, сплави, полімерні матеріали, паливо та мастила для локомотивів, миючі та просочувальні засоби, гальванічні джерела струму, корозію металів та ін. Треба також враховувати, що хімія – це основоположна дисципліна для багатьох спеціальних дисциплін, охорони праці, охорони навколишнього середовища.
Порядок вивчення курсу “Хімія”:
а) самостійне вивчення курсу за рекомендованою літературою згідно з тематичним планом;
б) виконання контрольних робіт (№1 та №2);
в) співбесіда з викладачем по виконаній контрольній роботі;
г) проходження підсумкового контролю знань з хімії.
Під час установчих сесій проводиться читання оглядових лекцій, а також на протязі семестру проводяться консультації викладачами кафедри “Охорона праці та навколишнього середовища”. При роботі з рекомендованою літературою бажано законспектувати вивчений матеріал. Цей конспект допоможе якісно виконати контрольні роботи, а також підготуватися до підсумкового контролю знань.
2 Тематичний план курсу “Хімія”
Тема № 1. Хімія як предмет природознавства. Роль хімії в розвитку промисловості та транспорту України. Основні закони хімії. Будова атома. Періодичний закон Д.І. Менделєєва.
Тема № 2. Хімічний зв’язок. Будова молекул. Види взаємодії молекул. Агрегатний стан речовин. Кристалічний стан речовини. Металевий зв’язок.
Тема № 3. Енергетика хімічних процесів. Закони термохімії. І закон термодинаміки. Ентальпія. ІІ закон термодинаміки. Ентропія. Енергія Гіббса.
Тема № 4. Хімічна кінетика. Закон дії мас. Правило Вант-Гоффа. Хімічна рівновага в гомогенних системах. Принцип Ле-Шательє. Кінетика та рівновага в гетерогенних системах. Каталіз.
Тема № 5. Розчини. Способи вираження складу розчинів. Закони ідеальних розчинів. Електроліти. Властивості розчинів електролітів. Водневий показник. Іонні реакції в розчинах. Гідроліз солей.
Тема № 6. Електрохімічні процеси. Окисно-відновні реакції. Електродний потенціал. Електрохімічний ряд напруги металів. Рівняння Нернста. Гальванічні елементи. Акумулятори. Електроліз. Гальванотехніка. Закони Фарадея.
Тема № 7. Корозія металів. Види корозії. Суть електрохімічної корозії. Методи захисту від корозії. Електрохімічний захист. Інгібітори корозії.
Тема № 8. Хімія полімерів. Методи одержання полімерів. Властивості полімерів. Пластмаси та їх застосування на транспорті . Фенопласти. Амінопласти.
Тема № 9. ( Для студентів механічного та будівельного факультетів). Хімія води. Фізичні та хімічні властивості води. Твердість води та методи її усунення. Фізичні та хімічні властивості металів. Методи отримання чистих металів. Сплави.
Тема № 10. ( Для студентів будівельного факультету). Хімія в’яжучих речовин. Повітряні й гідравлічні в’яжучі речовини. Вапно. Гіпс. Цемент, схоплення та твердіння. Бетони. Корозія бетонів та методи боротьби з нею.
Тема № 11. (Для студентів факультету УПП). Властивості небезпечних хімічних речовин, що перевозяться залізничним транспортом. Кислоти. Луги. Стиснені та зріджені гази. Вибухонебезпечні речовини.
3 Завдання на контрольні роботи та методичні вказівки до їх виконання
Учбовим планом передбачено виконання двох контрольних робіт студентами БФН. Ці методичні вказівки передбачають розв’язання 8 задач в рамках контрольної роботи № 1 і 6 задач в рамках контрольної роботи № 2. Перед виконанням контрольної роботи треба засвоїти теоретичний матеріал згідно з тематичним планом. Крім того, необхідно ознайомитись з прикладами розв’язання задач, що наведені на початку кожного розділу.
Варіант контрольної роботи (підбір номерів задач) визначається за таблицями варіантів для контрольної роботи № 1 і №2 з використанням учбового шифру(див. таблиці 1, 2).
На титульній сторінці контрольної роботи треба вказати прізвище виконавця та його шифр. Робота повинна бути підписана і вказана дата.
На першій сторінці потрібно вказати номери задач відповідно до варіанта студента.
Таблиця 1- Варіанти завдань для контрольної роботи № 1
Остання цифра навчального шифру |
Передостання цифра навчального шифру |
|||||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
0 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
1 |
1 21 38 53 74 85 103 121 |
2 22 39 54 75 86 104 122 |
3 23 40 55 76 87 105 123 |
4 24 41 56 77 88 106 124 |
5 25 42 57 78 89 107 125 |
6 26 43 58 79 90 108 126 |
7 27 44 59 80 91 109 127 |
8 28 45 60 81 92 110 128 |
9 29 46 61 82 93 111 129 |
10 30 47 62 79 94 112 130 |
2 |
11 31 48 63 75 95 113 131 |
12 32 49 64 76 96 114 132 |
13 33 50 65 77 97 115 133 |
14 34 51 66 78 98 116 134 |
15 35 52 67 79 99 117 135 |
16 36 38 68 80 100 118 136 |
17 37 39 69 81 101 119 137 |
18 21 40 70 82 85 120 138 |
19 22 41 71 73 83 102 139 |
20 23 42 72 74 84 103 123 |
3 |
2 24 43 54 76 97 104 124 |
3 25 44 55 77 98 105 125 |
4 26 45 56 78 99 106 126 |
5 27 46 57 79 100 107 127 |
6 28 47 58 80 101 108 128 |
7 29 48 59 81 83 109 129 |
8 30 49 60 82 84 110 130 |
9 31 50 61 73 85 111 131 |
10 32 51 62 74 86 112 132 |
11 33 52 63 75 87 113 133 |
4 |
12 34 39 64 77 88 114 134 |
13 35 40 65 78 89 115 135 |
14 36 41 66 79 90 116 136 |
15 37 42 67 80 91 117 137 |
16 21 43 68 81 92 118 138 |
17 22 44 69 82 93 119 139 |
18 23 45 70 73 94 120 121 |
19 24 46 71 74 95 102 122 |
20 25 47 72 75 96 103 123 |
1 26 48 53 76 97 104 124 |
5 |
3 27 49 55 78 83 105 125 |
4 28 50 56 79 84 106 126 |
5 29 51 57 80 85 107 127 |
6 30 52 58 81 86 108 128 |
7 31 38 59 82 87 109 129 |
8 32 39 60 73 88 110 130 |
9 33 40 61 74 89 111 131 |
10 34 41 62 75 90 112 132 |
11 35 42 63 76 91 113 133 |
12 36 43 64 77 92 114 134
|
Продовження таблиці 1
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
11 |
11 |
|
6 |
13 37 44 65 79 93 115 135 |
14 21 45 66 80 94 116 136 |
15 22 46 67 81 95 117 137 |
16 23 47 68 82 96 118 138 |
17 24 48 69 73 97 119 139 |
18 25 49 70 74 98 120 121 |
19 26 50 71 75 99 102 122 |
20 27 51 72 76 100 103 123 |
1 28 52 53 77 101 104 124 |
2 29 38 54 78 83 105 125 |
|
7 |
4 30 40 57 80 84 106 128 |
5 31 41 58 81 85 107 129 |
6 32 42 59 82 86 108 130 |
7 33 43 60 73 87 109 131 |
8 34 44 61 74 88 110 132 |
9 35 45 62 75 89 111 133 |
10 36 46 63 76 90 112 134 |
11 37 47 64 77 91 113 135 |
12 21 48 65 78 92 114 136 |
13 22 49 66 79 93 115 137 |
|
8 |
14 23 50 67 81 94 116 138 |
15 24 51 68 82 95 117 139 |
16 25 52 69 73 96 118 121 |
17 26 38 70 74 97 119 122 |
18 27 39 71 75 98 120 123 |
19 28 40 72 76 99 102 124 |
20 29 41 53 77 100 103 125 |
1 30 42 54 78 101 104 126 |
2 31 43 55 74 83 105 127 |
3 32 44 56 80 84 106 128 |
|
9 |
5 33 45 59 82 85 107 130 |
6 34 46 60 73 86 108 131 |
7 35 47 61 74 87 109 132 |
8 36 48 62 75 88 110 133 |
9 37 49 63 76 89 111 134 |
10 21 50 64 77 90 112 135 |
11 22 51 65 78 91 113 136 |
12 23 52 66 79 91 114 137 |
13 24 38 67 80 93 115 138 |
14 25 39 68 81 94 116 139 |
|
0 |
15 26 41 69 73 95 117 121 |
16 27 42 70 74 96 118 122 |
17 28 43 71 75 97 119 123 |
18 29 44 72 76 98 120 124 |
19 30 45 53 77 99 102 125 |
20 31 46 54 78 100 103 126 |
1 32 47 55 79 101 104 127 |
2 33 48 56 80 83 105 128 |
3 34 49 57 81 84 106 129 |
4 35 50 58 82 85 107 130 |
|
Таблиця 2 - Варіанти завдань для контрольної роботи № 2
Остання цифра навчального шифру |
Передостання цифра навчального шифру |
|||||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
0 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
1 |
140 160 180 200 220 239 |
141 161 181 201 221 240 |
142 162 182 202 222 241 |
143 163 183 203 223 242 |
144 164 184 204 224 243 |
145 165 185 205 225 244 |
146 166 186 206 226 245 |
147 167 187 207 227 246 |
148 168 188 208 228 247 |
149 169 189 209 229 248 |
2 |
150 170 190 210 230 249 |
151 171 191 211 231 250 |
152 172 192 212 232 251 |
153 173 193 213 233 252 |
154 174 194 214 234 253 |
155 175 195 215 235 254 |
156 176 196 216 236 255 |
157 177 197 217 237 256 |
158 178 198 218 238 257 |
159 179 199 219 220 258 |
3 |
141 160 182 205 221 240 |
142 161 183 206 222 241 |
143 162 184 207 223 242 |
144 163 185 208 224 243 |
145 164 186 209 225 244 |
146 165 187 210 226 245 |
147 166 188 211 227 246 |
148 167 190 212 228 247 |
149 168 191 213 229 248 |
150 169 192 214 230 249 |
4 |
151 170 193 204 231 250 |
152 171 194 203 232 251 |
153 172 195 202 233 252 |
154 173 196 201 234 253 |
155 174 197 200 235 254 |
156 175 198 219 236 255 |
157 176 199 218 237 256 |
158 177 180 217 238 257 |
159 178 181 216 220 258 |
140 179 182 215 221 239 |
5 |
142 160 182 210 222 241 |
143 161 183 211 223 242 |
144 162 184 212 224 243 |
145 163 185 213 225 244 |
146 164 186 214 226 245 |
147 165 187 215 227 246 |
148 166 188 216 228 247 |
149 167 189 217 229 248 |
150 168 190 218 230 249 |
151 169 191 219 231 250 |
6 |
152 170 192 201 232 251 |
153 171 193 202 233 252 |
154 172 194 203 234 253 |
155 173 195 204 235 254 |
156 174 196 205 236 255 |
157 175 180 206 237 256 |
158 176 181 207 238 257 |
159 177 197 208 220 258 |
140 178 198 209 221 239 |
141 174 199 201 222 240 |
7 |
143 160 184 203 223 242 |
144 161 185 204 224 243 |
145 162 186 205 225 244 |
146 163 187 206 226 245 |
147 164 185 207 227 246 |
148 165 189 208 228 247 |
149 166 190 209 229 248 |
150 167 191 210 230 249 |
151 168 192 211 231 250 |
152 169 193 212 232 251 |
Закінчення таблиці 2
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
8 |
153 170 194 213 233 252 |
154 171 195 214 234 253 |
155 172 196 215 235 254 |
156 173 197 201 236 255 |
157 174 198 202 237 256 |
158 175 199 216 238 257 |
159 176 180 217 220 258 |
140 177 181 218 221 239 |
141 178 182 219 222 240 |
142 179 183 200 223 241 |
|
9 |
144 160 187 207 224 243 |
145 161 188 208 225 244 |
146 162 189 209 226 245 |
147 163 190 210 227 246 |
148 164 191 211 228 247 |
149 165 192 212 229 248 |
150 166 193 213 230 249 |
151 167 194 214 231 250 |
152 168 195 215 232 251 |
153 169 196 216 233 252 |
|
0 |
154 170 197 217 234 253 |
155 171 198 218 235 254 |
156 172 199 219 236 255 |
157 173 180 200 237 256 |
158 174 181 201 238 257 |
159 175 182 202 230 258 |
140 176 183 203 231 239 |
141 177 184 204 232 240 |
142 178 185 205 233 241 |
143 179 186 206 234 242 |
|
Контрольне завдання № 1
1.1 Моль. Еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
Моль
- одиниця кількості речовини системи,
що містить стільки ж структурних
елементів, скільки міститься атомів у
вуглеці-12 масою 0,012 кг. При застосуванні
моля структурні елементи повинні бути
специфіковані: можуть бути атомами,
молекулами, іонами, електронами й іншими
частками або специфікованими групами
часток. Моль речовини відповідає
постійній Авогадро NA
= (6,022045 ± 0,000031)·1023
моль-1
структурних елементів. При застосуванні
поняття "моль" необхідно вказувати,
які структурні елементи мають на увазі,
наприклад, моль атомів Н, моль молекул
Н2,
моль протонів, моль електронів та ін.
Так, заряд моля електронів дорівнює
6,022·1023
![]() і відповідає кількості електрики, яка
дорівнює 1 фараді (F). Маса моля атомів
або маса моля молекул (мольна чи молярна
маса), яка виражена в грамах (г/моль), це
грам-атом даного елемента, або, відповідно,
грам-молекула даної речовини в попередньому
розумінні.
і відповідає кількості електрики, яка
дорівнює 1 фараді (F). Маса моля атомів
або маса моля молекул (мольна чи молярна
маса), яка виражена в грамах (г/моль), це
грам-атом даного елемента, або, відповідно,
грам-молекула даної речовини в попередньому
розумінні.
Приклад 1. Виразити в молях: а) 6,02·1021 молекул СО2; б) 1,20·1024 атомів кисню; в) 2,00·1023 молекул води. Чому дорівнює мольна (молярна) маса зазначених речовин?
Розв’язання. Моль — це кількість речовини, у якій міститься число часток будь-якого визначеного сорту, яке дорівнює постійній Авогадро (6,02·1023).
Звідси: а) 6,02·1021, тобто 0,01 моль; б) 1,20·1024, тобто 2 моль; в) 2,00·1023, тобто 1/3 моль.
Маса моля речовини виражається в кг/ моль або г/моль. Мольна (молярна) маса речовини в грамах чисельно дорівнює її відносній молекулярній (атомній) масі, яка виражена в атомних одиницях маси (а.о.м). Молекулярні маси СО2 та Н2О і атомна маса кисню відповідно рівні 44; 18 і 16 а.о.м., отже їх мольні (молярні) маси рівні: а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Приклад 2. Визначити еквівалент і еквівалентну масу me азоту, сірки та хлору в сполуках NH3, H2S і HCl.
Розв’язання. Маса речовини й кількість речовини — це поняття неідентичні. Маса виражається в кілограмах (грамах), а кількість речовини — у молях.
Еквівалент елемента (Е) – це така кількість речовини, що з'єднується з 1 моль атомів водню або заміщує таку ж кількість атомів водню в хімічних реакціях. Маса 1 еквівалента елемента називається його еквівалентною масою (me). Таким чином, еквіваленти виражаються в молях, а еквівалентні маси – у г/моль.
У даних сполуках з 1 моль атомів водню з'єднується 1/3 моль атомів азоту, 1/2 моль атомів сірки і 1 моль атомів хлору. Звідси Е(N) = 1/3 моль, Е(S) = 1/2 моль, E(C1) = 1 моль. Виходячи з мольних мас цих елементів, знаходимо їхні еквівалентні маси: me(N) = 1/3 14 = 4,67 г/моль,
me(s) =1/2 ·32 = 16г/моль, me(C1)= 1 · 35,45 =35,45 г/моль.
Приклад 3. На відновлення 7,09 г оксиду двовалентного металу потрібно 2,24 л водню (за н.у.). Обчисліть еквівалентну масу оксиду та еквівалентну масу металу. Чому дорівнює атомна маса металу?
Нормальні умови за Міжнародною системою одиниць (СО) : тиск 1,013 · 105 Па (760 мм рт. ст. =1 атм), температура 2730К або 00С.
Розв’язання. Згідно з законом еквівалентів маси (об’єми) речовин, що реагують одна з одною m1 і m2, пропорційні їх еквівалентним масам (об’ємам) :
![]() (1)
(1)
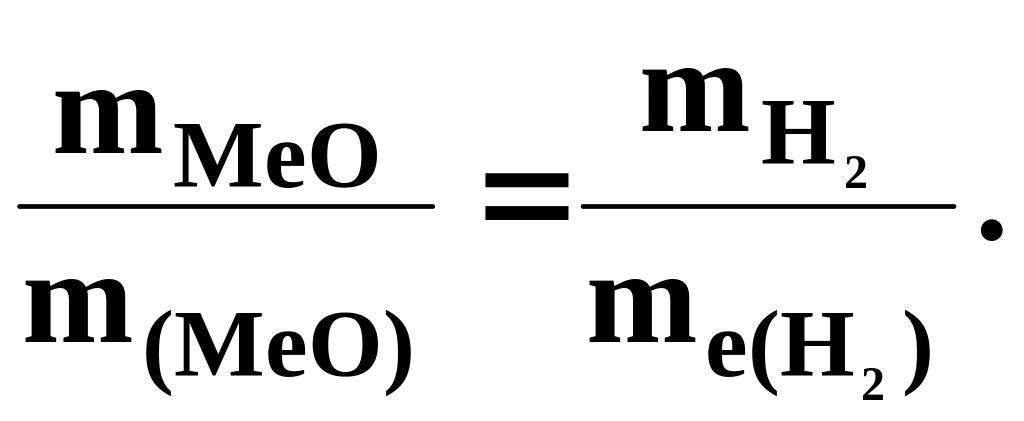 (2)
(2)
Якщо одна з речовин знаходиться в газоподібному стані, то, як правило, кількість виміряється в об'ємних одиницях (см3, л, м3).
Об’єм,
який займає за даних умов мольна чи
еквівалентна маса газоподібної речовини,
називається мольним чи відповідно
еквівалентним об’ємом цієї речовини.
Мольний об’єм будь-якого газу за н.у.
дорівнює 22,4 л. Звідси еквівалентний
об’єм водню
![]() ,
молекула якого складається з двох
атомів, тобто містить два молі атомів
водню, дорівнює 22,4:2 =11,2 л. У формулі (2)
відношення
,
молекула якого складається з двох
атомів, тобто містить два молі атомів
водню, дорівнює 22,4:2 =11,2 л. У формулі (2)
відношення
 замінюємо рівним йому відношенням
замінюємо рівним йому відношенням
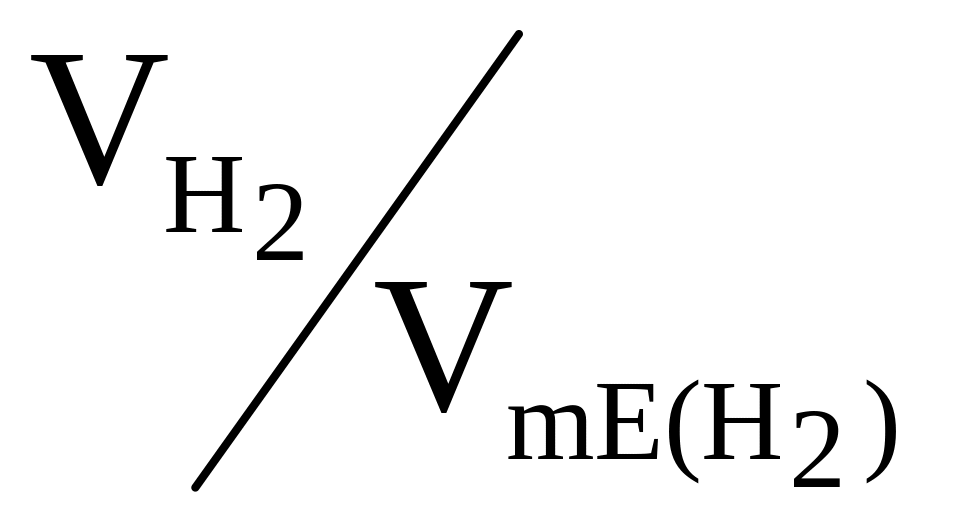 ,
,
де
![]() - об’єм водню;
- об’єм водню;
![]() - еквівалентний об’єм
водню
- еквівалентний об’єм
водню
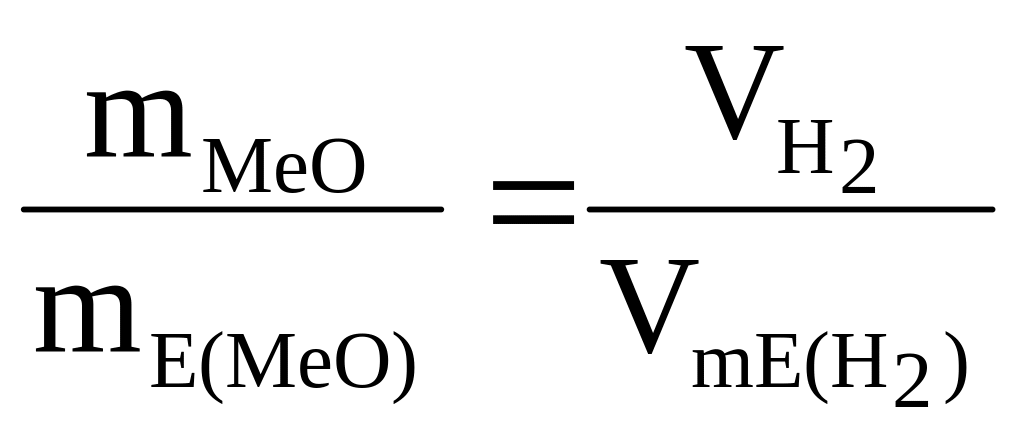 .
(3)
.
(3)
З рівняння (3) знаходимо еквівалентну масу оксиду металу mE(MeO):
![]()
![]()
Згідно
з законом еквівалентів
![]() .
Звідси
.
Звідси
![]() .
Мольну масу металу визначають за
співвідношенням
.
Мольну масу металу визначають за
співвідношенням
mE=A/B,
де mE – еквівалентна маса;
A — мольна маса металу;
B – стехиометрична валентність елемента;
А = mе·B = 27,45·2 =54,9 г/моль.
Оскільки атомна маса в а.о.м. чисельно дорівнює мольній (молярній) масі, яка виражається в г/моль, то атомна маса металу, яку шукаємо, 54,9 а.о.м.
Приклад 4. Скільки металу, еквівалентна маса якого 12,16 г/моль, взаємодіє з 310 см3 кисню (н.у.)?
Розв’язання. Так як мольна (молярна) маса О2 (32 г/моль) за н.у. займає об’єм 22,4л, то об’єм еквівалентної маси кисню (8 г/моль) буде 22,4:4 = = 5,6 л. =5600 см3. За законом еквівалентів
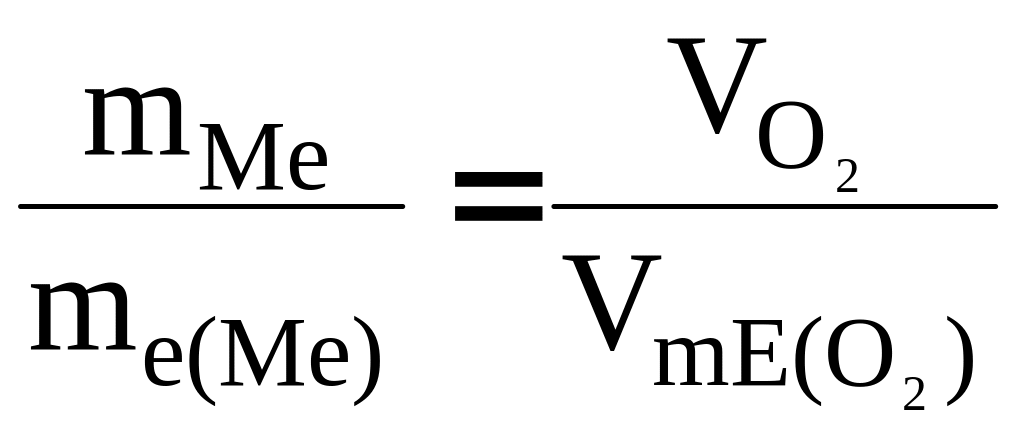
або
![]() ,
,
звідки mме = 12,16·310/5600 =0,673 г.
Приклад 5. Обчисліть еквіваленти й еквівалентні маси H2SO4 і Аl(OН)з у реакціях, виражених рівнянням:
H2SO4+КOН = KHSO4 + Н2О, (1)
H2SO4 + Mg = MgSO4 + Н2 , (2)
Al(OH)3+ HCl = Al(OH)2Cl+ H2O, (3)
Аl(ОН)3+ З НNО3 = Аl(N03)з+ З Н2О. (4)
Розв’язання.
Еквівалент (еквівалентна маса) складної
речовини, як і еквівалент (еквівалентна
маса) елемента, може мати різні значення
і залежить від того, у яку реакцію обміну
вступає ця речовина. Еквівалентна маса
кислоти (основи) дорівнює мольній масі
(М), поділеній на число атомів водню,
заміщених у даній реакції на метал (на
число гідроксильних груп, що вступають
у реакцію,). Отже, еквівалентна маса
H2SO4
у реакції (1)
![]() =
98 г/моль, а в реакції (2)
=
98 г/моль, а в реакції (2)
![]() /2
=49 г/моль. Еквівалентна маса АІ(ОН)з
у реакції (3) МАl(ОН)3
= 78 г/моль, а в реакції (4)МАl(ОН)3/3
=26 г/моль.
/2
=49 г/моль. Еквівалентна маса АІ(ОН)з
у реакції (3) МАl(ОН)3
= 78 г/моль, а в реакції (4)МАl(ОН)3/3
=26 г/моль.
Задачу можна розв’язати й іншим способом. Так як H2SO4 взаємодіє з однією еквівалентною масою КОН і двома еквівалентними масами магнію, то її еквівалентна маса дорівнює в реакції (1) М/1 г/моль і в реакції (2) M/2 г/моль. Аl(ОН)з взаємодіє з однією еквівалентною масою HCI і трьома еквівалентними масами HN03, тому його еквівалентна маса в реакції (3)дорівнює М/1 г/моль, у реакції (4) М/3 г/моль. Еквіваленти H2SO4 у рівняннях (1) і (2) відповідно рівні 1 моль і 1/2 моль; еквіваленти Аl(ОН)3 у рівняннях (3) і (4) відповідно рівні 1 моль і 1/3 моль.
Приклад 6. Із 3,85 г нітрату металу отримали 1,60 г його гідроксиду. Обчислити еквівалентну масу металу (me(Ме))
Розв’язання. При розв’язанні задачі варто мати на увазі: а) еквівалент (еквівалентна маса) гідроксиду дорівнює сумі еквівалентів (еквівалентних мас) металу і гідроксильної групи; б) еквівалент (еквівалентна маса) солі дорівнює сумі еквівалентів (еквівалентних мас) металу і кислотного залишку. Узагалі еквівалент (еквівалентна маса) хімічної сполуки дорівнює сумі еквівалентів (еквівалентних мас) складових її частин.
З огляду на сказане, підставляємо відповідні дані в рівняння (1) прикладу 3:
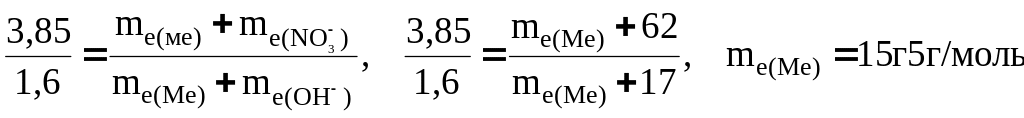 .
.
Приклад 7. У якій масі Са(ОН)2 міститься стільки ж еквівалентів, скільки в 312 г Аl(ОН)3?
Розв’язання. Еквівалентна маса Аl(ОН)з дорівнює 1/3 його мольної маси, тобто 78/3 = 26 г/моль. Отже, у 312 г Аl(ОН)3 міститься 312/26 = 12 еквівалентів. Еквівалентна маса Са(ОН)2 дорівнює 1/2 його мольної маси, тобто 37 г/моль. Звідси 12 еквівалентів складають 37 г/моль 12 моль=444 г.
Приклад 8. Обчислити абсолютну масу молекули сірчаної кислоти в грамах.
Розв’язання. Моль будь-якої речовини (див. приклад 1) містить постійну Авогадро NА структурних одиниць (у нашому прикладі молекул). Мольна маса H2SO4 дорівнює 98,0 г/моль. Отже, маса однієї молекули 98/ (6,02·1023) =1,63·10-22 г.
