
Зміст
Теоретичні основи аналітичної хімії
Якісний аналіз
Катіони I аналітичної групи
Катіони II аналітичної групи
Катіони III аналітичної групи
Катіони IV аналітичної групи
Катіони V аналітичної групи
Катіони VI аналітичної групи
Аніони I аналітичної групи
Аніони II аналітичної групи
Аніони III аналітичної групи
Аніони органічних кислот
Теоретичні основи аналітичної хімії
База 2007-2011рр
1. При виборі окисно-відновної реакції для потреб аналізу треба передбачити повноту та напрямок її проходження, що визначається:
A. *Різницею стандартних електродних потенціалів учасників реакції
B. Величиною водневого показника системи
C. Величиною стандартного електродного потенціалу окисника
D. Величиною стандартного електродного потенціалу відновника
E. Величиною стрибка потенціалу в ході оксидаційно-відновної реакції
2. При проведенні аналітичних реакцій широко застосовуються буферні суміші. При яких умовах буферна ємність розчину є максимальною?
A. *Співвідношення компонентів буферної суміші є еквімолярним
B. Концентрація компонентів буферної суміші є 1 М
C. При додаванні 100 мл 1 М розчину кислоти
D. При додаванні 100 мл 1 М розчину лугу
E. Загальний об’єм буферної суміші рівний 1 л
3. Для виготовлення та аналізу лікарських препаратів широко застосовуються буферні розчини. Буферні розчини використовують для:
A. *Підтримки певного значення величини рН розчину
B. Зміни величини рН розчину
C. Зміни константи іонізації речовини
D. Зміни іонної сили розчину
E. Зміни добутку розчинності речовини
4.
Якій солі відповідає вираз для константи
гідролізу
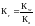
A. *NaCN
B. CH3COONH4
C. Na2SO4
D. (NH4)2SO4
E. (NH4)3PO4
5. Вам необхідно приготувати аміачний буферний розчин. Для цього Ви до водного розчину аміаку додаєте:
A. *Розчин амонію хлориду
B. Розчин хлоридної кислоти
C. Розчин сульфатної кислоти
D. Розчин калію хлориду
E. Розчин амонію сульфату
6. Який спосіб вираження концентрації застосовується у рівнянні добутку розчинності?
A. *Молярна концентрація
B. Масова частка (%)
C. Молярна концентрація еквівалента
D. Молярна частка
E. Моляльна концентрація
7. У фармацевтичній практиці широко використовується ізотонічний розчин натрій хлориду. Яку масу натрій хлориду потрібно взяти для приготування100 г ізотонічного розчину:
A. *0,85
B. 8,5 г
C. 5,0 г
D. 0,45 г
E. 4,5 г
8. Для приготування 50 г 10 % гіпертонічного розчину натрію хлориду необхідно:
A. *5 г NaCl
B. 25 г NaCl
C. 0,5 г NaCl
D. 1 г NaCl
E. 50 г NaCl
9. Для приготування 1 л 0,1 М розчину сульфатної кислоти (М(H2SO4) = 98 г/моль) необхідно взяти:
A. *9,8 г H2SO4
B. 98 г H2SO4
C. 980 г H2SO4
D. 49 г H2SO4
E. 0,098 г H2SO4
10. Розчинність осадів важкорозчинних електролітів зростає при:
A. *Підвищенні іонної сили розчину і протіканні конкуруючих реакцій
B. При підкисленні розчинів і зростанні іонної сили розчину
C. При пониженні концентрації одноіменних з осадом іонів та зниженні іонної сили розчину
D. При протіканні реакцій комплексоутворення
E. При дуже високих концентраціях сторонніх електролітів
11. Як можна підвищити термодинамічну стійкість комплексної сполуки:
A. *Введенням надлишку лігандів і застосування водно-органічних середовищ з певним значенням кислотності
B. Збільшенням концентрації комплексної сполуки в досліджуваних системах
C. Регулюванням рН розчину і додаванням надлишку реагенту
D. Використанням екстракції з водних розчинів в органічні розчинники
E. Її не можна змінити, оскільки вона визначається природою комплексоутворювача і лігандів
12. Для підвищення сили кислоти необхідно застосовувати:
A. *Розчинники з основними (протонно-акцепторними) властивостями
B. Кислотні розчинники (з протонно-донорними властивостями)
C. Нівелюючі розчинники
D. Диференціюючі розчинники
E. Малополярні розчинники
13. Напрям протікання окиснювально-відновних процесів визначається:
A. *Реальними (формальними) потенціалами окиснювально-відновних пар
B. Стандартними електродними потенціалами окиснювально-відновних пар
C. Термодинамічною константою рівноваги окиснювально-відновних реакцій
D. Перебігом конкуруючих реакцій з учасниками окиснювально-відновного процесу
E. Природою окиснювально-відновних пар
14. Стійкість комплексних сполук обумовлена наявністю в них особливого хімічного зв'язку, а саме:
A. *Донорно-акцепторного
B. Іонного
C. Водневого
D. Ковалентного полярного
E. Сил Ван-дер-Ваальса
15. Знайти правильне продовження речення: «Додавання натрій ацетату до розчину ацетатної кислоти...».
A. *Викликає зменшення ступеня дисоціації кислоти
B. Викликає збільшення ступеня дисоціації кислоти
C. Викликає збільшення ступеня дисоціації кислоти
D. Призводить до зростання ступеня дисоціації солі
E. Призводить до зменшення ступеня дисоціації солі
16. Дисоціацію малорозчинних речовин (типу AgCl чи BaSO4) характеризують з допомогою спеціальної константи, що називається:
A. *Добутком розчинності
B. Константою Больцмана
C. Ступенем іонізації
D. Йонним добутком
E. Постійною Планка
17. Розчинники, які використовують в аналітичній хімії, класифікують за їх здатністю приєднувати або відщеплювати протони. Вкажіть, до яких розчинників відносяться спирти:
А.*Амфіпротні
B. Протогенні і амфіпротні
C. Апротонні
D. Протофільні
E. Протогенні
18. Для приготування 500 г 10% розчину натрію гідроксиду останнього необхідно взяти:
A. *50 г
B. 5 г
C. 25 г
D. 0,5 г
E. 10 г
19. Як зменшити розчинність осаду?
A. *Застосувати надлишок осадника
B. Ввести у розчин сторонні іони
C. Нагріти розчин
D. Ввести окисник
E. Ввести комплексоутворювач
20. Характеристикою термодинамічного стану системи осад–насичений розчин є:
A. *Добуток розчинності
B. Іонний добуток
C. Константа стійкості
D. Іонна силу розчину
E. Константа дисоціації
21. Напрямок проходження оксидаційно-відновної реакції визначається:
A. *Різницею стандартних електродних потенціалів учасників реакції
B. Величиною стандартних електродних потенціалів учасників реакції
C. Величиною стрибка потенціалу в ході оксидаційно-відновної реакції
D. Величиною водневого показника системи
E. Температурою системи
22. Згідно теорії електролітичної дисоціації усі електроліти поділяються на сильні та слабкі. Слабким електролітом називається хімічна сполука, яка має:
A. *Малу константу іонізації
B. Низький ступінь окислення
C. Малу величину константи нестійкості
D. Низьке значення оптичної густини
E. Незначний добуток розчинності
23. Яким є процес дисоціації потужного електроліту і чи можна до нього застосувати закон дії мас?
A. *Зворотним, і до нього можна застосувати закон дії мас
B. Незворотним, і до нього не можна застосувати закон дії мас
C. Зворотним, і до нього не можна застосувати закон дії мас
D. Незворотним, і до нього можна застосувати закон дії мас
E. Не можна застосувати закон дії мас
24. Як називається співвідношення активної концентрації іонів до їх загальної аналітичної концентрації?
A. *Коефіцієнтом активності
B. Активністю
C. Іонною силою розчину
D. Константою дисоціації
E. Ступенем дисоціації
25. Для підтримки певного значення рН середовища використовують буферні розчини. Укажіть суміш речовин, яка не є буферною:
A. *NaOH+NaCI
B. CH3COOH+CH3COONa
C. NH4CI+NH3·H2O
D. НCOОН+НCOОNа
E. NaH2PO4+Na2HPO4
26. Як перебігає процес дисоціації комплексних іонів?
A. *Зворотно, за типом слабких електролітів
B. Зворотно, за типом сильних електролітів
C. Необоротно, за типом слабких електролітів
D. Необоротно, за типом сильних електролітів
E. Дисоціює, за типом слабких та сильних електролітів
27. В аналізі широко застосовують буферні розчини для:
A. *Забезпечення певного значення рН середовища
B. Забарвлення розчинів
C. Утворення комплексних сполук
D. Досягнення повноти осадження аналітичної групи катіонів
E. Маскування іонів
28. На розчинність важкорозчинних солей, утворених катіонами металів, які легко утворюють аміакати найбільший вплив має:
A. *Концентрація молекул аміаку
B. Концентрація іонів амонію
C. Концентрація амінів
D. Концентрація іонів гідрогену
E. Концентрація амідів
29. Деякі окислювально–відновні реакції супроводжуються перебігом побічних індукованих (спряжених) реакцій, в яких одна реакція перебігає самовільно, а друга тільки при проходженні першої. Яку назву має речовина, яка приймає участь в обох реакціях?
A. *Актор
B. Індуктор
C. Акцептор
D. Каталізатор
E. Індикатор
30. Для підтримання сталого pH у розчинах досліджуваних сполук застосовують буферні суміші. Яка з наведених сумішей є буферною?
A. *NH4Cl + NH4OH
B. HCl + NaOH
C. NH4Cl +HCl
D. NaCl+NaOH
E. H2SO4 + CH3COOH
31. В аналізі часто застосовують водні розчини солей, що гідролізують і викликають зміну рН середовища. Яке рН середовища у водному розчині натрію карбонату?
A. *Слаболужне
B. Кисле
C. Сильнолужне
D. Нейтральне
E. Слабокисле
32. Вказані препарати можуть використовуватися для корекції кислотно-основної та іонної рівноваги. При однаковій молярній концентрації максимальною величиною іонної сили характеризується розчин:
A. *Кальцію хлориду
B. Калію йодиду
C. Калію хлориду
D. Натрію фториду
E. Натрію йодиду
33. Знайти титр розчину, на приготування 1 дм3 якого взято 5,2 г K2Cr2O7
A. *5,194·10-3
B. 6,121·10-3
C. 4,858·10-3
D. 4,622·10-3
E. 5,851·10-3
34. Яку наважку (в г) H2C2O4·2H2O треба взяти для приготування 25 см3 0,05н розчину?
A. *7,87·10-2
B. 7,65·10-2
C. 8,24·10-2
D. 6,55·10-2
E. 5,47·10-2
35. Скільки см3 2н розчину NaOH потрібно для нейтралізації розчину, що містить 2,45 г H2SO4?
A. *25
B. 20
C. 15
D. 30
E. 35
36. Визначити ступінь дисоціації (в %) 0,4М розчину НСООН (Кдис.=1,77·10-4)
A. *2,1
B. 3,2
C. 4,3
D. 1,6
E. 5,2
37. Добуток розчинності малорозчинних електролітів залежить від:
A. *Температури
B. Молярної концентрації йонів
C. Концентрації солі
D. Моляльної концентрації солі
E. Наявності каталізатора
38. Укажіть, яку величину використовують для характеристики окисно – відновної здатності речовин:
A. *Величину редокс – потенціалів
B. Величину електронегативності елементів
C. Число прийнятих чи відданих електронів
D. Величину ступеня окиснення
E. Число іонів гідрогену, що беруть участь в реакції
39. Укажіть, яка окисно-відновна пара містить найбільш сильний відновник?
A. *Sn4+/Sn2+ E0 = – 0,15 В
B. Fe3+/Fe2+ E0 = + 0,77 В
C. I2/2I– E0 = + 0,54 В
D. S4O62–/2S2O32– E0 = + 0,09 В
E. VO2+/VO2+ E0 = + 0,99 В
40. Укажіть, яка окисно-відновна пара містить найбільш сильний окисник?
A. *MnO4–/Mn2+ E0 = + 1,51 В
B. Cr2O72–/2Cr3+ E0 = + 1,33 В
C. Cl2/Cl– E0 = + 1,36 В
D. MnO4–/MnO2 E0 = + 0,60 В
E. MnO4–/MnO42– E0 = + 0,56 В
41. Укажіть у якому із розчинів алюмінію хлориду: 0,1моль/л і 1 моль/л гідроліз перебігає глибше:
A. *З концентрацією солі 0,1 М
B. Не залежить від концентрації солі
C. Гідроліз пройде з однаковою глибиною (ступенем)
D. З концентрацією солі 1М
E. Розчин солі алюмінію хлориду не гідролізує
42. Щоб запобігти гідролізу сульфіту натрію до його розчину необхідно додати:
A. *Невелику кількість розведеного розчину лугу
B. Кристалічного натрію сульфіту
C. Дистильовану воду, щоб зменшити початкову концентрацію солі
D. Розчин натрію хлориду
E. Підкислити розчин невеликою кількістю будь-якої мінеральної кислоти
43. Користуючись таблицею добутку розчинності, визначте, яким із реагентів можна повніше осадити іони срібла із розчину нітрату срібла?
A. *Сульфідом натрію
B. Хроматом натрію
C. Оксалатом амонію
D. Сульфітом натрію
E. Сульфатом натрію
44. В насиченому розчині стронцій фосфату рівноважні концентрації іонів Sr2+ i PO43- зв’язані з реальним добутком розчинності цієї солі співвідношенням:
A. *[Sr2+]3[PO43-]2 = ДР
B. [Sr2+]3[PO43-] = ДР
C. [Sr2+]2[PO43-]2 = ДР
D. [Sr2+]3[PO43-] = ДР
E. [Sr2+][PO43-]2 = ДР
45. Висновок про можливість та напрямок протікання окиснювально-відновних процесів можна зробити на підставі:
A. *Стандартних електродних потенціалів окиснювально-відновних пар
B. Концентрації реагуючих речовин
C. Термодинамічних констант рівноваги окиснювально-відновних реакцій
D. Перебігу конкуруючих реакцій з учасниками окиснювально-відновного процесу
E. Природи окиснювально-відновних пар
46. Процес екстракції характеризується константою розподілу та коефіцієнтом розподілу. За якої умови константа розподілу буде чисельно дорівнювати коефіцієнту розподілу?
A. *Речовина перебуває в однаковій хімічній формі в обох фазах
B. Співвідношення об’ємів органічної і водної фази дорівнює одиниці
C. Система перебуває в стані рівноваги при певній температурі і однаковій аналітичній концентрації речовини
D. Екстрагент змішується з водою
E. Співвідношення об’ємів органічної і водної фази дорівнює одиниці і аналітична концентрація речовини є однаковою
47. Вкажіть найефективніший спосіб очищення осаду від домішок:
A. *Переосадження
B. Перемішування, охолоджування
C. Осадження з гарячих розчинів
D. Повільне осадження
E. Прожарення
48. В аналізі та при виробництві ліків широко застосовується рівноважна екстракція. Кількісною характеристикою процесу екстракції є:
A. *Константа розподілу
B. Константа дисоціації
C. Константа солюбілізації
D. Константа гідролізу
E. Константа стійкості
База 2012-2014рр
1. Кількісною характеристикою розчинності малорозчинних електролітів (типу AgCl або BaSO4) є константа, яка називається:
A. *Добутком розчинності
B. Константою нестійкості
C. Константою іонізації
D. Константою стійкості
E. Константою кислотності
Якісний аналіз
База 2007-2011рр
1. Укажіть чим характеризується здатність реагенту давати добре фіксований аналітичний ефект при взаємодії з досліджуваною речовиною?
A. *Чутливістю реакції
B. Вибірністю реакції
C. Специфічністю реакції
D. Селективністю реакції
E. Кількістю реагенту
2. Що є мірою специфічності аналітичних реакцій?
A. *Граничне співвідношення концентрацій іонів, як тих, що визначаються, так і сторонніх
B. Гранична концентрація іона , який визначається
C. Граничні співвідношення концентрацій сторонніх іонів
D. Чутливість аналітичних реакції
E. Концентрація сторонніх іонів
3. Як називаються реакції і реагенти, які дають можливість визначити даний іон в присутності інших:
A. *Специфічні
B. Селективні
C. Групові
D. Вибіркові
E. Загальні
4. При проведенні контролю якості лікарських засобів застосовуються аналітичні реакції. Хімічна реакція може бути використана як аналітична у тому випадку, коли вона:
A. *Проходить із видимими змінами у реакційній системі
B. Проходить з виділенням тепла
C. Відбувається із утворенням гетерофази
D. Є оборотною
E. Проходить повільно
5. Виявлення досліджуваних іонів за допомогою дробного методу аналізу вимагає виконання наступних аналітичних операцій:
A. *Використання специфічного реактиву
B. Концентрування досліджуваного розчину
C. Застосування групового реактиву
D. Застосування високочутливого реактиву
E. Застосування маскуючого реактиву
6. Поділ іонів (катіонів/аніонів) на аналітичні групи проводиться відповідно до:
A. *Хімічних властивостей їх сполук із певними реактивами
D. Положення елементів у періодичній системі
C. Розчинності їх сполук у воді
D. Оксидаційно-відновних властивостей цих іонів
E. Фізичних властивостей їх сполук
7. Як називається в аналізі прийом зв’язування сторонніх іонів?
A. *Аналітичним “маскуванням”
B. Аналітичним розділенням
C. Аналітичним вилученням
D. Аналітичним концентруванням
E. Аналітичним співосадженням
8. В дробному ході аналізу іони різних аналітичних груп виявляють:
A. *В окремих порціях розчину в будь-якій послідовності
B. При строгій послідовності операцій з виявлення
C. Після розділення іонів на аналітичні групи
9. Аналіз невідомої суміші слід починати з
A. *Виявлення катіонів
B. Виявлення аніонів мінеральних кислот
C. Виявлення аніонів органічних кислот
D. Виявлення осадів
E. Вимірювання маси
10. Чутливість аналітичних реакцій визначає можливість виявлення речовин у розчині. Чутливість реакції характеризують усі перелічені нижче величини крім:
A. *Мінімальний об’єм реагенту
B. Гранична концентрація
C. Граничне розведення
D. Границя виявлення
E. Мінімальний об’єм
11. Для ідентифікації компонентів в суміші, застосовують хімічні аналітичні реакції. Яким вимогам вони повинні відповідати?
A. *Бути специфічними, характерними, чутливими
B. Бути широкого спектру дії
C. Бути селективними
D. Проходити повільно
E. Бути незворотними
Катіони I аналітичної групи
База 2007-2011рр
1. Який аналітичний ефект спостерігається під час визначення катіону калію розчином натрій гексанітрокобальтату (ІІІ)?
A. *Жовтий кристалічний осад
B. Білий осад
C. Жовте забарвлення розчину
D. Чорний кристалічний осад
E. Червоний кристалічний осад
2. На аналіз поступила безбарвна кристалічна речовина, яка добре розчинна у воді. При проведенні проб з груповими реагентами (2н HCl, 2н H2SO4, 2н NaOH, концентрованим NH4OH) всі реакції дали негативний результат. Проба з реактивом Неслера також дала негативний результат. При додаванні до розчину гексанітрокобальтату (ІІІ) натрію утворився жовтий кристалічний осад, що свідчить про наявність в розчині:
A. *Катіонів калію
B. Катіонів амонію
C. Катіонів натрію
D. Катіонів літію
E. Катіонів магнію
3. Для зв'язування іонів водню при ідентифікації іонів калію з винною кислотою використовують розчин:
A. *Ацетату натрію
B. Гідроксиду натрію
C. Аміаку
D. Сірчаної кислоти
E. Соляної кислоти
4. Яка пара йонів не заважає один одному при виявленні?
A. *K+, Na+
B. NH4+, K+
C. NH4+, Na+
D. Li+, NH4+
E. Такої пари для І аналітичної групи немає
5. Який катіон знаходиться в розчині, якщо при нагріванні з лугом виділяється газ з різким запахом:
А.*Амонію
B. Свинцю (ІІ)
C. Ртуті (І)
D. Срібла
E. Ртуті (ІІ)
6. В лабораторії необхідно ідентифікувати катіон амонію. Можна використати розчин:
A. *Реактиву Несслера
B. Калію хромату
C. Цинку уранілацетату
D. Реактиву Чугаєва
E. Натрію сульфату
7. Яка із вказаних реакцій визначення катіонів амонію є специфічною?
A. *Реакція з гідроксидами лужних металів при нагріванні
B. Реакція з калію гексагідроксоcтибатом
C. Реакція з натрію гексанітрокобальтатом(III)
D. Реакція з калію тетрайодгідраргіратом (II) у лужному середовищі
E. Реакція з натрію гексанітрокобальтатом(III) у кислому середовищі
8. При проведенні аналізу сумішей катіонів за систематичним ходом необхідно відділити катіони першої аналітичної групи. Груповим реактивом для іонів першої аналітичної групи є:
A. *Жоден з цих реактивів
B. Гідроксид натрію
C. Гідроксид амонію
D. Хлоридна кислота
E. Сульфатна кислота
9. Аналізуючий розчин містить катіони калію і натрію. Вкажіть реагент, який дозволяє виявити в цій суміші катіони калію:
A. *Кислота винна
B. Кислота щавлева
C. Кислота оцтова
D. Кислота бензойна
10. При дії на аналізований розчин лугом при нагріванні виділяється газ, що змінює забарвлення червоного вологого лакмусового паперу на синє. Це свідчить про присутність в розчині:
A. *Іонів амонію
B. Карбонат-іонів
C. Іонів свинцю
D. Іонів вісмуту
E. Хлорид-іонів
11. Досліджуваний розчин містить катіони амонію і натрію. Вкажіть реагент, який дозволяє виявити в цьому розчині катіони натрію.
A. *Цинкуранілацетат
B. Калію оксалат
C. Калію тетрайодомеркурат (ІІ)
D. Калію гідротартрат
E. Калію бензоат
12. В фармакопейному аналізі для ідентифікації іонів натрію використовують реакцію з:
A. *2-метоксі-2-фенілоцетовою кислотою
B. 8-оксихіноліном
C. Дифеніламіном
D. Діацетилдіоксимом
E. Тетрафенілборатом
13. Яким аналітичним ефектом супроводжується реакція виявлення катіонів калію при дії натрію гідротартрату?
A .*Білий кристалічний осад
B. Жовте забарвлення розчину
C. Білий аморфний осад
D. Бурий осад
E. Жовтий осад
14. Яка з названих реакцій виявлення катіону амонію є надчутливою?
A. *Реакція з лугом під час нагрівання у газовій камері
B. Реакція з дигідроантимонатом калію
C. Реакція з гексанітрокобальтом (III) натрію
D. Реакція з тетрайодомеркуратом (ІІ) калію у лужному середовищі
E. Реакція з гексанітрокобальтом (ІІІ) натрію у кислому середовищі
15. В якому розчині присутні катіони лише I аналітичної групи?
A. *Na+,,K+, NH4+
B. Na+, Fe2+, Fe3+
C. NH4+, Cu2+, Hg22+
D. K+, Ag+, Al3+
E. K+, NH4+, Zn2+
16. Чому катіони І аналітичної групи не мають групового реагенту?
A. *Більшість їх солей розчинні у воді
B. Мають близькі іонні радіуси
C. Мають великі іонні радіуси
D. Мають здатність утворювати розчинні основи
E. Належать до біологічно важливих елементів
17. Досліджуваний розчин містить катіони калію і амонію. Вкажіть реагент, який дозволяє виявити в цьому розчині катіони амонію.
A. *Калію тетрайодомеркурат (ІІ)
B. Натрію гідротартрат
C. Натрію ацетат
D. Калію гексаціаноферат(ІІ)
E. Цинкуранілацетат
18. Для виявлення катіону амонію до проби додали реактив калію тетрайодомеркурату (ІІ). Якого кольору утвориться осад при наявності катіону амонію?
A. *Цегляно-червоного
B. Білого
C. Чорного
D. Жовтого
E. Коричневого
19. Необхідно провести ідентифікацію суміші, що містить катіони І аналітичної групи (Li+, Na+, K+, NH4+). Який з цих катіонів виявляють реактивом Неслера?
A. *Амоній
B. Натрій
C. Літій
D. Калій
E. Усі зазначені катіони
20. Сухий залишок, одержаний після випарювання розчину, що аналізується, забарвлює безбарвне полум’я пальника в жовтий колір, а при розгляді через синє скло – у фіолетовий. Які катіони знаходились в сухому залишку?
A. *Na+, K+
B. Ca2+, K+
C. Na+, Sr2+
D. Li+, Ba2+
E. Na+, Ca2+
21. Провізор-аналітик проводить ідентифікацію калію ацетату. За допомогою якого реактиву він підтверджує наявність калію в досліджуваній речовині?
A. *Розчин тартратної кислоти
B. Розчин калію перманганату
C. Розчин заліза (ІІІ) хлориду
D. Розчин натрію гідроксиду
E. Розчин форміатної кислоти
База 2012-2014рр
1. До I аналітичної групи катіонів за кислотно-основною класифікацією належать такі катіони:
A. *Натрію, калію, амонію
B. Кальцію, стронцію, барію
C. Аргентуму, плюмбуму, ніколу
D. Алюмінію, магнію, цинку
E. Калію, барію, бісмуту
2. Один із катіонів першої групи заважає виявленню інших. Тому його слід виявити першим і видалити. Який це катіон?
A. *NH4+
B. Ca2+
C. Na+
D. Li+
E. K+
3. При проведенні реакції іонів натрію с гексагідроксоантимонатом(V) калію в нейтральному середовищі утворюється осад. Вкажіть, якого кольору вказаний осад.
A. *Білий
B. Червоний
C. Жовтий
D. Зелений
E. Блакитний
4. Специфічною реакцією на іон амонію в якісному аналізі є дія:
A. *Розчину лугу при нагріванні
B. Реактиву Неслера
C. Розчину натрій гексанітрокобальтату
D. Розчину натрій гідротартрату
E. Розчину калій гексагідроксостибату
5. Для виявлення іонів амонію у розчині, який містить іони калію, натрію, плюмбуму і аргентуму слід використати реакцію з розчином:
A. *Лугу при нагріванні
B. Натрій гексанітрокобальтату (ІІІ)
C. Калій гексагідроксостибату (V)
D. Натрій метоксифенілацетату при охолодженні
E. Калій перманганату у кислому середовищі
6. Хімік-аналітик проводить якісний систематичний аналіз суміші катіонів першої аналітичної групи. Який катіон визначають на початку дослідження специфічною реакцією?
A. *Амонію
B. Калію
C. Натрію
D. Літію
E. Аргентуму
Катіони II аналітичної групи
База 2007-2011рр
1. На чому ґрунтується розділення аргентум хлориду від гідраргірум (І) хлориду:
A. *На різній розчинності у розчині амоніаку
B. На різній розчинності у соляній кислоті
C. На різній розчинності у лугах
D. На різній розчинності у гарячій воді
E. На різній розчинності у сірчаній кислоті
2. На чому ґрунтується відокремлення плюмбум (ІІ) хлориду від інших хлоридів ІІ аналітичної групи:
A. *На різній розчинності у гарячій воді
B. На різній розчинності у соляній кислоті
C. На різній розчинності у лугах
D. На різній розчинності у розчині аміаку
E. На різній розчинності у сірчаній кислоті
3. До розчину, який містить катіони ІІ аналітичної групи (за кислотно-основною класифікацією) додали невелику кількість концентрованого розчину амоніаку і 3-4 краплі розчину формальдегіду. Пробірку занурили у гарячу воду і на стінках пробірки з’явилась дзеркальна плівка. Наявність якого катіону обумовлює цю реакцію?
A. *Катіон арґентуму
B. Катіон гідраргіруму (І)
C. Катіон плюмбуму
D. Катіон барію
E. Катіон літію
4. При аналізі фармпрепарату необхідно розділити суміш хлоридів катіонів 2 аналітичної групи (аргентум (+1) та меркурій (+1)). Запропонуйте розчин реагенту для такого розділення:
A. *Амоніаку
B. Хлоридної кислоти
C. Сульфатної кислоти
D. Калій гідроксиду
E. Калій карбонату
5. При додаванні розведеного розчину хлороводневої кислоти до розчину, що аналізується, утворився білий сирнистий осад. Про присутність яких іонів це свідчить?
A. *Аргентум
B. Ферум (ІІ)
C. Барій
D. Амоній
E. Йод
6. Для визначення якісного складу препарату на зразок досліджуваного розчину подіяли 2 Н розчином HCl. Випав білий осад, розчинний в водному розчині аміаку. На наявність яких катіонів вказує цей аналітичний ефект:
A. *Аргентуму (І)
B. Плюмбуму (ІІ)
C. Меркурію (І)
D. Меркурію (ІІ)
E. Стануму (ІІ)
7. До досліджуваного розчину додали 2М розчин HCl. При цьому утворився білий осад, який при обробці розчином аміаку почорнів. Який катіон присутній у розчині:
A. *Hg22+
B. Ag+
C. Pb2+
D. Ba2+
E. Mg2+
8. До розчину, якій містить катіони меркурію(I), додали розчин хлоридної кислоти. До утвореного осаду додали розчин аміаку. Вкажіть хімічний склад осаду:
A. *[HgNH2]Cl+Hg
B. Hg2O
C. [HgNH2]Cl
D. Hg(OH)2
9. Відомо, що до складу досліджуваної суміші входять катіони другої аналітичної групи. До другої аналітичної групи належать катіони, які утворюють:
A. *Осади із хлоридною кислотою
B. Осади із нітратною кислотою
C. Осади із гідрофосфатом натрію
D. Осади із нітратом натрію
10. До досліджуваного розчину додали розчин калію йодиду. Випав золотисто-жовтий осад, який розчиняється в гарячій воді, надлишку реагенту і в оцтовій кислоті. Це свідчить про присутність в розчині:
A. *Катіонів плюмбуму
B. Катіонів аргентуму
C. Катіонів бісмуту
D. Катіонів меркурію (ІІ)
E. Катіонів меркурію (І)
11. До досліджуваного розчину додали 1М розчин сірчаної кислоти. Випав осад білого кольору, який розчиняється в лугах. Це свідчить про присутність в розчині:
A. *Катіонів свинцю (ІІ)
B. Катіонів кальцію (ІІ)
C. Катіонів барію (ІІ)
D. Катіонів срібла (І)
E. Катіонів ртуті (І)
12. За кислотно-основною класифікацією катіонів груповими реагентами можуть бути: HCl, H2SO4, NaOH або KOH, розчин NH3. До другої групи катіонів належать катіони Pb2+, Ag+, Hg22+.Вказати груповий реагент для другої групи катіонів.
A. *Розчин HCl
B. Розчин H2SO4
C. Група не має групового реагенту
D. Розчин NaOH
E. Розчин NH3
13. Реакція утворення золотисто-жовтого осаду (реакція «золотого дощу») - це реакція:
A. *Утворення осаду PbІ2
B. Утворення осаду PbCl2
C. Утворення осаду AgІ
D. Утворення осаду HgІ2
E. Утворення осаду Hg2І2
14. В якісному аналізі характерною реакцією на катіони срібла є:
A. *Реакція утворення сирнистого осаду AgCl, що розчиняється в розчині аміаку, який знову утворюється при додаванні НNО3.
B. Реакція утворення сирнистого осаду АgCl, що розчиняється у кислотах
C. Реакція утворення комплексу, який руйнується при дії розчину HNO3
D. Реакція утворення осаду, що розчиняється у розчині лугу
E. Реакція утворення жовтого осаду, що розчиняється у надлишку аміаку.
15. Які катіони містилися в розчині, якщо при додаванні до нього хлорводневої кислоти утворюється осад, після обробки якого розчином аміаку, відбувається часткове розчинення і почорніння нерозчинного осаду?
A. *Срібло і ртуті(I)
B. Срібла і барію
C. Срібла і свинцю
D. Срібло і ртуть(ІІ)
E. Ртуть(ІІ) і ртуть(I)
16. На розчин, отриманий після обробки осаду хлоридів катіонів II групи гарячою водою, подіяли розчином калію дихромату. Утворювався жовтий осад, нерозчинний в оцтовій кислоті, але розчинний у лузі. Які катіони містив досліджуваний розчин?
A. *Свинцю(II)
B. Ртуті(II)
C. Барію
D. Срібла(І)
E. Кальцію
17. Які катіони I-III аналітичних груп знаходяться в досліджуваному розчині, якщо з розчином лугу утворюється осад, розчинний в надлишку лугу?
A. *Свинцю (ІІ)
B. Ртуть(I)
C. Барію
D. Срібло (І)
E. Кальцію
18. До другої групи катіонів належать катіони Pb2+, Ag+, Hg22+. Вказати груповий реагент для другої групи катіонів.
A. *Розчин HCl
B. Розчин H2SO4
C. Група не має групового реагенту
D. Розчин NaOH
E. Розчин NH3
19. При визначенні одного з катіонів ІІ аналітичної групи використовують реакцію «золотого дощу». Продуктом цієї реакції є:
A. *Утворення осаду PbІ2
B. Утворення осаду PbCl2
C. Утворення осаду AgІ
D. Утворення осаду HgІ2
E. Утворення осаду Hg2І2
20. При додаванні до досліджуваного розчину лугу випав чорний осад, а при нагріванні утворився газ з різким запахом. Вкажіть яка пара катіонів знаходиться в розчині:
A. *Ртуті(I) і амонію
B. Натрію і амонію
C. Ртуті(I) і ртуті(II)
D. Калію і амонію
E. Свинцю і амонію
21. При дії групового реагенту на катіони ІІ аналітичної групи утворюється осад PbCl2, який розчиняється у:
A. *Гарячій воді
B. 0,2М розчин натрію карбонату
C. 2М розчині сульфатної кислоти
D. Етанолі
E. Насиченому розчині натрію карбонату
