
- •Загальні положення
- •Лабораторна робота №1 Тема: Будова прокаріотичної та еукаріотичної клітини
- •Відмінності у будові прокаріотичних та еукаріотичних клітин.
- •План роботи
- •Лабораторна робота № 2 Тема: Мікрохімічні реакції на кутин, лігнін, дубильні і пектинові речовини
- •Лабораторна робота №3 Тема: Мікрохімічні реакції на білки, жири і вуглеводи
- •План роботи
- •Лабораторна робота №4 Тема: Особливості будови клітин гідрофітів - з плаваючими листками (вільношіаваючі та прикріплені рослини)
- •План роботи
- •Лабораторна робота №5 Тема: Особливості будови клітин гідрофітів - рослин повністю занурених у воду
- •План роботи
- •Лабораторна робота №6 Тема: Визначення мітотичної активності рослинних тканин та відносної тривалості кожної з фаз мітотичного циклу
- •План роботи
- •Лабораторна робота № 7 Тема: Зміни якісного складу пластидних пігментів при старінні листка
- •Лабораторна робота № 8 Тема: Фотосенсибілізуюча дія хлорофілу
- •План роботи
- •Лабораторна робота № 9 Тема: Вивчення явищ плазмолізу та деплазмолізу в рослинних клітинах
- •План роботи
- •Лабораторна робота № 10 Тема: Визначення спектру поглинання пігментів листка
- •План роботи
- •Висновки: Лабораторна робота № 11 Тема: Вивчення проникності мембран
- •План роботи
- •Лабораторна робота № 12 Тема: Запасні поживні речовини рослинної клітини
- •План роботи
- •Лабораторна робота № 13 Тема: Будова клітинних пластид.
- •План роботи
- •Лабораторна робота № 14 Тема: Кількісне визначення хлорофілу
- •План роботи
- •Лабораторна робота № 15 Тема: Рух цитоплазми в клітинах елодеї і валіснерії
План роботи
1. У дві пробірки налити по 3-4 мл спиртової витяжки хлорофілу. В розчин всипати аскорбінову кислоту і розчинити до повного насичення. При цьому надлишок осідає на дно.
2. У кожну з пробірок додати по 1 мл метилового червоного, при цьому зелене забарвлення у пробірках зміниться на червоне.
3. Замінити 1 М розчин сахарози під покривним скельцем на воду аналогічно попередньому досліду. Вивчити за допомогою мікроскопу процес відкривання продихових щілин.
4. Суміші у пробірках збовтати. Першу пробірку виставити на інтенсивне світло,а другу накрити чохлом із чорного паперу. В третю пробірку, яка являється контролем налити 3-4 мл спирту, додати аскорбінову кислоту,метиловий червоний та також виставити на світло.
5. Через 15-20 хвилин забарвлення розчинів у пробірках порівняти. Результати досліджень занести до таблиці. Зробити висновки.
Варіант |
Склад реакційної суміші |
Умови досліду |
Зміна забарвлення розчину |
1 |
Розчин хлорофілу + аскорбінова кислота + метиловий червоний |
Світло |
|
2 |
Розчин хлорофілу + аскорбінова кислота + метиловий червоний |
Темрява |
|
Контроль |
Спирт + аскорбінова кислота + метиловий червоний |
Світло |
|
Висновки:
Лабораторна робота № 9 Тема: Вивчення явищ плазмолізу та деплазмолізу в рослинних клітинах
Мета роботи: Визначити умови проходження явища плазмолізу та деплазмолізу в рослинних клітинах
Матеріали: рослинні об’єкти.
Прилади: мікроскопи, препарувальні голки, скальпелі, пінцети, піпетки, фільтрувальний папір, склянки з водою, предметні та покривні скельця, скляні палички, розчин плазмолітиків.
П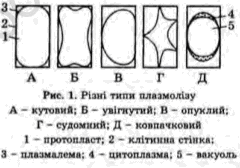 лазмоліз
–
процес відокремлення протопласта від
оболонки рослинної клітини. Причина
плазмолізу – втрата внутрішньоклітинної
води під дією гіпертонічних розчинів
чи плазмолітиків, концентрація, яких
більна ніж вакуолярного соку. За формою
розрізняють кутовий, увігнутий, опуклий,
спазматичний та ковпачків плазмоліз.
лазмоліз
–
процес відокремлення протопласта від
оболонки рослинної клітини. Причина
плазмолізу – втрата внутрішньоклітинної
води під дією гіпертонічних розчинів
чи плазмолітиків, концентрація, яких
більна ніж вакуолярного соку. За формою
розрізняють кутовий, увігнутий, опуклий,
спазматичний та ковпачків плазмоліз.
Деплазмоліз – оборотній процес, який полягає у поверненні клітини до нормального стану.
У зів’ялих рослин явище плазмолізу не відбувається, натомість спостерігається явище циторизу, коли плазма лема не відокремлюється від оболонки і клітина зморщується.
План роботи
1. Розрізати синьо забарвлену цибулю або інший рослинний об’єкт. Відділити шматочок епідермісу розміром 0,5Х0,5 см. Зробити препарат та розглянути його під мікроскопом. Знайти цитоплазму, яка є найбільш інтенсивно забарвлена. Замалювати клітини.
3. З одного боку покривного скла нанести краплину 1 М розчину сахарози або Ca(NO3)2, а з протилежного боку скельця прикласти шматочок фільтрувального паперу і відтягнути воду. Плазмолітик при цьому почне поступово надходити в клітини епідермісу.
4. Відмітити, коли цитоплазма почне відставати від оболонки клітини. Замалювати клітини у стані плазмолізу за малюнком визначити форму плазмолізу та підписати зображення.
5. Біляпокривного скельця нанести декілька крапель води, а з іншого боку відтянути розчин плазмолітика з препарату. Таким чином створити розчин з меншою концентрацією під покривним склом. Клітина при цьому насичується водою, а протопласт притискається до клітинної оболонки в результаті процесу деплазмолізу.
6. Зробити висновки.
Висновки:
