
- •Загальні положення
- •Лабораторна робота №1 Тема: Будова прокаріотичної та еукаріотичної клітини
- •Відмінності у будові прокаріотичних та еукаріотичних клітин.
- •План роботи
- •Лабораторна робота № 2 Тема: Мікрохімічні реакції на кутин, лігнін, дубильні і пектинові речовини
- •Лабораторна робота №3 Тема: Мікрохімічні реакції на білки, жири і вуглеводи
- •План роботи
- •Лабораторна робота №4 Тема: Особливості будови клітин гідрофітів - з плаваючими листками (вільношіаваючі та прикріплені рослини)
- •План роботи
- •Лабораторна робота №5 Тема: Особливості будови клітин гідрофітів - рослин повністю занурених у воду
- •План роботи
- •Лабораторна робота №6 Тема: Визначення мітотичної активності рослинних тканин та відносної тривалості кожної з фаз мітотичного циклу
- •План роботи
- •Лабораторна робота № 7 Тема: Зміни якісного складу пластидних пігментів при старінні листка
- •Лабораторна робота № 8 Тема: Фотосенсибілізуюча дія хлорофілу
- •План роботи
- •Лабораторна робота № 9 Тема: Вивчення явищ плазмолізу та деплазмолізу в рослинних клітинах
- •План роботи
- •Лабораторна робота № 10 Тема: Визначення спектру поглинання пігментів листка
- •План роботи
- •Висновки: Лабораторна робота № 11 Тема: Вивчення проникності мембран
- •План роботи
- •Лабораторна робота № 12 Тема: Запасні поживні речовини рослинної клітини
- •План роботи
- •Лабораторна робота № 13 Тема: Будова клітинних пластид.
- •План роботи
- •Лабораторна робота № 14 Тема: Кількісне визначення хлорофілу
- •План роботи
- •Лабораторна робота № 15 Тема: Рух цитоплазми в клітинах елодеї і валіснерії
План роботи
У фарфоровій ступці розтерти середню пробу листків у кількості 0,2 г з 0,02 г крейди та 5 мл етилового спирту до гомогенної маси.
Отриману масу відфільтрувати через фільтр у мірну пробірку. Витяжки повинно бути не більше 10 мл.
Отриману витяжку розбавити у 5 разів (1 мл витяжки + 4 мл спирту) і проаналізувати за допомогою ФЕК.
Використовуючи показник ФЕК, за калібрувальною кривою визначити концентрацію хлорофілів у розчині (мг/л).
Вміст хлорофілів визначають за формулою:
А =
Де, А- вміст хлорофілів у листках, мг ‰;
а- концентрація хлорофілів у розчині (дані визначені за калібрувальною кривою) мг/л;
в- загальний об’єм витяжки з урахуванням розведення;
с-наважка листків, г.
Приклад. У мірній пробірці отримано 10 мл витяжки пігментів. Витяжку розбавили у 5 разів. Показник ФЕК- 0,340, що за калібрувальною кривою відповідає 7,6 мг/л. Наважка- 0,2 г.
Висновки:
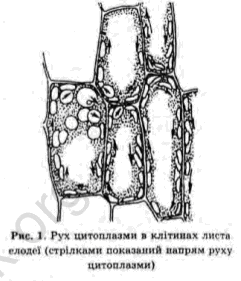
Лабораторна робота № 15 Тема: Рух цитоплазми в клітинах елодеї і валіснерії
Мета роботи: Виявити коловий рух цитоплазми завдяки спостереженням за переміщенням органел у клітині.
Матеріали: рослинні об’єкти (листки елодеї або вальсінерії).
Прилади: мікроскопи,скальпелі, препарувальні голки, предметні та покривні скельця, спирт, скляні палички, склянки з водою, фільтрувальний папір, пінцети.
Цитоплазма – це внутрішній вміст клітини за винятком ядра. Вона складається з гіалоплазми, органоїдів та включень та постійно рухається. Цитоплазма — це напіврідке середовище клітини — колоїд Гіалоплазма — прозорий розчин органічних і неорганічних сполук у воді. Хімічний склад цитоплазми: структурні білки, білки-ферменти, РНК, вуглеводи, жири, вода та неорганічні речовини. Агрегатний стан цитоплазми може бути різним: рідким — золь, в'язким — гель.
Рух цитоплазми — переміщення цитоплазми з усіма її органоїдами відносно оболонки клітини. Рух цитоплазми — одна з обов’язкових властивостей цитоплазми як живої матерії. Вперше цей процес описав італійський ботанік Д. Амічі (1827). Спостерігається в клітинах одноклітинних та багатоклітинних організмів. Основними причинами, що зумовлюють рух цитоплазми є постійні обмінні процеси, а головними умовами є наявність тепла і кисню. Рухаючись, цитоплазма захоплює за собою органоїди, тому про її рух можна судити, спостерігаючи за рухом органоїдів. Швидкість руху цитоплазми в різних клітинах неоднакова і в основному залежить від внутрішніх та зовнішніх факторів. Не з однаковою швидкістю рухається маса цитоплазми в межах однієї клітини. Так, шар цитоплазми, що прилягає до оболонки рухається найповільніше. Рух цитоплазми можна стимулювати підвищенням температури, освітленням, а також внутрішніми збудниками, зокрема етиловим спиртом. Встановлено, що для елодеї канадської оптимальна температура для руху цитоплазми є 37˚С.
Існує два типи руху цитоплазми: коловий, струмочковий.
Коловий рух цитоплазми спостерігається в клітинах, у яких протопласт зосереджений біля оболонки клітини, а внутрішня частина клітини виповнена великою вакуолею. Даний тип руху може відбуватися за і проти годинникової стрілки. Швидкість руху цитоплазми не велика. Так, наприклад, в елодеї становить 10-15 м. на секунду, а у валіснерії — 10-20 м. на секунду. Струмочковий рух цитоплазми відбувається в клітинах, у яких цитоплазма розташовується у вигляді тяжів, які перетинають центральну вакуолю. У таких випадках цитоплазма рухається в різних напрямках у виглідя тонких струмочків.
 План
роботи
План
роботи
Молоді пагони елодеї помістити у теплу воду (до 30ºС) до якої додати спирту (5-6 капель на склянку води). Пінцетом відірвати під водою від стебла елодеї свіжий зелений листок і покласти на предметне скло в краплину води та накрити покривним.
При малому збільшені мікроскопа знайти блідо-зелені ділянки листка. При великому- знайти видовжені клітин, що прилягають до середньої жилки листка і відмітити рух цитоплазми, спостерігаючи за рухом хлорофілових зерен вдовж оболонок. Також разом з током цитоплазми можуть рухатись і ядра.
З одного боку покривного скельця нанести декілька крапель сприту, а з іншого краю відтягнути воду за допомогою смужки фільтрувального паперу. Розглянути препарат пі мікроскопом. Рух цитоплазми припиняється внаслідок загибелі цитоплазми.
Клітини замалювати. Зробити висновки.
Висновки:
