
- •Часть 1
- •Глава I
- •§ 1. Статистическое распределение
- •§ 2. Статистическая независимость
- •§ 3. Теорема Лиувилля
- •§ 4. Роль энергии
- •§ 5. Статистическая матрица
- •§ 6. Статистическое распределение в квантовой статистике
- •§ 7. Энтропия
- •§ 8. Закон возрастания энтропии
- •Глава II
- •§ 9. Температура
- •§10. Макроскопическое движение
- •1) Производную по вектору надо понимать как вектор, составляющие которого равны производным по составляющим вектора, по которому произ- водится дифференцирование.
- •§11. Адиабатический процесс
- •§ 12. Давление
- •§ 13. Работа и количество тепла
- •§ 14. Тепловая функция
- •§ 15. Свободная энергия н термодинамический потенциал
- •§16. Соотношения между производными термодинамических
- •§ 16] Производные термодинамических величин
- •§ 17. Термодинамическая шкала температуры
- •§ 18. Процесс Джоуля — Томсона
- •§ 19. Максимальная работа
- •§ 20. Максимальная работа, производимая телом, находящимся во внешней среде
- •§ 20] Тело, находящееся во внешней среде 77
- •§ 21. Термодинамические неравенства
- •§ 22. Принцип Ле-Шателье
- •§ 23. Теорема Нернста
- •§ 24. Зависимость термодинамических величин от числа частиц
- •§ 25. Равновесие тела во внешнем поле
- •§ 26. Вращающиеся тела
- •§ 27. Термодинамические соотношения в релятивистской области
- •Глава III
- •§ 28. Распределение Гиббса
- •§ 29. Распределение Максвелла
- •§ 30. Распределение вероятностей для осциллятора
- •§ 31. Свободная энергия в распределении Гиббса
- •§ 32. Термодинамическая теория возмущений
- •§ 33. Разложение по степеням %
- •§ 34. Распределение Гиббса для вращающихся тел
- •§ 35. Распределение Гиббса с переменным числом частиц
- •§ 36. Вывод термодинамических соотношений из распределения Гиббса
- •Глава IV
- •§ 37. Распределение Больцмана
- •§ 38. Распределение Больцмана в классической статистике
- •§ 39. Столкновения молекул
- •§ 40. Неравновесный идеальный газ
- •§ 41. Свободная энергия больцмановского идеального газа
- •§ 42. Уравнение состояния идеального газа
- •§ 43. Идеальный газ с постоянной теплоемкостью
- •15. Определить максимальную работу, которую можно получить с по- мощью идеального газа при охлаждении от температуры т до температуры среды т0 при постоянном объеме.
- •§ 44. Закон равнораспределения
- •§ 43. Одноатомный идеальный газ
- •§ 46. Одноатомный газ. Влияние электронного момента
- •§ 47. Двухатомный газ с молекулами из различных атомов. Вращение молекул
- •§ 48. Двухатомный газ с молекулами из одинаковых атомов. Вращение молекул
- •§ 49. Двухатомный газ. Колебания атомов
- •§ 50. Двухатомный газ. Влияние электронного момента
- •§51] Многоатомный газ 169
- •§ 51. Многоатомный газ
- •§ 52. Магнетизм газов
- •Глава V
- •§ 53. Распределение Ферми
- •§ 54. Распределение Бозе
- •§ 55. Неравновесные ферми- и бозе-газы
- •§ 56. Ферми- и бозе-газы элементарных частиц
- •§ 56] Ферми- и бозе-газы элементарных частиц 185
- •§ 57. Вырожденный электронный газ
- •§ 58. Теплоемкость вырожденного электронного газа
- •§ 59. Магнетизм электронного газа. Слабые поля
- •§ 60. Магнетизм электронного газа. Сильные поля
- •§ 61. Релятивистский вырожденный электронный газ
- •§ 62. Вырожденный бозе-газ
- •§ 63. Черное излучение
- •Глава VI
- •§ 64. Твердые тела при низких температурах
- •§ 65. Твердые тела при высоких температурах
- •§ 66. Интерполяционная формула Дебая
- •§ 67. Тепловое расширение твердых тел
- •§ 68. Сильно анизотропные кристаллы
- •§ 69. Колебания кристаллической решетки
- •§ 70. Плотность числа колебаний
- •§ 71. Фононы.
- •§ 72. Операторы рождения и уничтожения фононов
- •§ 73. Отрицательные температуры
- •Глава VII
- •§ 74. Отклонение газов от идеальности
- •§ 75. Разложение по степеням плотности
- •§ 76. Формула ван-дер Ваальса
- •§ 77. Связь вириального коэффициента с амплитудой рассеяния
- •§ 78. Термодинамические величины классической плазмы
- •§ 79. Метод корреляционных функций
- •§ 80. Термодинамические величины вырожденной плазмы
- •1) В этом случае
- •Глава VIII
- •§ 81. Условия равновесия фаз
- •§ 82. Формула Клапейрона — Клаузиуса
- •§ 83. Критическая точка
- •§ 84. Закон соответственных состояний
- •Глава IX
- •§ 85. Системы с различными частицами
- •§ 86. Правило фаз
- •§ 87. Слабые растворы
- •§ 88. Осмотическое давление
- •§ 89. Соприкосновение фаз растворителя
- •§ 90. Равновесие по отношению к растворенному веществу
- •§ 91. Выделение тепла и изменение объема при растворении
- •§ 92. Растворы сильных электролитов
- •§ 93. Смесь идеальных газов
- •§ 94. Смесь изотопов
- •§ 95. Давление пара над концентрированным раствором
- •§ 96. Термодинамические неравенства в растворах
- •§ 97. Кривые равновесия
- •§ 98. Примеры диаграмм состояния
- •§ 99. Пересечение особых кривых поверхности равновесия
- •§ 100. Газ и жидкость
- •Глава X
- •§ 101. Условие химического равновесия
- •§ 102. Закон действующих масс
- •§ 103. Теплота реакции
- •§ 104. Ионизационное равновесие
- •§ 105. Равновесие по отношению к образованию пар
- •Глава XI
- •§ 106. Уравнение состояния вещества при больших плотностях
- •§ 107. Равновесие тел с большой массой
- •§ 108. Энергия гравитирующего тела
- •§ 109. Равновесие нейтронной сферы
- •Глава XII
- •§110. Распределение Гаусса
- •§ 110] Распределение гаусса 365
- •§ 111. Распределение Гаусса для нескольких величин
- •§ 113. Флуктуации в идеальном газе
- •§114. Формула Пуассона
- •§ 115. Флуктуации в растворах
- •§ 116. Пространственная корреляция флуктуации плотности
- •§ 117. Корреляция флуктуации плотности в вырожденном газе
- •§ 118. Корреляция флуктуации во времени
- •§ 119. Временная корреляция флуктуации нескольких величин
- •§ 120. Симметрия кинетических коэффициентов
- •§ 121. Диссипативная функция
- •§ 122. Спектральное разложение флуктуации
- •§ 123. Обобщенная восприимчивость
- •§ 123] Обобщенная восприимчивость 411
- •§ 124. Флуктуационно-диссипационная теорема
- •§ 125. Флуктуационно-диссипационная теорема для нескольких величин
- •§ 126. Операторное выражение обобщенной восприимчивости
- •§ 127. Флуктуации изгиба длинных молекул
- •Глава XIII
- •§ 128. Элементы симметрии кристаллической решетки
- •§ 129. Решетка Бравэ
- •§ 130. Кристаллические системы
- •§ 131. Кристаллические классы
- •§ 132. Пространственные группы
- •§ 133. Обратная решетка
- •§ 134. Неприводимые представления пространственных групп
- •§ 135. Симметрия относительно обращения времени
- •§ 136. Свойства симметрии нормальных колебаний кристаллической решетки
- •§ 137. Структуры с одно- и двумерной периодичностью
- •§ 138. Корреляционная функция в двумерных системах
- •§ 139. Симметрия по ориентации молекул
- •§ 140. Нематические и холестерические жидкие кристаллы
- •§ 141. Флуктуации в жидких кристаллах
- •Глава XIV
- •§ 142. Фазовые переходы второго рода
- •§ 143. Скачок теплоемкости
- •§ 144. Влияние внешнего поля на фазовый переход
- •§ 145. Изменение симметрии при фазовом переходе второго рода
- •§ 146. Флуктуации параметра порядка
- •§ 147. Эффективный гамильтониан
- •§ 148. Критические индексы
- •§ 149. Масштабная инвариантность
- •§ 150. Изолированные и критические точки непрерывного перехода
- •§ 151. Фазовый переход второго рода в двумерной решетке
- •§ 153. Флуктуационная теория критической точки
- •Глава XV
- •§ 154. Поверхностное натяжение
- •§ 155. Поверхностное натяжение кристаллов
- •§ 156. Поверхностное давление
- •§ 157. Поверхностное натяжение растворов
- •§ 158. Поверхностное натяжение растворов сильных электролитов
- •§ 159. Адсорбция
- •§ 160. Смачивание
- •§ 161. Краевой угол
- •§ 162. Образование зародышей при фазовых переходах
- •§ 1Б2] образование зародышей при фазовых переходах 581
- •§ 163. Невозможность существования фаз в одномерных системах
§ 103. Теплота реакции
Химическая реакция сопровождается поглощением или выделением тепла. В первом случае говорят об эндотермической, а во втором — об экзотермической реакции. Ясно, что если какая-либо реакция экзотермична, то обратная ей реакция эндотермична, и наоборот.
Тепловой эффект реакции зависит от условий, в которых она происходит. Поэтому, например, надо различать тепловые эффекты реакции, происходящей при постоянном объеме или при постоянном давлении (эта разница, впрочем, обычно относительно незначительна).
Как и при вычислении теплоты растворения (§91), определим сначала максимальную работу, которая может быть получена за счет химической реакции.
Назовем «элементарной» реакцию между одним набором молекул, определяемым уравнением реакции, и вычислим изменение термодинамического потенциала смеси реагирующих веществ при протекании некоторого малого числа on элементарных реакций; при этом предполагаем, что реакция происходит при постоянных температуре и давлении. Имеем
с i
Изменение числа молекул г'-го вещества при 8п элементарных реакциях равно, очевидно, 6Nj = — v,- б«. Таким образом,
6Ф = — 6«2v,p.,-. (103,1)
i
Как и следовало, в равновесии бФ/бп обращается в нуль.
Величина (103,1) представляет собой общее выражение для минимальной работы, которая должна быть затрачена для проведения 6п элементарных реакций. Она же есть максимальная работа, которую можно получить за счет того же числа реакций, протекающих в обратном направлении.
Предположим сначала, что реакция происходит между газами. Пользуясь выражением (102,1) для р,-, находим
или,
вводя константу равновесия:
бФ=Г6п
[-2
v,
In Р,.+1п
Кр
(Т)]=Т6п
[-2
v,-
In с,-+1п
Кс
(Р, Т)].
(103,2)
Для
реакций в растворах находим аналогично
с помощью
(102,7)
и (102,9)
(103,3)
Знак
величины 6Ф определяет направление, в
котором идет реакция: поскольку Ф
стремится к минимуму, то при 6Ф<0
реакция
протекает в прямом направлении (т. е.
«слева направо» в уравнении химической
реакции), а если 6Ф > 0, то это значит,
что в данной смеси реакция идет в
действительности в обратном направлении.
Отметим, впрочем, что направление
реакции можно усмотреть также и
непосредственно из закона действующих
масс:
составляем
для данной смеси произведение HpJ'
и
сравниваем
со значением константы равновесия
данной реакции; если, например,
окажется, что ЦPt
1
>
Кр,
то
это значит, что реакция будет идти в
прямом направлении—так, чтобы
уменьшались парциальные давления
исходных веществ (входящих в уравнение
реакции с положительными v()
и
увеличивались давления продуктов
реакции (для которых v,<0).
Теперь
можно определить и количество
поглощаемого (или выделяемого—в
зависимости от знака) тепла, опять-таки
при 8п
элементарных
реакциях. Согласно формуле (91,4) это
тепло 8Qp
для
реакций при постоянных температуре и
давлении равно![]()
![]()
Для
реакций между газами получаем, подставляя
(103,2),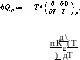
6QP = — Т2 Ьп
(103,4)
— Г2
8п![]()
д\т\К(Р, Т)
дТ
(103,5)
Заметим, что 8Qp просто пропорционально 8п и не зависит от значений концентраций в данный момент; поэтому эти формулы применимы и для любого не малого 8п.
Если Qp > 0, т. е. реакция эндотермична, то д In К/дТ < 0, т. е. константа равновесия падает с увеличением температуры. Напротив, для экзотермической реакции (Qp < 0) константа равновесия растет вместе с температурой. С другой стороны, рост константы равновесия означает сдвиг химического равновесия в сторону обратного образования исходных веществ (реакция идет «справа налево»)— так, чтобы увеличилось произведение Цсог -Наоборот, уменьшение константы равновесия означает сдвиг равновесия в сторону образования продуктов реакции. Другими словами, можно сформулировать следующее правило: нагревание сдвигает равновесие в сторону процесса, идущего эндотермически, а охлаждение —■ в сторону экзотермического процесса. Это правило находится в полном согласии с принципом Ле-Шателье.
Для реакций между газами представляет интерес также и тепловой эффект реакции, протекающей при постоянном объеме (и температуре). Эта величина 8QV связана простым образом с теплом 8Qp. Действительно, количество поглощаемого тепла при процессе с постоянным объемом равно изменению энергии системы, между тем как 8Qp равно изменению тепловой функции. Поскольку E—W—PV, то ясно, что
8Qv = 8Qp-8(PV) или, подставляя PV = Т^Ы( и 8W,- = — vfin, bQv=&QP + T8n'2ivi.
(103,6)
Наконец, определим изменение объема смеси реагирующих веществ в результате реакции, протекающей при постоянном давлении (и температуре). Для газов этот вопрос тривиален:
8V = ^8N
= — 8п У, v,-.
(103,7)
В частности, реакции, не меняющие общего числа частиц (2V< = 0)> идут без изменения объема.
Для реакций же в слабых растворах пользуемся формулой
V = — бф и, подставляя (103,3), получаем
8V=T8n
din К (Р, Т) дР
(103,8)
Таким образом, изменение объема при реакции связано с зависимостью константы равновесия от давления. Аналогично сказанному выше по поводу зависимости от температуры легко заключить, что увеличение давления способствует реакциям, протекающим с уменьшением объема (т. е. сдвигает в соответствующую сторону положение равновесия), а уменьшение давления — реакциям, приводящим к увеличению объема,— снова в полном согласии с принципом Ле-Шателье.
