
- •Часть 1
- •Глава I
- •§ 1. Статистическое распределение
- •§ 2. Статистическая независимость
- •§ 3. Теорема Лиувилля
- •§ 4. Роль энергии
- •§ 5. Статистическая матрица
- •§ 6. Статистическое распределение в квантовой статистике
- •§ 7. Энтропия
- •§ 8. Закон возрастания энтропии
- •Глава II
- •§ 9. Температура
- •§10. Макроскопическое движение
- •1) Производную по вектору надо понимать как вектор, составляющие которого равны производным по составляющим вектора, по которому произ- водится дифференцирование.
- •§11. Адиабатический процесс
- •§ 12. Давление
- •§ 13. Работа и количество тепла
- •§ 14. Тепловая функция
- •§ 15. Свободная энергия н термодинамический потенциал
- •§16. Соотношения между производными термодинамических
- •§ 16] Производные термодинамических величин
- •§ 17. Термодинамическая шкала температуры
- •§ 18. Процесс Джоуля — Томсона
- •§ 19. Максимальная работа
- •§ 20. Максимальная работа, производимая телом, находящимся во внешней среде
- •§ 20] Тело, находящееся во внешней среде 77
- •§ 21. Термодинамические неравенства
- •§ 22. Принцип Ле-Шателье
- •§ 23. Теорема Нернста
- •§ 24. Зависимость термодинамических величин от числа частиц
- •§ 25. Равновесие тела во внешнем поле
- •§ 26. Вращающиеся тела
- •§ 27. Термодинамические соотношения в релятивистской области
- •Глава III
- •§ 28. Распределение Гиббса
- •§ 29. Распределение Максвелла
- •§ 30. Распределение вероятностей для осциллятора
- •§ 31. Свободная энергия в распределении Гиббса
- •§ 32. Термодинамическая теория возмущений
- •§ 33. Разложение по степеням %
- •§ 34. Распределение Гиббса для вращающихся тел
- •§ 35. Распределение Гиббса с переменным числом частиц
- •§ 36. Вывод термодинамических соотношений из распределения Гиббса
- •Глава IV
- •§ 37. Распределение Больцмана
- •§ 38. Распределение Больцмана в классической статистике
- •§ 39. Столкновения молекул
- •§ 40. Неравновесный идеальный газ
- •§ 41. Свободная энергия больцмановского идеального газа
- •§ 42. Уравнение состояния идеального газа
- •§ 43. Идеальный газ с постоянной теплоемкостью
- •15. Определить максимальную работу, которую можно получить с по- мощью идеального газа при охлаждении от температуры т до температуры среды т0 при постоянном объеме.
- •§ 44. Закон равнораспределения
- •§ 43. Одноатомный идеальный газ
- •§ 46. Одноатомный газ. Влияние электронного момента
- •§ 47. Двухатомный газ с молекулами из различных атомов. Вращение молекул
- •§ 48. Двухатомный газ с молекулами из одинаковых атомов. Вращение молекул
- •§ 49. Двухатомный газ. Колебания атомов
- •§ 50. Двухатомный газ. Влияние электронного момента
- •§51] Многоатомный газ 169
- •§ 51. Многоатомный газ
- •§ 52. Магнетизм газов
- •Глава V
- •§ 53. Распределение Ферми
- •§ 54. Распределение Бозе
- •§ 55. Неравновесные ферми- и бозе-газы
- •§ 56. Ферми- и бозе-газы элементарных частиц
- •§ 56] Ферми- и бозе-газы элементарных частиц 185
- •§ 57. Вырожденный электронный газ
- •§ 58. Теплоемкость вырожденного электронного газа
- •§ 59. Магнетизм электронного газа. Слабые поля
- •§ 60. Магнетизм электронного газа. Сильные поля
- •§ 61. Релятивистский вырожденный электронный газ
- •§ 62. Вырожденный бозе-газ
- •§ 63. Черное излучение
- •Глава VI
- •§ 64. Твердые тела при низких температурах
- •§ 65. Твердые тела при высоких температурах
- •§ 66. Интерполяционная формула Дебая
- •§ 67. Тепловое расширение твердых тел
- •§ 68. Сильно анизотропные кристаллы
- •§ 69. Колебания кристаллической решетки
- •§ 70. Плотность числа колебаний
- •§ 71. Фононы.
- •§ 72. Операторы рождения и уничтожения фононов
- •§ 73. Отрицательные температуры
- •Глава VII
- •§ 74. Отклонение газов от идеальности
- •§ 75. Разложение по степеням плотности
- •§ 76. Формула ван-дер Ваальса
- •§ 77. Связь вириального коэффициента с амплитудой рассеяния
- •§ 78. Термодинамические величины классической плазмы
- •§ 79. Метод корреляционных функций
- •§ 80. Термодинамические величины вырожденной плазмы
- •1) В этом случае
- •Глава VIII
- •§ 81. Условия равновесия фаз
- •§ 82. Формула Клапейрона — Клаузиуса
- •§ 83. Критическая точка
- •§ 84. Закон соответственных состояний
- •Глава IX
- •§ 85. Системы с различными частицами
- •§ 86. Правило фаз
- •§ 87. Слабые растворы
- •§ 88. Осмотическое давление
- •§ 89. Соприкосновение фаз растворителя
- •§ 90. Равновесие по отношению к растворенному веществу
- •§ 91. Выделение тепла и изменение объема при растворении
- •§ 92. Растворы сильных электролитов
- •§ 93. Смесь идеальных газов
- •§ 94. Смесь изотопов
- •§ 95. Давление пара над концентрированным раствором
- •§ 96. Термодинамические неравенства в растворах
- •§ 97. Кривые равновесия
- •§ 98. Примеры диаграмм состояния
- •§ 99. Пересечение особых кривых поверхности равновесия
- •§ 100. Газ и жидкость
- •Глава X
- •§ 101. Условие химического равновесия
- •§ 102. Закон действующих масс
- •§ 103. Теплота реакции
- •§ 104. Ионизационное равновесие
- •§ 105. Равновесие по отношению к образованию пар
- •Глава XI
- •§ 106. Уравнение состояния вещества при больших плотностях
- •§ 107. Равновесие тел с большой массой
- •§ 108. Энергия гравитирующего тела
- •§ 109. Равновесие нейтронной сферы
- •Глава XII
- •§110. Распределение Гаусса
- •§ 110] Распределение гаусса 365
- •§ 111. Распределение Гаусса для нескольких величин
- •§ 113. Флуктуации в идеальном газе
- •§114. Формула Пуассона
- •§ 115. Флуктуации в растворах
- •§ 116. Пространственная корреляция флуктуации плотности
- •§ 117. Корреляция флуктуации плотности в вырожденном газе
- •§ 118. Корреляция флуктуации во времени
- •§ 119. Временная корреляция флуктуации нескольких величин
- •§ 120. Симметрия кинетических коэффициентов
- •§ 121. Диссипативная функция
- •§ 122. Спектральное разложение флуктуации
- •§ 123. Обобщенная восприимчивость
- •§ 123] Обобщенная восприимчивость 411
- •§ 124. Флуктуационно-диссипационная теорема
- •§ 125. Флуктуационно-диссипационная теорема для нескольких величин
- •§ 126. Операторное выражение обобщенной восприимчивости
- •§ 127. Флуктуации изгиба длинных молекул
- •Глава XIII
- •§ 128. Элементы симметрии кристаллической решетки
- •§ 129. Решетка Бравэ
- •§ 130. Кристаллические системы
- •§ 131. Кристаллические классы
- •§ 132. Пространственные группы
- •§ 133. Обратная решетка
- •§ 134. Неприводимые представления пространственных групп
- •§ 135. Симметрия относительно обращения времени
- •§ 136. Свойства симметрии нормальных колебаний кристаллической решетки
- •§ 137. Структуры с одно- и двумерной периодичностью
- •§ 138. Корреляционная функция в двумерных системах
- •§ 139. Симметрия по ориентации молекул
- •§ 140. Нематические и холестерические жидкие кристаллы
- •§ 141. Флуктуации в жидких кристаллах
- •Глава XIV
- •§ 142. Фазовые переходы второго рода
- •§ 143. Скачок теплоемкости
- •§ 144. Влияние внешнего поля на фазовый переход
- •§ 145. Изменение симметрии при фазовом переходе второго рода
- •§ 146. Флуктуации параметра порядка
- •§ 147. Эффективный гамильтониан
- •§ 148. Критические индексы
- •§ 149. Масштабная инвариантность
- •§ 150. Изолированные и критические точки непрерывного перехода
- •§ 151. Фазовый переход второго рода в двумерной решетке
- •§ 153. Флуктуационная теория критической точки
- •Глава XV
- •§ 154. Поверхностное натяжение
- •§ 155. Поверхностное натяжение кристаллов
- •§ 156. Поверхностное давление
- •§ 157. Поверхностное натяжение растворов
- •§ 158. Поверхностное натяжение растворов сильных электролитов
- •§ 159. Адсорбция
- •§ 160. Смачивание
- •§ 161. Краевой угол
- •§ 162. Образование зародышей при фазовых переходах
- •§ 1Б2] образование зародышей при фазовых переходах 581
- •§ 163. Невозможность существования фаз в одномерных системах
§ 47. Двухатомный газ с молекулами из различных атомов. Вращение молекул
Переходя к вычислению термодинамических величин двухатомного газа, прежде всего укажем, что подобно тому, как одноатомные газы имеет смысл рассматривать лишь при температурах Т, малых по сравнению с энергией ионизации, двухатомный газ можно рассматривать как таковой лишь при условии малости Т по сравнению с энергией диссоциации молекулы2). Это обстоятельство в свою очередь приводит к тому, что в статистической сумме надо учитывать лишь нормальный электронный терм молекулы.
')
Температуры, соответствующие интервалам
сверхтонкой структуры различных
атомов, лежат в пределах от 0,1 до 1,5°.
2)
Укажем для примера температуры /дисс/&
для некоторых двухатомных молекул:
Н2:52000°;
N2:113000°;
О2:59000°;
С12:29000°;
N0:61000°; СО: 98 ООО".
Уровень энергии двухатомной молекулы складывается в известном приближении из трех независимых частей—электронной энергии (в которую включают также и энергию кулонового взаимодействия ядер в их равновесном положении и которую мы будем отсчитывать от суммы энергий разведенных атомов), вращательной энергии и энергии колебаний ядер внутри молекулы. Для синглетного электронного терма эти уровни могут быть написаны в виде (см. III, § 82)
svK = to + ^(v+^+pIK(K+l). (47,1)
Здесь е0—электронная энергия, /гсо — колебательный квант, v — колебательное квантовое число, К—вращательное квантовое число (момент вращения молекулы), I = т'г%—момент инерции молекулы \т'= mltnJ(m1-\-mi)—приведенная масса обоих атомов, га — равновесное значение расстояния между ядрами).
При подстановке выражения (47,1) в статистическую сумму последняя распадается, очевидно, натри независимых множителя:
Z = e-^ZBpZK0J„ (47,2)
где «вращательная» и «колебательная» суммы определяются как
Zbp=L (2/С+1)ехр [~~K(K + l)]t (47,3)
К= о
со
Z-M=2>p [_^^ + jjJ, (47,4)
причем множитель 2/С+ 1 в ZBp учитывает вырождение вращательных уровней по направлениям момента К. Соответственно, свободная энергия представится в виде суммы трех частей:
F = -NT In +FBV + FKon + Ne0 (47,5)
(m = ml+m2—масса молекулы). Первый член можно назвать поступательной частью Fnoc (поскольку он связан со степенями свободы поступательного движения молекул), а
FBV Л7Г1п ZBp, Fкол = - NT In ZK0JI (47,6)
— вращательной и колебательной частями. Поступательная часть всегда выражается формулой типа (43,1) с постоянной теплоемкостью спос = 3/2 и химической постоянной
^с = 41п^- (47,7)
Полная теплоемкость газа запишется в виде суммы нескольких членов:
cv = спос Н~ ^вр Н~ скол, ср = спос -|- свр -\- скол -|- 1, (47,8)
каждый из которых связан с тепловым возбуждением соответственно поступательного движения молекулы, ее вращения и колебаний атомов внутри молекулы.
Займемся вычислением вращательной свободной энергии. Если температура настолько высока, что
(«вращательный квант» Й-2/2/ мал по сравнению с Г)1), то в сумме (47,3) основную роль играют члены с большими К- Но при больших значениях К вращение молекулы квазиклассично. Поэтому в этом случае статистическая сумма ZBp может быть заменена соответствующим классическим интегралом
ZBV= J e-««>/rdTBpt (47,9)
где е(М) — классическое выражение кинетической энергии вращения как функции момента вращения М. Ввводя связанную с молекулой вращающуюся систему координат |т]£ с осью £ вдоль оси молекулы и имея в виду, что двухатомная молекула обладает двумя вращательными степенями свободы, а момент вращения линейной механической системы перпендикулярен к ее оси, пишем:
е(М) = 1(М1+М2).
х)
Фактически это условие всегда выполняется
для всех газов, за исключением обоих
изотопов водорода. Для примера укажем
значения Й.2/2&/
для некоторых молекул: Н2:85,4°;
D2:43°;
HD:64°; N2:2,9°;
02:2,1°;
Cl2:0,36°;
N0:2,4°;
НС1:15,2°.
2)
Необходимо иметь в виду, что такой
способ написания в известном смысле
условен, так как dq>g
и
dtp
не
являются полными дифференциалами
какой бы то ни было функции положения
осей.
ного угла dO{ для направления третьей оси £; интегрирование по телесному углу даст 4я. Таким образом, имеем *)
+ 00
z**=^Sf Иехр [~ т м%] dMtdM*=tJ-
Отсюда свободная энергия
FB9 = -NT\nT-NT\n^. (47,10)
Таким образом, при рассматриваемых не слишком низких температурах вращательная часть теплоемкости оказывается постоянной и равной свр = 1 в соответствии с общими результатами классического рассмотрения в § 44 (по 1/2 на каждую вращательную степень свободы). Вращательная часть химической постоянной равна £вр = In (2//Д2). Мы увидим ниже, что существует значительная область температур, в которой выполнено условие Т^*>%2/21 и в то же время колебательная часть свободной энергии, а с нею и колебательная часть теплоемкости отсутствуют. В этой области теплоемкость двухатомного газа равна cv — caoz-\-~\~ с т. е.
ВР' ' ' с, = 5/2, с, «7/2, (47,11)
С = 1п
(47,12)
'21 fm\'/'
\%ь\2и)
В обратном предельном случае низких температур
Г<й*/2/
достаточно сохранить два первых члена суммы:
ZBp=l+3e-*'//r, и для свободной энергии получим в том же приближении
Отсюда энтропия
F^—ZNTe-b'i'T. (47,13)
3Np
и теплоемкость
с„ = зн(%)'е-»'». (47,15)
') Это значение Z3V можно получить также и иным способом: считая числа К в сумме (47,3) большими и заменяя суммирование интегрированием па К, найдем
/СФ\ .v 2TI
 Таким
образом, вращательные энтропия и
теплоемкость газа при Т-*-0
обращаются
в нуль в основном по экспоненциальному
закону. При низких температурах,
следовательно, -двухатомный газ ведет
себя как одноатомный; как его теплоемкость,
так и химическая постоянная имеют те
же значения, которые имел бы одноатомный
газ с частицами массы т.
Таким
образом, вращательные энтропия и
теплоемкость газа при Т-*-0
обращаются
в нуль в основном по экспоненциальному
закону. При низких температурах,
следовательно, -двухатомный газ ведет
себя как одноатомный; как его теплоемкость,
так и химическая постоянная имеют те
же значения, которые имел бы одноатомный
газ с частицами массы т.
%г _
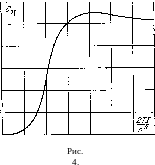
го
Q6 Q4
О 0,4 12 £4
Q8
В общем случае произвольных температур сумма ZBp должна вычисляться численно. На рис. 4 приведен график свр как функции от 27V/&2. Вращательная теплоемкость имеет максимум, равный 1,1 при Т = 0,81 (%2/21), после чего асимптотически приближается к классическому значению 11).
