
- •Часть 1
- •Глава I
- •§ 1. Статистическое распределение
- •§ 2. Статистическая независимость
- •§ 3. Теорема Лиувилля
- •§ 4. Роль энергии
- •§ 5. Статистическая матрица
- •§ 6. Статистическое распределение в квантовой статистике
- •§ 7. Энтропия
- •§ 8. Закон возрастания энтропии
- •Глава II
- •§ 9. Температура
- •§10. Макроскопическое движение
- •1) Производную по вектору надо понимать как вектор, составляющие которого равны производным по составляющим вектора, по которому произ- водится дифференцирование.
- •§11. Адиабатический процесс
- •§ 12. Давление
- •§ 13. Работа и количество тепла
- •§ 14. Тепловая функция
- •§ 15. Свободная энергия н термодинамический потенциал
- •§16. Соотношения между производными термодинамических
- •§ 16] Производные термодинамических величин
- •§ 17. Термодинамическая шкала температуры
- •§ 18. Процесс Джоуля — Томсона
- •§ 19. Максимальная работа
- •§ 20. Максимальная работа, производимая телом, находящимся во внешней среде
- •§ 20] Тело, находящееся во внешней среде 77
- •§ 21. Термодинамические неравенства
- •§ 22. Принцип Ле-Шателье
- •§ 23. Теорема Нернста
- •§ 24. Зависимость термодинамических величин от числа частиц
- •§ 25. Равновесие тела во внешнем поле
- •§ 26. Вращающиеся тела
- •§ 27. Термодинамические соотношения в релятивистской области
- •Глава III
- •§ 28. Распределение Гиббса
- •§ 29. Распределение Максвелла
- •§ 30. Распределение вероятностей для осциллятора
- •§ 31. Свободная энергия в распределении Гиббса
- •§ 32. Термодинамическая теория возмущений
- •§ 33. Разложение по степеням %
- •§ 34. Распределение Гиббса для вращающихся тел
- •§ 35. Распределение Гиббса с переменным числом частиц
- •§ 36. Вывод термодинамических соотношений из распределения Гиббса
- •Глава IV
- •§ 37. Распределение Больцмана
- •§ 38. Распределение Больцмана в классической статистике
- •§ 39. Столкновения молекул
- •§ 40. Неравновесный идеальный газ
- •§ 41. Свободная энергия больцмановского идеального газа
- •§ 42. Уравнение состояния идеального газа
- •§ 43. Идеальный газ с постоянной теплоемкостью
- •15. Определить максимальную работу, которую можно получить с по- мощью идеального газа при охлаждении от температуры т до температуры среды т0 при постоянном объеме.
- •§ 44. Закон равнораспределения
- •§ 43. Одноатомный идеальный газ
- •§ 46. Одноатомный газ. Влияние электронного момента
- •§ 47. Двухатомный газ с молекулами из различных атомов. Вращение молекул
- •§ 48. Двухатомный газ с молекулами из одинаковых атомов. Вращение молекул
- •§ 49. Двухатомный газ. Колебания атомов
- •§ 50. Двухатомный газ. Влияние электронного момента
- •§51] Многоатомный газ 169
- •§ 51. Многоатомный газ
- •§ 52. Магнетизм газов
- •Глава V
- •§ 53. Распределение Ферми
- •§ 54. Распределение Бозе
- •§ 55. Неравновесные ферми- и бозе-газы
- •§ 56. Ферми- и бозе-газы элементарных частиц
- •§ 56] Ферми- и бозе-газы элементарных частиц 185
- •§ 57. Вырожденный электронный газ
- •§ 58. Теплоемкость вырожденного электронного газа
- •§ 59. Магнетизм электронного газа. Слабые поля
- •§ 60. Магнетизм электронного газа. Сильные поля
- •§ 61. Релятивистский вырожденный электронный газ
- •§ 62. Вырожденный бозе-газ
- •§ 63. Черное излучение
- •Глава VI
- •§ 64. Твердые тела при низких температурах
- •§ 65. Твердые тела при высоких температурах
- •§ 66. Интерполяционная формула Дебая
- •§ 67. Тепловое расширение твердых тел
- •§ 68. Сильно анизотропные кристаллы
- •§ 69. Колебания кристаллической решетки
- •§ 70. Плотность числа колебаний
- •§ 71. Фононы.
- •§ 72. Операторы рождения и уничтожения фононов
- •§ 73. Отрицательные температуры
- •Глава VII
- •§ 74. Отклонение газов от идеальности
- •§ 75. Разложение по степеням плотности
- •§ 76. Формула ван-дер Ваальса
- •§ 77. Связь вириального коэффициента с амплитудой рассеяния
- •§ 78. Термодинамические величины классической плазмы
- •§ 79. Метод корреляционных функций
- •§ 80. Термодинамические величины вырожденной плазмы
- •1) В этом случае
- •Глава VIII
- •§ 81. Условия равновесия фаз
- •§ 82. Формула Клапейрона — Клаузиуса
- •§ 83. Критическая точка
- •§ 84. Закон соответственных состояний
- •Глава IX
- •§ 85. Системы с различными частицами
- •§ 86. Правило фаз
- •§ 87. Слабые растворы
- •§ 88. Осмотическое давление
- •§ 89. Соприкосновение фаз растворителя
- •§ 90. Равновесие по отношению к растворенному веществу
- •§ 91. Выделение тепла и изменение объема при растворении
- •§ 92. Растворы сильных электролитов
- •§ 93. Смесь идеальных газов
- •§ 94. Смесь изотопов
- •§ 95. Давление пара над концентрированным раствором
- •§ 96. Термодинамические неравенства в растворах
- •§ 97. Кривые равновесия
- •§ 98. Примеры диаграмм состояния
- •§ 99. Пересечение особых кривых поверхности равновесия
- •§ 100. Газ и жидкость
- •Глава X
- •§ 101. Условие химического равновесия
- •§ 102. Закон действующих масс
- •§ 103. Теплота реакции
- •§ 104. Ионизационное равновесие
- •§ 105. Равновесие по отношению к образованию пар
- •Глава XI
- •§ 106. Уравнение состояния вещества при больших плотностях
- •§ 107. Равновесие тел с большой массой
- •§ 108. Энергия гравитирующего тела
- •§ 109. Равновесие нейтронной сферы
- •Глава XII
- •§110. Распределение Гаусса
- •§ 110] Распределение гаусса 365
- •§ 111. Распределение Гаусса для нескольких величин
- •§ 113. Флуктуации в идеальном газе
- •§114. Формула Пуассона
- •§ 115. Флуктуации в растворах
- •§ 116. Пространственная корреляция флуктуации плотности
- •§ 117. Корреляция флуктуации плотности в вырожденном газе
- •§ 118. Корреляция флуктуации во времени
- •§ 119. Временная корреляция флуктуации нескольких величин
- •§ 120. Симметрия кинетических коэффициентов
- •§ 121. Диссипативная функция
- •§ 122. Спектральное разложение флуктуации
- •§ 123. Обобщенная восприимчивость
- •§ 123] Обобщенная восприимчивость 411
- •§ 124. Флуктуационно-диссипационная теорема
- •§ 125. Флуктуационно-диссипационная теорема для нескольких величин
- •§ 126. Операторное выражение обобщенной восприимчивости
- •§ 127. Флуктуации изгиба длинных молекул
- •Глава XIII
- •§ 128. Элементы симметрии кристаллической решетки
- •§ 129. Решетка Бравэ
- •§ 130. Кристаллические системы
- •§ 131. Кристаллические классы
- •§ 132. Пространственные группы
- •§ 133. Обратная решетка
- •§ 134. Неприводимые представления пространственных групп
- •§ 135. Симметрия относительно обращения времени
- •§ 136. Свойства симметрии нормальных колебаний кристаллической решетки
- •§ 137. Структуры с одно- и двумерной периодичностью
- •§ 138. Корреляционная функция в двумерных системах
- •§ 139. Симметрия по ориентации молекул
- •§ 140. Нематические и холестерические жидкие кристаллы
- •§ 141. Флуктуации в жидких кристаллах
- •Глава XIV
- •§ 142. Фазовые переходы второго рода
- •§ 143. Скачок теплоемкости
- •§ 144. Влияние внешнего поля на фазовый переход
- •§ 145. Изменение симметрии при фазовом переходе второго рода
- •§ 146. Флуктуации параметра порядка
- •§ 147. Эффективный гамильтониан
- •§ 148. Критические индексы
- •§ 149. Масштабная инвариантность
- •§ 150. Изолированные и критические точки непрерывного перехода
- •§ 151. Фазовый переход второго рода в двумерной решетке
- •§ 153. Флуктуационная теория критической точки
- •Глава XV
- •§ 154. Поверхностное натяжение
- •§ 155. Поверхностное натяжение кристаллов
- •§ 156. Поверхностное давление
- •§ 157. Поверхностное натяжение растворов
- •§ 158. Поверхностное натяжение растворов сильных электролитов
- •§ 159. Адсорбция
- •§ 160. Смачивание
- •§ 161. Краевой угол
- •§ 162. Образование зародышей при фазовых переходах
- •§ 1Б2] образование зародышей при фазовых переходах 581
- •§ 163. Невозможность существования фаз в одномерных системах
§ 160. Смачивание
Рассмотрим адсорбцию на поверхности твердого тела из пара адсорбируемого вещества с давлением, близким к давлению насыщения. Равновесная концентрация у определяется условием равенства химического потенциала адсорбированного вещества и.' и химического потенциала пара рг. При этом могут иметь место различные случаи, смотря по характеру зависимости р' от у.
Представим себе, что количество адсорбированного вещества постепенно возрастает и адсорбционный слой переходит в макроскопически толстую жидкую пленку. Поверхностная концентрация у приобретает при этом условный смысл величины, пропорциональной толщине пленки /: y=pl/m, где т—масса молекулы, а р—плотность жидкости. При возрастании толщины пленки химический потенциал ее вещества стремится к рж—химическому потенциалу массивной жидкости. Условимся отсчитывать значение р' (при заданных Р и Т) от этого предельного значения, т. е. будем ниже писать р' + рж вместо р'; таким образом, по определению, р'—*0 при у—зоохимический потенциал пара можно представить в виде
tir = \iM(T) + T\n-?-,
х) Мы имеем здесь в виду адсорбцию на поверхности жидкости; адсорбция на твердой поверхности в данном аспекте не представляет интереса ввиду отмеченной выше фактической ее неоднородности.
Отметим, что в принципе возможна также анизотропия поверхности раздела между двумя изотропными фазами (жидкость и пар) одного и того же чистого вещества.
где Р0 (Т)—давление насыщенного пара; здесь использовано то обстоятельство, что насыщенный пар, по определению, находится в равновесии с жидкостью, т. е. при Р = Р0 должно быть рг = рж1). Поверхностная концентрация определяется условием р'+Рж = Мт> т. е.
ц'(у) = 7Чп|-. (160,1)
Если это уравнение удовлетворяется несколькими значениями у, то устойчивому состоянию отвечает то из них, для которого минимален потенциал Q^. Отнеся его к 1 см2 поверхности, мы получим величину, которую можно назвать (в общем случае любой толщины пленки) «эффективным коэффициентом поверхностного натяжения» а на границе твердого тела и пара, учитывающим существование прослойки между ними. Именно, интегрируя соотношение (159,2), напишем:
00
a(y) = lv%dV + a™ + a™v (160,2)
v
Постоянная выбрана таким образом, чтобы при y—функция а (у) переходила в сумму поверхностных натяжений на границах «массивных» фаз твердое тело—жидкость и жидкость — газ.
Напомним также, что необходимым условием термодинамической устойчивости состояния является неравенство (159,1), справедливое при любых y-
Рассмотрим теперь некоторые типичные случаи, которые могут иметь место в зависимости от характера функции р/ (y). На изображаемых ниже графиках сплошная кривая представляет вид этой функции в области макроскопически толстых пленок жидкости, а пунктирная—в области адсорбционных пленок «молекулярной толщины». Разумеется, изображение функции в этих двух областях в одном масштабе на одном графике, строго говоря, невозможно, и в этом смысле графики имеют условный характер.
В первом из изображаемых случаев (рис. 76, а)) функция р' (у) в области макроскопических толщин пленки монотонно убывает с ростом y (т. е. толщины пленки). Что касается области молекулярных размеров, то здесь функция р' (у) всегда стремится при у—*0 к —оо по закону р/ = 7" In у, соответствующему «слабому раствору» адсорбируемого вещества на поверхности. Равновесная концентрация определяется, согласно (160,1), точкой пересечения кривой с горизонтальной прямой р/ = const ^0. В данном случае это имеет место лишь в области молекулярных
х) Жидкость рассматриваем как несжимаемую, т. е. пренебрегаем зависимостью ее химического потенциала от давления.
концентраций, т. е. должна произойти обычная молекулярная адсорбция, о которой шла речь в предыдущем параграфе.
Если р' (у) есть монотонно возрастающая, везде отрицательная функция (рис. 69, б), то в равновесии на поверхности адсорбента образуется жидкая пленка макроскопической толщины. В частности, при давлении Р = Р0 (насыщенный пар) должна возникнуть пленка настолько большой толщины, что свойства вещества в ней уже не отличаются от свойств массивной жидкости, так что насыщенный пар будет соприкасаться со своей же жидкой фазой. В таком случае говорят, что жидкость полностью смачивает данную твердую поверхность.
0
л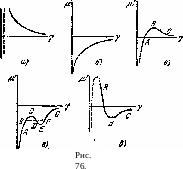 Возможны
в принципе и более сложные случаи. Так,
если функция р' (у)
проходит
через нуль и обладает максимумом (рис.
76, в),
то
мы будем иметь случай смачивания, но с
образованием пленки, устойчивой
лишь при толщинах, меньших определенного
предела. В равновесии с насыщенным
паром находится пленка конечной толщины,
соответствующая точке А.
Это
состояние отделено от другого
устойчивого состояния —равновесия
твердой стенки с массивной
жидкостью—метастабильной областью
АВ
и
областью полной неустойчивости ВС.
Возможны
в принципе и более сложные случаи. Так,
если функция р' (у)
проходит
через нуль и обладает максимумом (рис.
76, в),
то
мы будем иметь случай смачивания, но с
образованием пленки, устойчивой
лишь при толщинах, меньших определенного
предела. В равновесии с насыщенным
паром находится пленка конечной толщины,
соответствующая точке А.
Это
состояние отделено от другого
устойчивого состояния —равновесия
твердой стенки с массивной
жидкостью—метастабильной областью
АВ
и
областью полной неустойчивости ВС.
Кривая изображенного на рис. 76, г типа соответствует пленке, неустойчивой в определенном интервале толщин. Прямая BF, отсекающая равные площади BCD и DEF, соединяет точки В и F с одинаковыми (при одинаковых р') значениями а (как это легко видеть из (160,2)). Устойчивым пленкам отвечают ветви АВ и FG; интервал СЕ полностью неустойчив, а интервалы ВС и EF метастабильны.
Обе границы области неустойчивости (точки В и F) в этом случае отвечают макроскопическим толщинам пленки. Неустойчивости в интервале от некоторой макроскопической толщины до молекулярной должна была бы • соответствовать кривая изображенного на рис. 76, д типа. Однако такая кривая будет скорее всего приводить просто к случаю несмачивания. Действительно, границе устойчивости соответствовала бы такая точка на ветви ВС, в которой горизонтальная прямая отсекала бы одинаковые площади под верхней и над нижней частями кривой. Но это, вообще говоря, невозможно: последняя площадь, связанная с ван-дер-ваальсовыми силами (см. ниже), мала по сравнению с первой, связанной со значительно большими силами на молекулярных расстояниях. Это значит, что поверхностное натяжение на всей ветви ВС будет больше, чем то, которое соответствовало бы молекулярной адсорбции на твердой поверхности, и потому пленка будет метастабильной.
Химический потенциал жидкой пленки (отсчитываемый от значения рж) характеризует отличие энергии вещества в пленке от его энергии в массивной жидкости. Ясно поэтому, что р.' определяется силами взаимодействия между атомами на расстояниях, больших по сравнению с атомными размерами — расстояниях ~ I (так называемые ван-дер-ваальсовы силы). Потенциал р' (/) может быть вычислен в общем виде, причем результат выражается через диэлектрические проницаемости твердой стенки и жидкости (см. том IX).
