
- •Введение
- •1. Основные классы неорганических соединений
- •Примеры составления условий задач и их решения
- •1.1. Тесты. Основные классы неорганических соединений
- •2. Газовые законы. Простейшие стехиометрические законы
- •2.1. Взаимозависимые параметры состояния газов
- •Примеры составления условий задач и их решения
- •2.2. Химические эквиваленты
- •Примеры составления условия задач и их решения
- •2.3. Тесты. Стехиометрия химических превращений
- •3. Основные закономерности протекания химических реакций
- •3.1. Энергетика химических реакций. Химико-термодинамические расчеты
- •Примеры составления условий задач и их решения
- •3.2. Тесты. Энергетика химических реакций
- •3.3. Скорость химических реакций и химическое равновесие
- •Примеры составления условий задачи и их решение
- •3.4. Тесты. Химическая кинетика и равновесие
- •4. Окислительно – восстановительные процессы
- •4.1. Окислительно-восстановительные реакции
- •Ионно-электронный метод
- •Примеры составления условий задач и их решения
- •4.2. Тесты. Окислительно-восстановительные реакции
- •4.3. Гальванические элементы
- •Примеры составления условий задач и их решения
- •4.4. Электролиз
- •Примеры составления условий задач и их решения
- •1. Электролиз водного раствора Na2so4.
- •3. Электролиз водного раствора кВr.
- •4. Электролиз водного раствора СuCl2.
- •4.5. Тесты. Электрохимические элементы. Электролиз
- •4.6. Коррозия металлов
- •Механизм коррозии
- •Примеры составления условий задач и их решение
- •4.7. Тесты. Коррозия металлов
- •5. Растворы
- •5.1 Способы выражения содержания растворенного вещества в растворе
- •Примеры составления условий задач и их решения
- •5.2. Физико-химические свойства разбавленных растворов неэлектролитов
- •Свойства растворов неэлектролитов
- •Примеры составления условий задач и их решения
- •5.3. Растворы электролитов
- •В задачах 757–771 определить кажущуюся степень диссоциации водных растворов электролитов по их температурам кипения
- •5.4. Ионное произведение воды. Водородный показатель
- •Примеры составления задач и их решения
- •5.5. Молекулярно-ионные уравнения обменных реакций между растворами электролитов
- •Примеры составления задач и их решения
- •5.6. Произведение растворимости
- •Примеры составления задач и их решения
- •5.7. Гидролиз солей
- •Примеры составления задач и их решения
- •5.8. Тесты. Растворы
- •6. Строение атома
- •Примеры составления условий задач и их решения
- •6.1. Тесты. Строение атома
- •7. Комплексные соединения
- •Примеры составления задач и их решение
- •7.1. Тесты. Комплексные соединения
- •8. Химические свойства металлов
- •8.1. Взаимодействие металлов с водой
- •Примеры составления условий задач и их решения
- •8.2. Взаимодействие металлов с водными растворами щелочей
- •Взаимодействие металлов с расплавами щелочей
- •Примеры составления условий задач и их решения
- •8.4. Окислительные свойства концентрированной серной кислоты
- •8.5. Окислительные свойства азотной кислоты
- •Примеры составления условий задач и их решение
- •8.6. Окисление металлов катионами других металлов в водных растворах
- •8.7. Тесты. Химические свойства металлов
- •8.8. Тесты. S-, p-, d-, f – элементы и их соединения
- •9. Биологическая роль химических элементов в организме
- •Примеры составления условий задач и их решения
- •9.1. Тесты. Биологическая роль химических элементов в организме
- •Оглавление
7.1. Тесты. Комплексные соединения
Вариант 1
Комплексными соединениями называются:
сложные молекулы, способные к существованию в растворенном состоянии;
соединения, имеющие внутреннюю и внешнюю сферу;
сложные анионы и катионы, способные к существованию в кристаллическом состоянии;
химические соединения, образованные сочетанием определенных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в растворенном состоянии?
Комплексообразователь это:
центральный атом, обычно положительно заряженный;
нейтральная молекула
внутренняя сфера комплексного соединения;
внешняя сфера комплексного соединения.
Критерием для определения типа гибридизации и пространственного строения комплекса являются его магнитные свойства. Каждый электрон обладает определенным магнитным моментом. Вещества называются парамагнитными:
если электроны в соединениях спарены, их магнитные моменты взаимно скомпенсированы;
в состав которых входят неспаренные электроны и при взаимодействии с внешним магнитным полем втягиваются в него;
в состав которых входят спаренные электроны, способные выталкиваться из внешнего магнитного поля;
в состав которых входят спаренные электроны и при взаимодействии с внешним магнитным полем втягиваются в него?
В каком соединении степень окисления комплексообразователя наименьшая:
K[Cr(SO4)2]; 2) [Pt(NH3)2Cl2]; 3) K[VF6]; 4) K3[Fe(CN)6]?
Какие свободные орбитали внешнего n – энергетического уровня кадмия (II) гибридизируются при образовании комплексного иона [Cd(CN3)6]2+:
5p3 5d3; 2) 5s2 5p3; 3) 5p2 5d4; 4) 5s 5p3 5d2?
Вариант 2
Какие свободные орбитали (n – 1)d и n – энергетических уровней хрома (III) гибридизируются при образовании комплексного иона [Cr(H2O)6]Cl3:
3d5 4p; 2) 3d3 4s 4p2; 3) 3d2 4s 4p3; 4) 3d4 4s 4p?
Комплексный ион [NiCl4]2- является внешнеорбитальным. Какие свободные орбитали n – энергетического уровня Ni2+ после гибридизации являются акцепторами неподеленных пар электронов ионов хлора при образовании этого комплекса:
4s 4p3; 2) 4p3 4d; 3) 4p2 4d2; 4) 4s 4d3?
Какие орбитали предвнешнего (n – 1)d и внешнего n – энергетических уровней Ni2+ гибридизируются при образовании комплексного иона [Ni(CN)4]2-? Этот ион диамагнитен и не содержит неспаренных электронов:
4s 4p3; 2) 3d 4p3; 3) 3d4s4p2; 4) 3d 4p2?
Какие орбитали внешнего n – энергетического уровня кобальта (III) гибридизируются при образовании комплексного иона [CoF6]3-? Этот внешнеорбитальный , высокоспиновый ион парамагнитен и содержит четыре неспаренных электрона:
4s3 4d3; 2) 4s 4p2 4d3; 3) 4p 4d5; 4) 4s 4p3 4d2?
Какие орбитали внешнего n – энергетического уровня Zn2+ гибридизируются при образовании комплексного иона [Zn(NH3)4]2+:
4s 4p3; 2) 4p3 4d; 3) 4s 4p 4d2; 4) 4p2 4d2?
Вариант 3
Основополагающие представления о комплексных соединениях ввел в науку:
Вернер; 2) Ахметов; 3) Бекетов; 4) Гельмгольц?
В молекуле комплексного соединения один из атомов, обычно положительно заряженный, занимает центральное место и называется:
внешней средой; 2) лигандом; 3) комплексообразователем;
4) координационным числом?
Из раствора комплексной соли CoCl3*5NH3 нитрат серебра осаждает только ⅔ содержащего в ней хлора. В растворе соли не обнаружено ионов кобальта и свободного аммиака. Каково координационное строение этого соединения:
[Co(NH3)5Cl]Cl; 2) [Co(NH3)5Cl]Cl2; 3) [Co(NH3)5Cl3]; 4) [Co(NH3)4Cl]Cl?
В каком комплексном ионе, образованном хромом (III) заряд равен + 2:
[Cr(H2O)5Cl]; 2) [Cr(H2O)4Cl2]; 3) [Cr(H2O)2(C2O4)2]; 4) [Cr(H2O)3Cl3]?
Чему равна константа нестойкости комплексной соли [Ag(NH3)2]Cl:
Кнест.=
 ;
2) Кнест.=
;
2) Кнест.=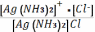 ;
;
3) Кнест.= ;
4) Кнест.=
;
4) Кнест.= .
.
Вариант 4
В комплексном соединении центральный атом координирует вокруг себя молекулы, атомы или ионы называемые:
1) внутренней сферой; 2) координационным числом;
3) лигандами; 4) комплексообразователями?
В каком комплексном ионе, образованным платиной (IV) заряд равен нулю:
[Pt(NH3)4Cl2]; 2) [Pt(NH3)3Cl5]; 3) [Pt(NH3)5Cl]; 4) [Pt(NH3)2Cl4]?
Многие лиганды соединяются одной σ – связью с комплексообразователем – их называют:
1) дидентатными; 2) монодентатными;
3) тридентатными; 4) тетрадентатными?
Какой тип гибридизации в комплексном ионе [Fe(CN)6]4-:
1) sp2; 2) d sp2; 3) d2 sp3; 4) sp?
Образование комплексного иона [BeCl4]2- можно объяснить sp3 – гибридизацией иона Be2+. Какова пространственная конфигурация иона:
1) тетраэдр; 2) равносторонний треугольник; 3) квадрат; 4) октаэдр?
Вариант 5
Метод валентных связей в комплексных соединениях основан на предположении, что химическая связь всегда является связью:
1) двухэлектронной; 2) одноэлектронной; 3) линейной; 4) многоэлектронной?
Какое из перечисленных комплексных соединений является нейтральным:
1) K2[RuCl5OH]; 2) [Co(SCN)(NH3)5](NO3)2;
3) [PtCl3(NO2)(NH3)2]; 4) [Co(NH3)6][Co(CN6)]?
С точки зрения электролитической диссоциации комплексные соединения делят на кислоты, основания, соли. Из данных комплексных соединений укажите соединение основного характера:
1) H[AuCl4]; 2) [Ag(NH3)2]OH; 3) [Ni(NH3)6](NO3)2; 4) [Fe(CO)5]?
Какую диссоциацию называют первичной диссоциацией комплексного соединения: Когда происходит:
1) обратимый распад внутренней сферы;
2) ступенчатая диссоциация комплексных ионов;
3) диссоциация с отщеплением внешней сферы;
4) диссоциация нейтральных комплексов?
Какое ионное уравнение соответствует молекулярному уравнению реакции обмена между нитратом меди (II) и комплексным соединением железа K3[Fe(CN)6]: 3Cu(NO3)2+2K3[Fe(CN)6]→Cu3[Fe(CN)6]2↓+6KNO3:
1 ) 3Cu2++2[Fe(CN)6]3- Cu3[Fe(CN)6]2;
2 ) 3Cu2++2NO-3+2[Fe(CN)6]3- 3Cu2++ [Fe(CN)6]2;
3 ) 3Cu2++6K++2[Fe(CN)6]3- Cu3[Fe(CN)6]2+6K++6NO-3;
4 ) 3Cu2++6[Fe(CN)6]3- Cu3[Fe(CN)6]2?
Вариант 6
Представление о комплексных соединениях ввел А.Вернер в
1908; 2) 1898; 3) 1793; 4) 1900 году?
Дидентатные лиганды связаны с комплексообразователем двумя атомами. Это:
F-, Cl-, Br-, I-, S2- и др; 2) OH-, CN-, NO2-, SCN- и др;
3) CO32-, S2O32-, C2O42-, SO42- и др; 4) H2O, NH3, R-NH2, R2S и др?
Определить заряд лиганда (CNS)x в нейтральном комплексе [Cu(CNS)2x(NH3)2], если степень окисления комплексообразователя равна +2: Заряд лиганда (CNS) равен:
-1; 2) 0; 3) +1; 4) +4.
Исследования магнитных свойств показали, что комплексный ион [Co(NH3)6]3+ проявляет диамагнитные свойства. Какой тип гибридизации атомных орбиталей возникает при образовании этого иона и каково его пространственное строение:
sp3 d2 – октаэдрическое; 2) d2sp3 – октаэдрическое;
3) d sp3 d – октаэдрическое; 4) d sp3 – квадратное?
Составьте координационную форму соединения PtCl2*2NH3; если комплексообразователем является ион Pt2+:
[Pt(NH3)2Cl2]; 2) [Pt(NH3)Cl3]-; 3) [Pt(NH3)3Cl]+; 4) [Pt(NH3)Cl4]2-?
