
- •Введение
- •1. Основные классы неорганических соединений
- •Примеры составления условий задач и их решения
- •1.1. Тесты. Основные классы неорганических соединений
- •2. Газовые законы. Простейшие стехиометрические законы
- •2.1. Взаимозависимые параметры состояния газов
- •Примеры составления условий задач и их решения
- •2.2. Химические эквиваленты
- •Примеры составления условия задач и их решения
- •2.3. Тесты. Стехиометрия химических превращений
- •3. Основные закономерности протекания химических реакций
- •3.1. Энергетика химических реакций. Химико-термодинамические расчеты
- •Примеры составления условий задач и их решения
- •3.2. Тесты. Энергетика химических реакций
- •3.3. Скорость химических реакций и химическое равновесие
- •Примеры составления условий задачи и их решение
- •3.4. Тесты. Химическая кинетика и равновесие
- •4. Окислительно – восстановительные процессы
- •4.1. Окислительно-восстановительные реакции
- •Ионно-электронный метод
- •Примеры составления условий задач и их решения
- •4.2. Тесты. Окислительно-восстановительные реакции
- •4.3. Гальванические элементы
- •Примеры составления условий задач и их решения
- •4.4. Электролиз
- •Примеры составления условий задач и их решения
- •1. Электролиз водного раствора Na2so4.
- •3. Электролиз водного раствора кВr.
- •4. Электролиз водного раствора СuCl2.
- •4.5. Тесты. Электрохимические элементы. Электролиз
- •4.6. Коррозия металлов
- •Механизм коррозии
- •Примеры составления условий задач и их решение
- •4.7. Тесты. Коррозия металлов
- •5. Растворы
- •5.1 Способы выражения содержания растворенного вещества в растворе
- •Примеры составления условий задач и их решения
- •5.2. Физико-химические свойства разбавленных растворов неэлектролитов
- •Свойства растворов неэлектролитов
- •Примеры составления условий задач и их решения
- •5.3. Растворы электролитов
- •В задачах 757–771 определить кажущуюся степень диссоциации водных растворов электролитов по их температурам кипения
- •5.4. Ионное произведение воды. Водородный показатель
- •Примеры составления задач и их решения
- •5.5. Молекулярно-ионные уравнения обменных реакций между растворами электролитов
- •Примеры составления задач и их решения
- •5.6. Произведение растворимости
- •Примеры составления задач и их решения
- •5.7. Гидролиз солей
- •Примеры составления задач и их решения
- •5.8. Тесты. Растворы
- •6. Строение атома
- •Примеры составления условий задач и их решения
- •6.1. Тесты. Строение атома
- •7. Комплексные соединения
- •Примеры составления задач и их решение
- •7.1. Тесты. Комплексные соединения
- •8. Химические свойства металлов
- •8.1. Взаимодействие металлов с водой
- •Примеры составления условий задач и их решения
- •8.2. Взаимодействие металлов с водными растворами щелочей
- •Взаимодействие металлов с расплавами щелочей
- •Примеры составления условий задач и их решения
- •8.4. Окислительные свойства концентрированной серной кислоты
- •8.5. Окислительные свойства азотной кислоты
- •Примеры составления условий задач и их решение
- •8.6. Окисление металлов катионами других металлов в водных растворах
- •8.7. Тесты. Химические свойства металлов
- •8.8. Тесты. S-, p-, d-, f – элементы и их соединения
- •9. Биологическая роль химических элементов в организме
- •Примеры составления условий задач и их решения
- •9.1. Тесты. Биологическая роль химических элементов в организме
- •Оглавление
1.1. Тесты. Основные классы неорганических соединений
Вариант 1
1. Укажите оксид, который при взаимодействии с водой образует сильное основание:
1) CuO; 2) Al2O3; 3) BaO; 4) Mn2O7; 5) SO2?
2. С какими из перечисленных ниже веществ будет реагировать оксид кадмия:
1) Ca(OH)2; 2) H2O; 3) NaNO3; 4) FeO; 5) V2O5?
3. Укажите оксид, который при взаимодействии с водой образует сильную кислоту:
1) TiO2; 2) SiO2; 3) Pb2O3; 4) CO2; 5) CrO3?
4. С какими из перечисленных ниже веществ будет реагировать оксид ванадия(V):
1) CaO; 2) SO3; 3) HNO3; 4) нет ответа; 5) K3PO4?
5. С какими из перечисленных ниже веществ будет реагировать оксид алюминия:
1) H2O; 2) NO; 3) Na2SO4; 4) Ba(OH)2; 5) нет ответа?
Вариант 2
1. Какие из приведенных пар оксидов могут при взаимодействии друг с другом образовывать соль
1) CrO3 и Cl2O; 2) BaO и TiO2; 3) SiO2 и CO; 4) CaO и Ag2O; 5) Cu и CO?
2. Какие из приведенных ниже соединений можно отнести к классу оксидов
1) Mn3O4; 2) KO3; 3) Na2O2; 4) Pb2O3; 5) Mn2O7?
3. Какой из приведенных ниже оксидов элементов 2 периода имеет ярко выраженный амфотерный характер
1) Li2O3; 2) BeO; 3) B2O3; 4) CO2; 5) SO2?
4. Как изменяются кислотно-основные свойства оксидов марганца (MnO – Mn2O3 – MnO2 – MnO3 – Mn2O7) с увеличением степени окисления марганца
1) не изменяются; 2) увеличиваются основные свойства; 3) увеличиваются кислотные свойства; 4) уменьшаются кислотные свойства; 5) нет ответа?
5. У какого из приведенных ниже оксидов элементов 5 группы сильнее выражены основные свойства
1) NO2; 2) Sb2O3; 3) P2O3; 4) As2O3; 5) Bi2O3?
Вариант 3
1. Как изменяются кислотно-основные свойства оксидов в периодах, например: Na2O – MgO – Al2O3 – SiO2
1) увеличиваются основные свойства; 2) уменьшаются кислотные свойства; 3) не изменяются 4) увеличиваются кислотные свойства; 5) нет ответа?
2. С какими из перечисленных ниже веществ будет реагировать оксид азота(II)
1) H2SO4; 2) KOH; 3) CaO; 4) MgO; 5) Cu(NO3)2?
3. Укажите уравнения реакции, на которой основан лабораторный метод получения оксида углерода(IV)
1) C + O2 →; 2) CO + O2 →; 3) CaCO3 + HCl →; 4) C + H2O →; 5) H2CO3 →?
4. Какие из указанных ниже веществ реагируют с гидроксидом калия
1) Ba(OH)2; 2) CuO; 3) Cu(OH)2; 4) NaHCO3; 5) CO?
5. Какая из реакций, схемы уравнений которых приведены ниже, обычно используется в лаборатории для получения гидроксида железа(III)
1) Fe(OH)2 + O2 + H2O →; 2) Fe + H2O →; 3) Fe2O3+H2O;
4) FeCl3+ H2O →;5) FeCl3+ 3KOH →?
Вариант 4
1. Какие из указанных ниже металлов реагируют с водой по схеме
Me + 2H2O → Me(OH)2 + H2
1) Zn; 2) Be; 3) Au; 4) Ca; 5) Fe?
2. Какие вещества образуются при взаимодействии цинка с водными растворами щелочи калия
1) Zn(OH)2, K; 2) K2[Zn(OH)]4, H2; 3) Zn(OH)2, H2; 4) K2ZnO2, H2O; 5) Zn(OH)2?
3. Какой из указанных ниже гидроксидов проявляет наиболее сильно выраженные основные свойства
1) Ge(OH)2; 2) Sn(OH)2; 3) Pb(OH)2; 4) Ge(OH)4; 5) PbO2·n H2O?
4. Какие из приведенных пар гидроксидов могут при взаимодействии друг с другом образовать соль
1) Ba(OH)2 и Pb(OH)2; 2) Mg(OH)2 и KOH; 3) Cd(OH)2 и Fe(OH)2; 4) нет ответа; 5) CsOH и LiOH?
5. Какая пара уравнений реакций из приведенных ниже не иллюстрирует амфотерный характер Be(OH)2
1) Be(OH)2 + 2 HCl → BeCl2 + 2 H2O
Be(OH)2 + 2 KOH →K2BeO2 + 2 H2O
2) Be(OH)2 + 2 KOH → K2[Be(OH)4]
Be(OH)2 + 4 HCl → H2[BeCl4] + 2 H2O
3) Be(OH)2
+
2 H+
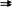 Be2+
+ 2 H2O
Be2+
+ 2 H2O
Be(OH)2 + 2 OH– → [Be(OH)4]2–
4) BeCl2 + 2 KOH → Be(OH)2 + 2 KCl
BeCl2 + H2O → BeOHCl + HCl
5) Be(OH)2 Be2+ + 2 OH–
Be(OH)2 → BeO22– + 2H+ ?
Вариант 5
1. Какие из перечисленных ниже кислот могут образовывать кислые соли
1) HCOOH; 2) HBr; 3) CH3COOH; 4) H2S; 5) HCN?
2. Какие из перечисленных ниже гидроксидов могут образовать основные соли
1) NH4OH; 2) CsOH; 3) NaOH; 4) CuOH; 5) Cu(OH)2?
3. Какая соль образуется при взаимодействии 1 моль ортофосфорной кислоты с 2 моль гидроксида калия
1) K3PO4; 2) K2HPO4; 3) K2HPO3; 4) K3PO3; 5) KH2PO4?
4. Какое соединение бария образуется при взаимодействии 1 моль карбоната бария с 1 моль угольной кислоты
1) BaCO3; 2) нет ответа; 3) (BaOH)2CO3; 4) Ba(HCO3)2; 5) Ba(OH)2?
5. Какое соединение меди образуется при взаимодействии 1 моль сульфата гидроксомеди(II) с 1 моль серной кислоты
1) CuSO4; 2) (CuOH)2SO4; 3) Cu(HSO4)2; 4) Cu(OH)2; 5) CuOH?
Вариант 6
1. Какое соединение кадмия образуется при взаимодействии 1 моль сульфата кадмия с 1 моль гидроксида калия
1) Cd(OH)2; 2) (CdOH)2SO4; 3) CdHSO4; 4) CdS; 5) Cd(HSO4)2?
2. Какое соединение железа образуется при взаимодействии 1 моль сульфата железа(III) с 3 моль гидроксида бария
1) [Fe(OH)2]2SO4; 2) FeOHSO4; 3) (FeOH)2SO4; 4) Fe(OH)3; 5) Ba(FeO2)2?
3. Какая из формул соответствует хлорной кислоте
1) HCl; 2) HClO4; 3) HClO3; 4) HClO; 5) HClO2?
4. Какая из формул соответствует соли гидротеллурида калия
1) KHTe; 2) K2TeO3; 3) KHTeO4; 4) K2Te; 5) KHTeO3?
5. Какая из формул соответствует соли плюмбита кальция
1) CaPbO4; 2) (CaOH)2PbO2; 3) CaPbO3; 4) CaPbO2; 5) CaPb?
Вариант 7
1. Какая из формул соответствует соли нитрата дигидроксоалюминия
1) Al(OH)2NO2; 2) AlOH(NO2)2; 3) AlOHNO3; 4) AlN; 5) Al(OH)2NO3?
2. Какая из формул соответствует соли хлорида оксовисмута(III)
1) Bi(OH)2Cl; 2) BiOCl; 3) BiCl3; 4) BiOHCl2; 5) BiOCl2?
3. Какая из формул соответствует соединению Pb3O4
1) PbPbO3; 2) Pb2PbO4; 3) Pb2O3·PbO; 4) PbO∙PbO2; 5) Pb2O3·PbO2?
4. Какая из реакций, схемы уравнений которых приведены ниже, может быть использована для получения сульфата дигидроксожелеза(III)
1) 2Fe(OH)3 + H2SO4; 2) Fe(OH)3+H2SO4; 3) Fe(OH)2 + H2SO4;
4) (FeOH)2SO4 + H2SO4; 5) FeSO4 + 1 KOH?
5. Какое взаимодействие приведет к получению дигидрофосфата калия
1) H3PO4 + 2KOH; 2) P2O5 + KOH; 3) H3PO4 + 1 KOH;
4) P2O3+KOH; 5) Ca3(PO4)2 + KOH?
Вариант 8
1. Какое взаимодействие приведет к получению нитрата меди(II) из нитрата гидроксомеди
1) CuOHNO3 + KOH; 2)Cu(OH)2 + 1 HNO3; 3) Cu(NO3)2 + 1 KOH;
4) Cu(NO3)2+2KOH; 5) CuOHNO3 + HNO3?
2. Какая из реакций, схемы уравнений которых приведены ниже, может быть использована для получения гидросульфида кальция
1) Ca(OH)2 + H2SO3; 2) Ca(OH)2 + (NH)4S; 3) Ca(OH)2 + 2H2S;
4) CaO + H2SO4; 5) Ca(OH)2+Na2S?
3. Какое взаимодействие приведет к получению хлорида висмута(III) из хлорида оксовисмута(III)
1) Bi(OH)2Cl → H2O + ; 2) BiCl3 + 1 KOH; 3) BiOHCl2 + 2 KOH;
4) Bi(OH)2Cl + HCl; 5) BiOCl + 2 HCl?
4. Какое взаимодействие приведет к получению гидрофосфата калия из дигидрофосфата калия
1) KH2PO4 + H3PO4; 2) K2HPO4 + HPO3; 3) KH2PO4 + 2 KOH; 4) K2HPO4 + KOH; 5) K3PO4 + H3PO4?
5. Какая из реакций, схемы уравнений которых приведены ниже, может быть использована для получения гидросульфата свинца
1) PbSO4 + 2 KOH; 2) PbSO4 + H2SO4; 3) (PbOH)2SO4 + H2SO4; 4) (PbOH)2SO4 + KOH; 5) PbSO4+KOH?
