
- •Введение
- •1. Основные классы неорганических соединений
- •Примеры составления условий задач и их решения
- •1.1. Тесты. Основные классы неорганических соединений
- •2. Газовые законы. Простейшие стехиометрические законы
- •2.1. Взаимозависимые параметры состояния газов
- •Примеры составления условий задач и их решения
- •2.2. Химические эквиваленты
- •Примеры составления условия задач и их решения
- •2.3. Тесты. Стехиометрия химических превращений
- •3. Основные закономерности протекания химических реакций
- •3.1. Энергетика химических реакций. Химико-термодинамические расчеты
- •Примеры составления условий задач и их решения
- •3.2. Тесты. Энергетика химических реакций
- •3.3. Скорость химических реакций и химическое равновесие
- •Примеры составления условий задачи и их решение
- •3.4. Тесты. Химическая кинетика и равновесие
- •4. Окислительно – восстановительные процессы
- •4.1. Окислительно-восстановительные реакции
- •Ионно-электронный метод
- •Примеры составления условий задач и их решения
- •4.2. Тесты. Окислительно-восстановительные реакции
- •4.3. Гальванические элементы
- •Примеры составления условий задач и их решения
- •4.4. Электролиз
- •Примеры составления условий задач и их решения
- •1. Электролиз водного раствора Na2so4.
- •3. Электролиз водного раствора кВr.
- •4. Электролиз водного раствора СuCl2.
- •4.5. Тесты. Электрохимические элементы. Электролиз
- •4.6. Коррозия металлов
- •Механизм коррозии
- •Примеры составления условий задач и их решение
- •4.7. Тесты. Коррозия металлов
- •5. Растворы
- •5.1 Способы выражения содержания растворенного вещества в растворе
- •Примеры составления условий задач и их решения
- •5.2. Физико-химические свойства разбавленных растворов неэлектролитов
- •Свойства растворов неэлектролитов
- •Примеры составления условий задач и их решения
- •5.3. Растворы электролитов
- •В задачах 757–771 определить кажущуюся степень диссоциации водных растворов электролитов по их температурам кипения
- •5.4. Ионное произведение воды. Водородный показатель
- •Примеры составления задач и их решения
- •5.5. Молекулярно-ионные уравнения обменных реакций между растворами электролитов
- •Примеры составления задач и их решения
- •5.6. Произведение растворимости
- •Примеры составления задач и их решения
- •5.7. Гидролиз солей
- •Примеры составления задач и их решения
- •5.8. Тесты. Растворы
- •6. Строение атома
- •Примеры составления условий задач и их решения
- •6.1. Тесты. Строение атома
- •7. Комплексные соединения
- •Примеры составления задач и их решение
- •7.1. Тесты. Комплексные соединения
- •8. Химические свойства металлов
- •8.1. Взаимодействие металлов с водой
- •Примеры составления условий задач и их решения
- •8.2. Взаимодействие металлов с водными растворами щелочей
- •Взаимодействие металлов с расплавами щелочей
- •Примеры составления условий задач и их решения
- •8.4. Окислительные свойства концентрированной серной кислоты
- •8.5. Окислительные свойства азотной кислоты
- •Примеры составления условий задач и их решение
- •8.6. Окисление металлов катионами других металлов в водных растворах
- •8.7. Тесты. Химические свойства металлов
- •8.8. Тесты. S-, p-, d-, f – элементы и их соединения
- •9. Биологическая роль химических элементов в организме
- •Примеры составления условий задач и их решения
- •9.1. Тесты. Биологическая роль химических элементов в организме
- •Оглавление
5.7. Гидролиз солей
Гидролиз солей относится к обменным реакциям, поскольку процесс идет без изменения степени окисления реагирующих веществ. Сущность реакций гидролиза состоит во взаимодействии ионов соли с ионами воды с образованием слабых электролитов. В процессе гидролиза один из ионов воды связывается в слабый электролит, а другой, как правило, накапливается в растворе. Тот ион, который накапливается в растворе, определяет реакцию среды. Если накапливаются ионы Н+, то среда будет кислой, если группы ОН – щелочной. При образовании одинаковых по силе электролитов среда может быть и нейтральной. Последний случай встречается редко.
Уравнения гидролиза пишутся аналогично другим ионным уравнениям: малодиссоциированные (в том числе и вода) и малорастворимые, а также газообразные вещества пишутся в виде молекул, сильные электролиты записываются в виде ионов. Уравнения гидролиза солей многоосновных кислот и многокислотных оснований записываются по ступеням, аналогично ступенчатой диссоциации.
Гидролиз солей, или их обменное взаимодействие с водой, происходит лишь в тех случаях, когда ионы, образующиеся в результате электролитической диссоциации соли–катион, анион или оба вместе, способны образовывать с ионами воды Н+ и ОН– – малодиссоциированные сочетания. Гидролизу подвергаются соли, образованные: слабыми кислотами и сильными основаниями; слабыми основаниями и сильными кислотами; слабыми кислотами и слабыми основаниями.
Если процесс гидролиза необходимо усилить, то следует разбавить раствор и повысить температуру.
Если необходимо уменьшить гидролиз солей, то к раствору добавляют кислоту или щелочь в зависимости от типа гидролизуемой соли.
Примеры составления задач и их решения
Задача 893
Какие из перечисленных ниже солей подвергаются гидролизу: NH4I, Na2S, Al(CH3COO)3, CaCl2?
Решение:
Иодид аммония - соль, образованная сильной кислотой и слабым основанием. Гидролиз соли: гидролизу подвергается катион соли. Реакция раствора кислая: рН<7.
NH4I + HOH NH4OH + HI.
Или в ионном виде:
NH4+ + HOH NH4OH + H+.
Сульфид натрия – соль, образованная сильным основанием и слабой кислотой.
При растворении солей многоосновных кислот гидролиз протекает ступенчато:
Na2S + H2O NaHS + NaOH.
Или в ионной форме:
S2– + H2O HS– + OH–.
Гидролизу подвергается анион соли. Процесс отражает гидролиз по первой стадии.
Чтобы гидролиз соли многоосновной кислоты прошел полностью, как правило, увеличивают температуру процесса:
 ,
,
или в ионной форме:
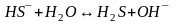 .
.
Раствор такой соли проявляет щелочную реакцию рН7.
Ацетат алюминия – соль, образованная слабым основанием и слабой кислотой. Гидролизу подвергается как катион, так и анион соли:
Al(CH3COO)3 + H2O AlOH(CH3COO)2 + CH3COOH.
Параллельно идут два процесса:
Al3+ + H2O AlOH2+ + H+,
CH3COO– + H2O CH3COOH + OH–.
В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих соль. Для гидролиза А1(СН3С00)3 реакция полученного раствора будет слабокислотной, поскольку константа диссоциации А1(OН)3 (К=1,3810-9) меньше константы диссоциации уксусной кислоты (К=I,7510-5).
Хлорид кальция - соль, образованная сильным основанием и сильной кислотой. Взаимодействие с водой можно представить таким образом:
CaCl2 + 2H2O Ca(OH)2 + 2HCl,
H2O H+ + OH–.
Однако единственным малодиссоциирующим соединением в реакции остается сама вода, следовательно, равновесие реакции полностью смещено влево - гидролиз не идет. Раствор соли проявляет нейтральную среду.
Реакция гидролиза представляет собой эндотермический процесс. Поскольку гидролиз является обычным равновесным процессом, то он зависит от всех тех факторов, которые влияют на равновесие реакций, и к нему применимо правило Ле-Шателье.
Задача 899
Вычислить константу гидролиза NН4Сl.
Решение:
Гидролиз соли, образованной слабым основанием и сильной кислотой, характеризуется константой гидролиза:
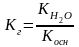 ,
,
где
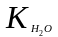 - ионное произведение воды; Косн
–
константа диссоциации основания.
- ионное произведение воды; Косн
–
константа диссоциации основания.
Из
табл. 7 приложения находим
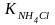 =
1,8
10-5
.
=
1,8
10-5
.
Отсюда
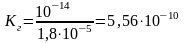 .
.
Задача 915
Вычислить степень гидролиза ZnCl2 по 1 ступени в 0,5 М растворе.
Решение:
Ионное уравнение гидролиза Zn2+ + H2O ZnOH+ + H+,
 =
1,510-9.
=
1,510-9.
Степень гидролиза вычисляем по формуле:
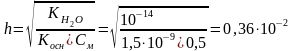 (0,36 %).
(0,36 %).
Степень гидролиза соли тем больше, чем меньше ее концентрация; иначе говоря, при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает.
При выполнении заданий рекомендуется использовать методические указания [2].
При решении задач по гидролизу использовать данные констант диссоциации некоторых электролитов, приведенные в табл. 9 приложения.
В задачах 860–893 указать, какие из перечисленных ниже солей подвергаются гидролизу. Для каждой из гидролизующихся солей написать в молекулярной и ионной форме уравнения гидролиза, указать реакцию водного раствора соли
№ Задачи |
|
|
|
CrCI3, Na2S, AI2S3, KNO3 Zn(NO3)2, NaNO2, Ba(NO3)2, (NH4)2S MnSO4, CH3COONH4, KCI, NaHSO3 Na2SiO3, CuSO4, NaBr, Pb(CH3COO)2 NaH2PO4, AI2(SO4)3, NH4CN, BaCI2 Ca(HS2), Fe(CN)2, Ni(NO3)2, NaCI HCOONH4, FeCI3, KHCO3, Li2SO4 (CuOH)2SO4, (NH4)2CO3, K2SO4, Ba(NO3)2 Cr2(SO4)3, K2S, Na2SO4, Cr2S3 Na3AsO4, CoSO4, NaCIO4, Al2S3 CsNO3, K2HAsO4, NH4CIO4, Cu(CH3COO)2 Na2TeO3, ZnSO4, KJ, Fe(HCOO)3 K2HAsO4, NH4Br, RbNO3, Al(CH3COO)3 CaS, SrCl2, MgSO4, (NH4)2SO3 K2Se, BaJ2, Pb(CH3COO)2, SnSO4 NH4CN, Mg(ClO4)2, Ca(HS)2, RbCl Ca(NO2)2, Li2CrO4, Cr2S3, Zn(NO3)2 (ZnOH)2SO4, NaAsO2, Fe(CN)2, K2SO4 Zn(CN)2, Li2SO3, MnSO4, (NH4)2CO3 Bi(NO3)2, Li2SiO3, KJ, (NH4)2CO3 SbCl3, K2CrO4, Zn(CN)2, CdSO4 CH3COOK, Fe2(SO4)3, BaCl2, Al2S3 Al2S3, CsNO3, NH4ClO4, K2Te K2Te, SnSO4, Cu(CN)2, NaNO3 CuOHCl, NaH2PO4, NaBr, Cu(CH3COO)2 SrS, FeCl3, NH4CN, K2SO4 K2CO3, NaNO2, NH4HCOO, LiCl NaClO3, (NH4)2SO4, CH3COOK, KNO3 CuCl2, Ca(CH3COO)2, Pb(NO3)2, NaBr FeCl3, (NH4)2CO3, Na3PO4, K2CrO4 NaHS, Al2S3, MnCl2, Ba(NO3)2 NaHSO3, MnJ2, (NH4)2S, KSCN NaClO4, Mg(CH3COO)2, Ni3(PO4)2, RbCl NH4J, Na2S, Al(CH3COO)3, CaCl2 |
В задачах 894–903 вычислить константу гидролиза
|
|
ацетата натрия формиата натрия ацетата калия карбоната калия ортофосфата калия |
|
хлорида аммония гипохлорида натрия цианида натрия гидрокарбоната калия сульфита калия |
В задачах 904–915 вычислить степень гидролиза
№ задачи |
|
|
|
Цианида калия в 0,1 Н растворе Ацетата калия в 0,1 М растворе 0,1 М раствора ортофосфата калия Карбоната натрия по I ступени в 0,2 М растворе Ортофосфата натрия по I ступени в 0,1 М растворе В 0,01 М растворе гидрокарбоната натрия Цианида аммония в 0,01Н растворе Хлорида аммония в 0,01 М растворе Гипохлорида калия в 0,001 М растворе В 0,06 М растворе нитрата свинца по I ступени Формиата лития в 0,001 н растворе Хлорида цинка по I ступени в 0,5 М растворе |
