
- •Введение
- •1. Основные классы неорганических соединений
- •Примеры составления условий задач и их решения
- •1.1. Тесты. Основные классы неорганических соединений
- •2. Газовые законы. Простейшие стехиометрические законы
- •2.1. Взаимозависимые параметры состояния газов
- •Примеры составления условий задач и их решения
- •2.2. Химические эквиваленты
- •Примеры составления условия задач и их решения
- •2.3. Тесты. Стехиометрия химических превращений
- •3. Основные закономерности протекания химических реакций
- •3.1. Энергетика химических реакций. Химико-термодинамические расчеты
- •Примеры составления условий задач и их решения
- •3.2. Тесты. Энергетика химических реакций
- •3.3. Скорость химических реакций и химическое равновесие
- •Примеры составления условий задачи и их решение
- •3.4. Тесты. Химическая кинетика и равновесие
- •4. Окислительно – восстановительные процессы
- •4.1. Окислительно-восстановительные реакции
- •Ионно-электронный метод
- •Примеры составления условий задач и их решения
- •4.2. Тесты. Окислительно-восстановительные реакции
- •4.3. Гальванические элементы
- •Примеры составления условий задач и их решения
- •4.4. Электролиз
- •Примеры составления условий задач и их решения
- •1. Электролиз водного раствора Na2so4.
- •3. Электролиз водного раствора кВr.
- •4. Электролиз водного раствора СuCl2.
- •4.5. Тесты. Электрохимические элементы. Электролиз
- •4.6. Коррозия металлов
- •Механизм коррозии
- •Примеры составления условий задач и их решение
- •4.7. Тесты. Коррозия металлов
- •5. Растворы
- •5.1 Способы выражения содержания растворенного вещества в растворе
- •Примеры составления условий задач и их решения
- •5.2. Физико-химические свойства разбавленных растворов неэлектролитов
- •Свойства растворов неэлектролитов
- •Примеры составления условий задач и их решения
- •5.3. Растворы электролитов
- •В задачах 757–771 определить кажущуюся степень диссоциации водных растворов электролитов по их температурам кипения
- •5.4. Ионное произведение воды. Водородный показатель
- •Примеры составления задач и их решения
- •5.5. Молекулярно-ионные уравнения обменных реакций между растворами электролитов
- •Примеры составления задач и их решения
- •5.6. Произведение растворимости
- •Примеры составления задач и их решения
- •5.7. Гидролиз солей
- •Примеры составления задач и их решения
- •5.8. Тесты. Растворы
- •6. Строение атома
- •Примеры составления условий задач и их решения
- •6.1. Тесты. Строение атома
- •7. Комплексные соединения
- •Примеры составления задач и их решение
- •7.1. Тесты. Комплексные соединения
- •8. Химические свойства металлов
- •8.1. Взаимодействие металлов с водой
- •Примеры составления условий задач и их решения
- •8.2. Взаимодействие металлов с водными растворами щелочей
- •Взаимодействие металлов с расплавами щелочей
- •Примеры составления условий задач и их решения
- •8.4. Окислительные свойства концентрированной серной кислоты
- •8.5. Окислительные свойства азотной кислоты
- •Примеры составления условий задач и их решение
- •8.6. Окисление металлов катионами других металлов в водных растворах
- •8.7. Тесты. Химические свойства металлов
- •8.8. Тесты. S-, p-, d-, f – элементы и их соединения
- •9. Биологическая роль химических элементов в организме
- •Примеры составления условий задач и их решения
- •9.1. Тесты. Биологическая роль химических элементов в организме
- •Оглавление
5.3. Растворы электролитов
При растворении электролита в воде увеличивается общее число частиц, т. к. электролиты диссоциируют на ионы и наблюдается отклонение от законов Вант-Гоффа и Рауля.
Это отклонение характеризуется изотоническим коэффициентом i, который показывает, во сколько раз осмотическое давление росм , повышение температуры кипения tкип, понижение температуры замерзания t’зам электролита, найденные экспериментально, больше соответствующих значений (Pосм, tкип, t’зам )для растворов неэлектролитов при той же молярной концентрации или моляльности.
Значение изотонического коэффициента для растворов электролитов больше 1, для растворов неэлектролитов равно 1.
Осмотическое давление для растворов электролитов с учетом изотонического коэффициента
Pосм = inRT/V=iTR СМ.
2-й закон Рауля для растворов сильных электролитов выражается уравнениями
tкип= im1Кэ1000/Мm2 и tзам= im1Кк1000/Мm2.
Изменение общего числа частиц в растворах электролитов характеризуется степенью электролитической диссоциации .
Степень диссоциации и изотонический коэффициент электролита связаны между собой соотношением
= i –1 / k-1,
где k – число ионов, образующихся при диссоциации молекулы вещества.
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты, диссоциированные на 30 % и больше, обычно называют сильными, диссоциированные в пределах от 30 до 3 % – электролитами средней силы, еще менее диссоциированные – слабыми электролитами.
Согласно новой электростатической теории электролитов, сильные электролиты в разбавленных растворах нацело диссоциированы на ионы, т.е. степень диссоциации = 1. Однако степень диссоциации определяется экспериментально и оказывается, как правило, меньше единицы ( < 1). Объясняется это тем, что измеряется всегда не истинная, а кажущаяся степень диссоциации. Так, если = 0,7, то все молекулы диссоциированы на ионы, но ионы свободны лишь на 70 %, остальные 30 % ионов «связаны» электростатическими взаимодействиями.
Слабые электролиты диссоциируют в растворах не полностью. В их растворах устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации - ионами.
Степенью диссоциации электролита называется доля его молекул, подвергшихся диссоциации, т.е. отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул электролита:
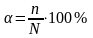 ,
,
где n – число молекул, распавшихся на ионы; N – общее число растворенных молекул.
В случае электролита АХ устанавливается равновесие
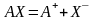 ,
,
константа которого (константа диссоциации) определяется соотношением
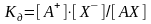 .
.
Для бинарного электролита АХ константа и степень диссоциации связаны соотношением (закон разбавления Оствальда):
Кд = СМ 2/1-,
где См – молярная концентрация электролита, моль/л.
Так как для слабых электролитов степень диссоциации значительно меньше единицы, то для приближенных расчетов можно принять 1 - 1. Тогда выражение закона Оствальда упрощается:
Кд = СМ 2, откуда
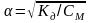 .
.
Если
в растворе электролита АХ степень его
диссоциации равна ,
то концентрации ионов А+
и
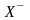 в
растворе одинаковы и могут быть найдены
по формуле [А+]
= [Х-]
=
СМ
.
в
растворе одинаковы и могут быть найдены
по формуле [А+]
= [Х-]
=
СМ
.
Подставив значение из выражения закона разбавления, находим
[А+]
= [
]
=
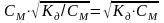 .
.
Задача 732
Раствор,
содержащий 2,1 г гидроксида калия в 250 г
воды, кристаллизуется при 0,52 °С. Определить
кажущуюся степень диссоциации КОН (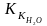 =
1,86).
=
1,86).
Решение:
Находим понижение температуры замерзания раствора без учета диссоциации электролита (∆tзам. выч.):
tзам. выч. = Кк m11000/Мm2 = 1,862,11000/56250 = 0,28 С.
Вычисляем изотонический коэффициент:
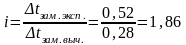 .
.
Находим кажущуюся степень диссоциации: КОН = К + + ОН– (k = 2),
= i-1/k-1 = 1,86-1/2-1 = 0,86 или 86 %.
Задача 746. Кажущаяся степень диссоциации карбоната натрия в растворе, содержащем 1,06 г Nа2СО3 в 200 г H2O, равна 0,70. Определить температуру замерзания этого раствора ( = 1,86).
Решение:
Находим изотонический коэффициент i из формулы
= i-1/k-1, i = 1+(k-1).
Na2CO3
= 2 Na++
СО32–
(k
= 3,
= 0,70 в долях единицы,
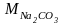 =
106 г/моль),
=
106 г/моль),
i=1 + 0,7 (3-1) = 2,4.
Вычисляем понижение температуры замерзания раствора
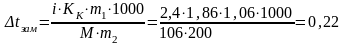 ,
,
tзам р-ра= tзам воды - tзам=0-0,22=-0,22С.
Задача
757. Раствор,
содержащий 10 г хлорида натрия в 100 г
воды, кипит при температуре 101,6 oC.
Определить кажущуюся степень диссоциации
NaCl
(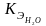 =
0,516).
=
0,516).
Решение:
Находим повышение температуры кипения раствора без учета диссоциации электролита (∆tкип. выч.):
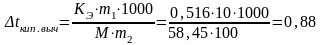 oC,
oC,
tкип. р-ра = tкип. р-теля + ∆tкип; ∆tкип. эксп = 101,6o – 100o = 1,6o.
Вычисляем изотонический коэффициент:
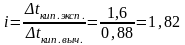 .
.
Находим кажущуюся степень диссоциации: NaCl = Na+ + Cl– (k = 2)
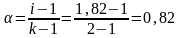 или
82 %.
или
82 %.
Задача 773
Найти степень диссоциации и концентрацию ионов Н+ сероводородной кислоты по первой ступени в 0,1М растворе, если константа диссоциации для этой ступени равна 1,110-7.
Решение:
Сероводородная кислота очень слабая, диссоциирует по уравнению
H2S = Н+ + HS–.
Используя упрощенное выражение закона разбавления Оствальда, вычисляем степень диссоциации:
 ;
;
= 1,0510-3100 = 0,105 %.
Концентрация ионов [Н+] = См = 0,11,0510–3 = 1,0510–4 моль/л.
В задачах 729–744 определить кажущуюся степень диссоциации электролитов по температуре замерзания раствора
№
|
Электролит |
Содержание воды, г |
Температура замерзания раствора,оС |
|
Формула |
Содержание |
|||
|
|
МgС12 ZnCI2 Nа2СО3 КОН KCI NaCI MgCl2 СаC12 А12(SO4)3 АgNO3 KNO3 НCI NaCI СаC12 СН3СООН NaCI |
3 г 0,85 г 0,53 г 2,1 г 4,47 г 14,62 г 0,1 моль 0,745 г 8 г 6,8 1моль 1,246 г 3г 0,117 моль 0,66 г 0,3668 г |
125 125 200 250 100 500 1000 100 25 400 1л 100 100 1000 100 100 |
-1,23 -0,23 -0,13 -0,52 -2,0 -1,67 -0,461 -0,36 -4,46 -0,337 -3,01 -1,18 -1,8 -0,6 -0,21 -0,22 |
В задачах 745–756 вычислить температуру замерзания водных растворов электролитов
№
|
Растворенное вещество |
Содержание растворителя, г |
Кажущаяся степень диссоциации, (%, долей единиц) |
|
Формула |
Содержание |
|||
|
|
СаС12 Na2CO3 AgNO3 KCI Na2SO4 СаС12 NaCI NaОН МgС12 MgSO4 NaNO3 KCI |
0,666 г 1,06 г 1 г 2,33 г 3,55 г 8 г 2 моль 100 г 0,1 н 0,01 н 0,1 моль 0,1 н |
125 200 50 500 500 мл 400 1000 100 - - 900 - |
0,75 0,7 0,59 0,8 70 % 70 % 70 % 60 % 0,75 66 % 80 % 0,8 |
