
- •Введение
- •1. Основные классы неорганических соединений
- •Примеры составления условий задач и их решения
- •1.1. Тесты. Основные классы неорганических соединений
- •2. Газовые законы. Простейшие стехиометрические законы
- •2.1. Взаимозависимые параметры состояния газов
- •Примеры составления условий задач и их решения
- •2.2. Химические эквиваленты
- •Примеры составления условия задач и их решения
- •2.3. Тесты. Стехиометрия химических превращений
- •3. Основные закономерности протекания химических реакций
- •3.1. Энергетика химических реакций. Химико-термодинамические расчеты
- •Примеры составления условий задач и их решения
- •3.2. Тесты. Энергетика химических реакций
- •3.3. Скорость химических реакций и химическое равновесие
- •Примеры составления условий задачи и их решение
- •3.4. Тесты. Химическая кинетика и равновесие
- •4. Окислительно – восстановительные процессы
- •4.1. Окислительно-восстановительные реакции
- •Ионно-электронный метод
- •Примеры составления условий задач и их решения
- •4.2. Тесты. Окислительно-восстановительные реакции
- •4.3. Гальванические элементы
- •Примеры составления условий задач и их решения
- •4.4. Электролиз
- •Примеры составления условий задач и их решения
- •1. Электролиз водного раствора Na2so4.
- •3. Электролиз водного раствора кВr.
- •4. Электролиз водного раствора СuCl2.
- •4.5. Тесты. Электрохимические элементы. Электролиз
- •4.6. Коррозия металлов
- •Механизм коррозии
- •Примеры составления условий задач и их решение
- •4.7. Тесты. Коррозия металлов
- •5. Растворы
- •5.1 Способы выражения содержания растворенного вещества в растворе
- •Примеры составления условий задач и их решения
- •5.2. Физико-химические свойства разбавленных растворов неэлектролитов
- •Свойства растворов неэлектролитов
- •Примеры составления условий задач и их решения
- •5.3. Растворы электролитов
- •В задачах 757–771 определить кажущуюся степень диссоциации водных растворов электролитов по их температурам кипения
- •5.4. Ионное произведение воды. Водородный показатель
- •Примеры составления задач и их решения
- •5.5. Молекулярно-ионные уравнения обменных реакций между растворами электролитов
- •Примеры составления задач и их решения
- •5.6. Произведение растворимости
- •Примеры составления задач и их решения
- •5.7. Гидролиз солей
- •Примеры составления задач и их решения
- •5.8. Тесты. Растворы
- •6. Строение атома
- •Примеры составления условий задач и их решения
- •6.1. Тесты. Строение атома
- •7. Комплексные соединения
- •Примеры составления задач и их решение
- •7.1. Тесты. Комплексные соединения
- •8. Химические свойства металлов
- •8.1. Взаимодействие металлов с водой
- •Примеры составления условий задач и их решения
- •8.2. Взаимодействие металлов с водными растворами щелочей
- •Взаимодействие металлов с расплавами щелочей
- •Примеры составления условий задач и их решения
- •8.4. Окислительные свойства концентрированной серной кислоты
- •8.5. Окислительные свойства азотной кислоты
- •Примеры составления условий задач и их решение
- •8.6. Окисление металлов катионами других металлов в водных растворах
- •8.7. Тесты. Химические свойства металлов
- •8.8. Тесты. S-, p-, d-, f – элементы и их соединения
- •9. Биологическая роль химических элементов в организме
- •Примеры составления условий задач и их решения
- •9.1. Тесты. Биологическая роль химических элементов в организме
- •Оглавление
3.4. Тесты. Химическая кинетика и равновесие
Вариант 1
Укажите математическое выражение закона действия масс для реакции 4NH3(г)+3О2(г)=2N2(г)+6Н2О(ж)
V= к C4NH3*C3O2; 2) V= к CNH3* CO2; 3) V= к CNH3* CO2*CN2*CH2O;
4) нет ответа; 5) V= к C4NH3* C3O2*C2N2*C6H2O?
У
 кажите
математическое выражение скорости
прямой реакции 3Fe(к)+4H2O(г)
Fe3O4(к)+4Н2(г)
кажите
математическое выражение скорости
прямой реакции 3Fe(к)+4H2O(г)
Fe3O4(к)+4Н2(г)
V= к С3Fe; 2) V= к СН2О; 3) V= к С4Н2О;
4) V= к С3Fe* С4Н2О; 5)V= к СFe* СН2О?
Укажите математическое выражение закона действия масс для реакции Ва(к)+2HCl(р) = BaCl2(р)+H2(г)
V= к CBa*C2HCl; 2) V= к CBa*CHCl; 3) V= к CBa*C2HCl*CBaCl2*CH2;
4) нет ответа; 5) V= к C2HCl?
Укажите математическое выражение скорости прямой реакции
MgCO3(к) MgO(к)+CO2(г)
V= к CMgCO3; 2) нет ответа; 3) V=к; 4) V=к CMgO*CCO2; 5) V=к CCO2?
В растворе проходит реакция по уравнению KCl(р)+HClO(р)=Cl2(г)+KOH(р)
Во сколько раз изменится скорость реакции при разбавлении реагирующей смеси в 6 раз
Уменьшится в 6 раз; 2) уменьшится в 12 раз; 3)увеличится в 12 раз;
4) уменьшится в 36 раз; 5) не изменится?
Вариант 2
Во сколько раз возрастет скорость реакции 2NO(г)+Cl2(г)=2NOCl(г) при увеличении давления в системе в 3 раза
В 27 раз; 2) в 9 раз; 3) в 6 раз; 4) в 2 раза; 5) в 18 раз?
Во сколько раз следует изменить (увеличить или уменьшить) давление, чтобы скорость образования NO2 по реакции 2NO(г)+O2(г)=2NO2(г) возросла в 1000 раз
Уменьшить в 100 раз; 2) увеличить в 1000 раз; 3) увеличить в 10 раз;
4) увеличить в 100 раз; 5) уменьшить в 10 раз?
В о сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2NO(г)+О2(г) 2NO2(г) при увеличении давления в 2 раза
в 2 раза; 2) в 4 раза; 3) в 3/2 раза; 4) в 0,5 раза; 5) в 2/3 раза?
Во сколько раз увеличится скорость реакции при повышении температуры от 400 до 700 С Температурный коэффициент равен 3
В 9 раз; 2) в 3 раза; 3) в 27 раз; 4) в 90 раз; 5) в 30 раз?
На сколько градусов необходимо понизить температуру, чтобы скорость реакции уменьшилась в 27 раз, если температурный коэффициент равен 3
на 90С; 2) на 300С; 3) на 810С; 4) на 30С; 5) на 270С?
Вариант 3
При повышении температуры на каждые 100С скорость некоторой химической реакции увеличивается в 4 раза. При какой температуре следует проводить реакцию, чтобы скорость реакции, идущей при 1000С, уменьшилась в 16 раз
при 200С; 2) при 400С; 3) при 800С; 4) при 1160С; 5) при 640С?
Кинетическое уравнение реакции CaO(к)+CO2(г)=CaCO3(к) имеет вид V=кССО2. Определите общий порядок реакции
первый; 2) второй; 3) третий; 4) нулевой; 5) дробный?
Определите порядок реакции С6Н6(г)+Br2(ж)=C6H5Br(ж)+HBr(г)
дробный; 2) нулевой; 3) третий; 4) второй; 5) первый?
При какой концентрации воды гидролитическое разложение сахара с образованием глюкозы и фруктозы С12Н22О11(р)+Н2О(р)=С6Н12О6(р)+С6Н12О6(р) является реакцией второго порядка
высокой; 2) средней; 3) низкой; 4) любой; 5) нет ответа?
Общий порядок реакции Н2(г)+I2(г)=2HI(г) равен 2. Чему равны частные порядки реакции по водороду и иоду
Нулевой порядок по водороду и первый по иоду;
Первый порядок по водороду и второй по иоду;
Нулевой порядок по водороду и иоду;
Второй порядок по водороду и иоду;
Первый порядок по водороду и иоду?
Вариант 4
Укажите выражение константы равновесия реакции
F e2O3(к)+3СО(г) 2Fe(к)+3СО2(г)
Кс=
 ;
2) Кс=
;
2) Кс= ;
3) Кс=
;
3) Кс=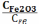 ;
;
4) Кс=
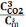 ;
5) Кс=
;
5) Кс=
 ?
?
Укажите выражение константы равновесия реакции
4 HCl(г)+O2(г) 2Cl2(г)+2Н2О(г)
Кр= ; 2) Кр=
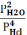 ;
3) нет ответа; 4) Кр=
; 5) Кр=
;
3) нет ответа; 4) Кр=
; 5) Кр=
 ?
?
Укажите выражение константы равновесия реакции
C l2(г)+Н2О(р) HCl(р)+HClO(р)
Кс= СCl2; 2) Кс=
 ;
3) Кс=
;
3) Кс=
 ;
;
4) Кс=
 ;
5) Кс=
;
5) Кс=
 ?
?
В ычислите константу равновесия реакции СО2(г)+2Н2(г) СН3ОН(г), если равновесные концентрации ССО2=0,3 моль/л, СН2=1,1 моль/л, ССН3ОН=2,1 моль/л
0,17; 2) 5,79; 3) 6,36; 4) 0,16; 5) 5,4?
В реакции Н2(г)+I2(г) 2HI(г) исходные концентрации Н2 и I2 равны каждая 1 моль/л. Вычислите равновесные концентрации веществ, если константа равновесия равна 50
нет ответа; 2) СН2=CI2=0.61, CHI=0,78; 3) CH2=CI2=0.22, CHI=1.56;
4) СH2=CI2=0.00, CHI=2.0; 5) CH2=CI2=0.5, CHI=1,0?
Вариант 5
Исходные концентрации оксида углерода и паров соответственно равны 0,08 моль/л. Вычислите равновесные концентрации СО, Н2О, Н2 в системе СО+Н2О СО2+Н2, если равновесная концентрация СО2 оказалась равной 0,05 моль/л. Рассчитайте константу равновесия реакции.
С СО=СН2О=0,03, СН2=0,05, Кс=2,78; 2) ССО=СН2О=0,03, СН2=0,05, Кс=0,36;
3) ССО=СН2О=0,13, СН2=0,05, Кс=1,47; 4) Нет ответа;
5) ССО=СН2О=0,13, СН2=0,05, Кс=6,76?
Д ействием каких факторов можно сместить вправо равновесие реакции СО2(г)+2Н2(г) СН3ОН(г); Н0=193,3 кДж
Введением катализатора; 2) понижением температуры 3) понижением давления; 4) увеличением концентрации СО2 или Н2; 5) увеличением объема реакционного сосуда?
Каким путем можно повысит выход СО2 в следующей реакции:
С аСО3(к) СаО(к)+СО2(г); Н0=179 кДж
Повысить давление; 2) понизить давление; 3) увеличить концентрацию CaO; 4) уменьшить концентрацию СаСО3; 5) нет ответа?
В каких из нижеприведенных обратимых реакций изменение давления не вызовет нарушения равновесия
Н ет ответа; 2) СО(г)+Н2О(г) СО2+Н2(г);
3 )СОСl2(г) СО(г)+Cl2(г); 4) MgCO3(к) MgO(к)+СО2(г);
5 ) 2NO(г)+O2(г) 2NO2(г)?
К ак следует одновременно изменить температуру и давление в системе CO2(г)+С(графит) 2СО(г); Н<0, что бы повысить выход оксида углерода
увеличить температуру и давление;
уменьшить температуру и давление;
уменьшить температуру, увеличить давление;
увеличить температуру, уменьшить давление;
температуру не изменять, давление увеличить.
