
- •Введение
- •1. Основные классы неорганических соединений
- •Примеры составления условий задач и их решения
- •1.1. Тесты. Основные классы неорганических соединений
- •2. Газовые законы. Простейшие стехиометрические законы
- •2.1. Взаимозависимые параметры состояния газов
- •Примеры составления условий задач и их решения
- •2.2. Химические эквиваленты
- •Примеры составления условия задач и их решения
- •2.3. Тесты. Стехиометрия химических превращений
- •3. Основные закономерности протекания химических реакций
- •3.1. Энергетика химических реакций. Химико-термодинамические расчеты
- •Примеры составления условий задач и их решения
- •3.2. Тесты. Энергетика химических реакций
- •3.3. Скорость химических реакций и химическое равновесие
- •Примеры составления условий задачи и их решение
- •3.4. Тесты. Химическая кинетика и равновесие
- •4. Окислительно – восстановительные процессы
- •4.1. Окислительно-восстановительные реакции
- •Ионно-электронный метод
- •Примеры составления условий задач и их решения
- •4.2. Тесты. Окислительно-восстановительные реакции
- •4.3. Гальванические элементы
- •Примеры составления условий задач и их решения
- •4.4. Электролиз
- •Примеры составления условий задач и их решения
- •1. Электролиз водного раствора Na2so4.
- •3. Электролиз водного раствора кВr.
- •4. Электролиз водного раствора СuCl2.
- •4.5. Тесты. Электрохимические элементы. Электролиз
- •4.6. Коррозия металлов
- •Механизм коррозии
- •Примеры составления условий задач и их решение
- •4.7. Тесты. Коррозия металлов
- •5. Растворы
- •5.1 Способы выражения содержания растворенного вещества в растворе
- •Примеры составления условий задач и их решения
- •5.2. Физико-химические свойства разбавленных растворов неэлектролитов
- •Свойства растворов неэлектролитов
- •Примеры составления условий задач и их решения
- •5.3. Растворы электролитов
- •В задачах 757–771 определить кажущуюся степень диссоциации водных растворов электролитов по их температурам кипения
- •5.4. Ионное произведение воды. Водородный показатель
- •Примеры составления задач и их решения
- •5.5. Молекулярно-ионные уравнения обменных реакций между растворами электролитов
- •Примеры составления задач и их решения
- •5.6. Произведение растворимости
- •Примеры составления задач и их решения
- •5.7. Гидролиз солей
- •Примеры составления задач и их решения
- •5.8. Тесты. Растворы
- •6. Строение атома
- •Примеры составления условий задач и их решения
- •6.1. Тесты. Строение атома
- •7. Комплексные соединения
- •Примеры составления задач и их решение
- •7.1. Тесты. Комплексные соединения
- •8. Химические свойства металлов
- •8.1. Взаимодействие металлов с водой
- •Примеры составления условий задач и их решения
- •8.2. Взаимодействие металлов с водными растворами щелочей
- •Взаимодействие металлов с расплавами щелочей
- •Примеры составления условий задач и их решения
- •8.4. Окислительные свойства концентрированной серной кислоты
- •8.5. Окислительные свойства азотной кислоты
- •Примеры составления условий задач и их решение
- •8.6. Окисление металлов катионами других металлов в водных растворах
- •8.7. Тесты. Химические свойства металлов
- •8.8. Тесты. S-, p-, d-, f – элементы и их соединения
- •9. Биологическая роль химических элементов в организме
- •Примеры составления условий задач и их решения
- •9.1. Тесты. Биологическая роль химических элементов в организме
- •Оглавление

Т.В. Скрипко
Общая и неорганическая химия
Омск - 2011
Государственное образовательное учреждение высшего профессионального образования
«Омский государственный технический университет»
Т.В. Скрипко
Общая и неорганическая химия
Практикум
Омск - 2011
УДК 54 + 546(075)
ББК 24я 73
С 45
Рецензенты:
И.А. Бобренко доктор с.-х. наук, декан факультета агрохимии, почвоведения и экологии ФГОУ ВПО ОмГАУ
Н.А. Воронкова, канд. с.-х. наук, доцент, ГНУ СибНИИСХ СО Россельхозакадемии.
Скрипко Т.В.
С 45 Общая и неорганическая химия: практикум. 2-е изд., перераб. И доп. – Омск: Изд-во ОмГТУ, 2011 – 211 с.
Пособие содержит широкий набор задач, охватывающий раздел курса. Каждому разделу предпосланы краткое теоретическое введение и примеры с детальным разбором решения задач. Тематические тесты представляют собой задания для контроля и самоконтроля знаний.
Из текста задач исключен весь справочный материал, который помещен в приложении. Поиски необходимых данных создадут у студентов предпосылки к выработке полезной привычки обращения к справочной литературе.
Пособие предназначено для студентов всех форм обучения, изучающих общую и неорганическую химию.
Введение
|
Развитие и образование ни одному человеку не могут быть даны или сообщены. Всякий, кто желает к ним приобщиться, должен достигнуть этого собственной деятельностью, собственным напряжением. А. Дистервег
|
Одной из основных задач методики обучения в высшей школе является разработка наиболее эффективных методов обучения и контроля знаний. Эффективность обучения определяется многими факторами и прежде всего активизацией самостоятельной работы студентов над изучаемым курсом.
Основным видом самостоятельной работы является проработка лекционного материала по конспекту, учебнику и методическим разработкам. Для более четкого усвоения материала, активизации самостоятельной работы и систематического самоконтроля в межсессионный период студентам необходимо выполнить индивидуальные домашние задания на основе раздела общетеоретической части курса.
Пособие содержит широкий набор задач, расположенных в логической последовательности изложения курса. Каждому разделу предпослано краткое теоретическое введение и примеры с детальным разбором хода решения типовых задач.
Домашнее задание выполняется в отдельной тетради, причем каждая задача решается на отдельном листе с указанием темы задания, номера задачи и составленного полного условия задачи. Если задача не зачтена, ее нужно выполнить вторично с учетом замечаний на том же месте, где она выполнялась в первый раз.
При решении расчетных задач необходимо приводить уравнения реакций, математическое выражение законов и правил (формулы), числовые значения констант. Необходимо указывать весь ход решения задач и все математические преобразования. Домашнее задание должно быть аккуратно оформлено.
Тестовые задания рассчитаны на проверку различной глубины знаний на уровне не только запоминания, но и понимания, умения использовать знания для решения расчетных и теоретических задач, написания уравнений
химических реакций, объяснения различных явлений. Вопросы сформулированы в вопросительной, повествовательной или повелительной форме. Разнообразие форм вопросов активизирует мыслительный процесс у студентов. Несовпадение (или неполное совпадение) выбранных ответов с приведенными в конце пособия укажет студенту на необходимость повторной проработки соответствующего материала дисциплины. Представленный спектр задач – материал и для контрольных работ по темам дисциплины. Основная цель контрольных работ – закрепление знаний, анализ и контроль освоения студентом программного материала. Пособие предназначено для студентов всех форм обучения.
Автор благодарит рецензентов доктора с.-х. наук И.А. Бобренко, канд. с.-х. наук доцента Н.А. Воронкову за внимание, проявленное к работе, а так же инженера Е.В. Нагибина за техническую помощь в подготовке рукописи.
1. Основные классы неорганических соединений
Фундаментом для изучения химии является четкое представление о классах неорганических соединений и их свойствах. Внимательно изучив раздел о классах неорганических соединений, можно дать ответ, какие соединения называют оксидами, кислотами, основаниями, солями.
Общие свойства этих соединений приведены ниже в виде схем.

При выполнении заданий рекомендуется использовать материал практикума[1].
Для правильного составления химических уравнений необходимо использовать Прил. 1.2.
Генетическую связь между классами неорганических веществ можно изобразить следующей схемой:
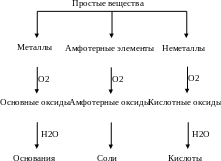
Эти схемы можно использовать при написании химических уравнений и при решении задач.
