
- •9 Класс введение
- •Тема урока. Периодический закон, периодическая система химических элементов д. И. Менделеева. Химическая связь, строение вещества
- •Ход урока
- •I. Организация класса.
- •II. Проверка домашнего задания.
- •III. Актуализация опорных знаний.
- •III. Обобщение и систематизация изученного материала
- •1. Строение атома. Принцип заполнения электронных орбиталей.
- •1. Принцип Паули.
- •2. Энергия орбиталей возрастает в ряду:
- •3. Правило Хунда.
- •IV. Подведение итогов урока
- •V. Домашнее задание
9 Класс введение
Урок 2
Тема урока. Периодический закон, периодическая система химических элементов д. И. Менделеева. Химическая связь, строение вещества
Цели урока:
- обобщить и систематизировать знания учащихся о периодическом законе химических элементов Д.И. Менделеева;
- повторить свойства химических элементов и веществ, образованных этими элементами;
- расширить представления учащихся о строении атома, связи между строением атомов и их положением в периодической системе;
- повторить виды химической связи, типы кристаллических решеток, связь между строением атомов, химической связью и строением вещества.
Тип урока: обобщение и систематизации знаний.
Оборудование: Периодическая система химических элементов
Д. И. Менделеева, карточки с задачами.
Ход урока
I. Организация класса.
II. Проверка домашнего задания.
III. Актуализация опорных знаний.
Вспомнить с помощью опорных конспектов за 8 класс (в тетрадях для самообразовательной деятельности) и дать ответы на следующие вопросы:
1) Приведите формулировку периодического закона Д. И. Менделеева.
2) Приведите современную формулировку периодического закона.
3) Изобразите строение атома и иона
а) хлора;
б) Натрия.
4) Изобразите электронную схему образования молекулы между этими атомами, укажите тип химической связи.
5) Укажите положение в периодической системе сильнейшего металла. Обоснуйте свое мнение.
6) Укажите положение в периодической системе сильнейшего неметалла. Обоснуйте свое мнение.
7) Какое место в периодической системе занимают инертные элементы?
III. Обобщение и систематизация изученного материала
1. Строение атома. Принцип заполнения электронных орбиталей.
В химических реакциях ядра атомов остаются без изменений, меняется лишь строение электронных оболочек вследствие перераспределения электронов между атомами. Способностью атомов отдавать или присоединять электроны определяются их химические свойства.
Как определяется положение электронов в атоме?
Электрон имеет двойную (корпускулярно-волновую) природу. Электроны в атоме могут иметь только четко определенные значения энергии, которые зависят от расстояния до ядра. Электроны, имеющие близкие значения энергии, образуют энергетический уровень. Он содержит определенное количество электронов - максимально 2n2. Энергетические уровни подразделяются на s-, p-, d- и f-подуровни; их число равно номеру уровня.
Квантовые числа электронов
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг своей оси.
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облачка. Имеет целые значения (n = 1, 2, 3 ...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и внешний энергетический уровень.
Задание 1.
Назовите число энергетических уровней в атоме элемента: Ферум, Натрий, Сера, кремний, Бром, Радий.
Что такое электронная орбиталь?
Какие формы могут приобретать электронные орбитали?
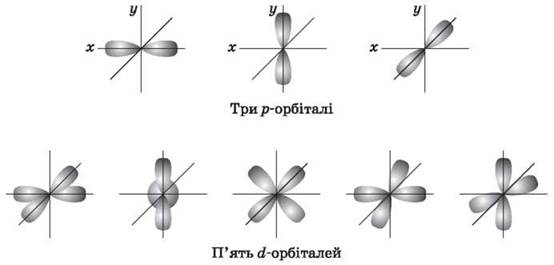
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Имеет значение целых чисел от 0 до (n-1). Независимо от номера энергетического уровня каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, с одинаковыми n и l - подуровнем.
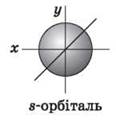
Для l = 0 s-подуровень, s-орбиталь - орбиталь сфера;
l = 1 р-подуровень, р-орбиталь - орбиталь гантель;
l = 2 d-подуровень, d-орбиталь - орбиталь сложной формы;
l = 3 f-подуровень, f-орбиталь - орбиталь еще более сложной формы.
Вспомните, какие электроны могут располагаться на первом уровне; на втором уровне; на третьем уровне. (Заполняем таблицу)
Номер уровня |
Максимальное количество электронов |
Подуровни |
1 |
2 |
s |
2 |
8 |
s, р |
3 |
18 |
s, р, d |
4 |
32 |
s, р, d, f |
5 |
50 |
s, р, d, f, g |
Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве.
Для s-орбитали (l = 0 такое положение одно и соответствует m = 0 Сфера не может иметь разные ориентации в пространстве.
Для р-орбитали (l = 1 - три равноценные ориентации в пространстве. Для d-орбитали (l = 2) - пять равноценных ориентаций в пространстве.
Итак, на s-подуровне - одна, на р-подуровне - три, на d-подуровне - пять, на f-подуровне - семь орбиталей.
Что такое «спин»?
Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Может иметь только два значения: +1/2 и -1/2, соответствующие противоположным направлениям вращения.
Принципы заполнения орбиталей
