
- •П.2. Гибридизация атомов углерода в органических соединениях.
- •Электрон имеет заряд минус один!!! Во всех стабильных соединениях углерод практически всегда четырехвалентен!!!
- •Запомнить:
- •П. 3.2. Формальный и частичный заряды атомов в молекулах и ионах.
- •П. 3.3. Определение формального заряда атома в соединении или ионе.
- •П.4. Понятие об индуктивном эффекте заместителей.
- •П.5. Влияние индуктивного эффекта заместителей на стабильность карбокатионов и карбанионов.
- •П.6. Мезомерный эффект заместителей. Теория резонанса.
- •П.7. Реакции электрофильного присоединения в ряду алкенов.
- •П.8. Реакции нуклеофильного замещения.
П.7. Реакции электрофильного присоединения в ряду алкенов.
Молекула этена является плоской, что обычно объясняют sp2‑гибридным состоянием углеродных атомов в ней. При этом каждый из атомов углерода образует три σ‑связи (одну связь С‑С и две С‑Н) за счет трех sp2‑гибридных орбиталей. Эти связи лежат в одной плоскости – плоскости молекулы. Перпендикулярно ей располагаются две р‑орбитали, по одной у каждого из атомов углерода, за счет относительно малоэффективного бокового перекрывания которых образуется π‑связь С‑С.
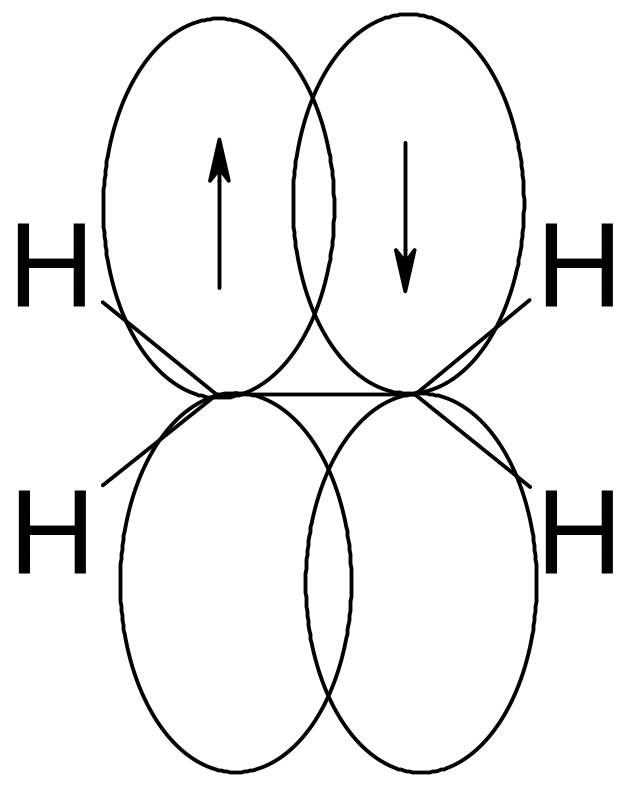
π-Связь С–С заметно слабее σ-связи С‑С, а поэтому достаточно легко рвется. Это обеспечивает повышенную реакционную способность ненасыщенных соединений и легкость их вступления в реакции присоединения, продуктами которых являются не содержащие π‑связей насыщенные соединения:

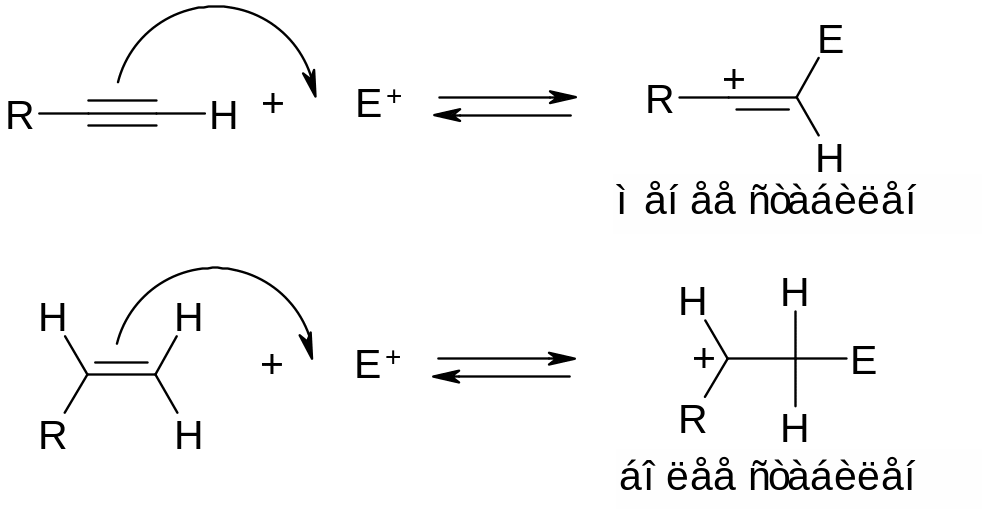
Ввиду пространственной доступности двух электронов π‑связи, этен (как и другие алкены) проявляет нуклеофильные (хотя и относительно слабые) свойства и на первой стадии реагирует с электрофильной частицей Е+, что позволяет относить реакцию взаимодействия алкена с регентом типа ENu к реакциям электрофильного присоединения. При этом на первой стадии происходит гетеролитический разрыв относительно слабой π‑связи и образование новой связи С-Е по донорно‑акцепторному механизму (за счет двух электронов ранее образовывавших π‑связь и пустой орбитали электрофила). На приведенной ниже схеме стрелкой изображено перемещение электронной пары: эта стрелка начинается РОВНО посередине связи С=С, где располагалось два электрона, образующих π‑связь, и заканчивается между атомами С и Е, поскольку эта электронная пара идет на образование ковалентной связи С‑Е.

Присоединение галогеноводородов: промежуточное образование карбокатиона и направление присоединения к гомологам этена.
Галогеноводороды являются типичными реагентами, способными присоединяться по двойной углерод‑углеродной связи алкенов. Наиболее легко реагирует йодистый водород, в то время как с фтороводородом реакция протекает медленнее, что связано с его более слабыми кислотными свойствами.
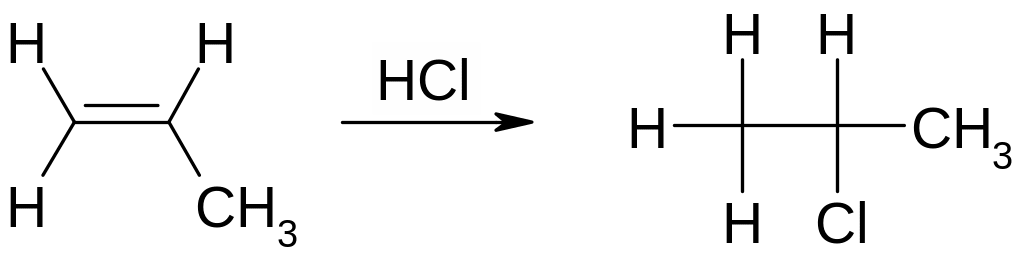
Механизм реакции рассмотрим на примере взаимодействия этена с хлороводородом. Последний является источником протонов (электрофильные частицы) и хлорид‑ионов (нуклеофильные частицы). Образующийся на первой стадии при взаимодействии этена с протоном этильный катион С2Н5+ (такие частицы называют карбокатионами) крайне малостабилен, поскольку один из атомов углерода в этой частице трехвалентен. Например, он может превратиться в исходную молекулу этена за счет протекания обратной реакции. Ввиду наличия у электронодефицитного атома углерода (С+) пустой орбитали, этильный карбокатион обладает электрофильным характером. Это определяет возможность быстрого и практически необратимого взаимодействия образующегося С2Н5+ (ввиду малой стабильности этой частицы) с какой-нибудь из нуклеофильных частиц, присутствующих в реакционной смеси, что приводит к образованию устойчивого продукта реакции. Например, при взаимодействии этена с хлороводородом получается хлорэтан:

Присоединение галогеноводородов к несимметричным олефинам происходит в соответствии с правилом В. В. Марковникова: водород присоединяется преимущественно к наиболее гидрогенизированному, то есть наименее замещенному, атому углерода. Например, при взаимодействии пропена с хлороводородом предпочтительно образуется 2-хлорпропан, а не изомерный ему 1-хлорпропан.
В отличие от этена, присоединение протона в данном случае может приводить к двум изомерным карбокатионам I и II (см. схему ниже). Оба эти катиона крайне реакционоспособны, поскольку один из атомов углерода в них трехвалентен. Считается, однако, что катион II более стабилен, чем I, что ведет к предпочтительному образованию в качестве промежуточной частицы именно карбокатиона II. Последнее обстоятельство, в свою очередь, обусловливает образование 2-хлорпропана в качестве основного продукта реакции.
Катионы I и II являются типичными примерами алкильных катионов, в которых электрофильный атом углерода (то есть С+) образует связи либо с атомами водорода, либо с алкильными группами (этильной, как в случае I или двумя метильными, как в случае II). По количеству алкильных групп при электронодефицитном атоме углерода карбокатионы делят на первичные, вторичные и третичные. Так, катион I – первичный, а II – вторичный.

Основным фактором, определяющим стабильность карбокатионов, является степень размытости, иначе говоря, делокализации положительного заряда в них. Чем более делокализован этот положительный заряд, тем более стабилен карбокатион. Таким образом, для карбокатиона крайне невыгодно, если весь положительный заряд, которым обладает частица, сосредоточен на электронодефицитном атоме углерода (С+), но выгодно, если за счет смещения электронной плотности от соседних электронодонорных групп заряд электронодефицитного атома углерода (С+) частично погашается. Эффективность делокализации положительного заряда, следовательно, зависит от количества заместителей при карбокатионном центре и их электронных эффектов.
Алкильные группы являются электронодонорными (по сравнению с атомом водорода) и проявляют т.н. положительный индуктивный эффект (+I). Это означает, что они более эффективно, чем атом водорода, поставляют электроны к электронодефицитному атому углерода, имеющему формальный заряд +1, что обеспечивает бо́льшую делокализацию положительного заряда и, как результат, большую стабильность этильного катиона.

Получается, что при замене одного из атомов водорода в СН3+ на донорную группу стабильность катиона повышается. Нетрудно понять, что и последующая замена атомов водорода при электрофильном центре на метильные (или другие алкильные) группы повышает стабильность частицы.

Представление об отрицательном индуктивном эффекте тригалогенметильной группы. Направление присоединения к двойной связи в молекулах 3,3,3-тригалогенпропенов.
Понятно также, что если замена атомов водорода в метильном катионе на электронодонорные (+I-эффект) заместители обеспечивает стабилизацию карбокатиона, то замена атомов водорода на электроноакцепторные (‑I‑эффект) заместители понижает стабильность катиона, поскольку приводит к повышению реального положительного заряда (δ+) на карбокатионном центре. Примером групп, обладающих ‑I‑эффектом, могут служить тригалогенметильные группы. Их электроноакцепторный характер обусловлен наличием в них атомов галогена, обладающих высокой электроотрицательностью. Группы CN, NO2, CO2CH3 и др. также являются электроноакцепторными и обладают ‑I‑эффектом.

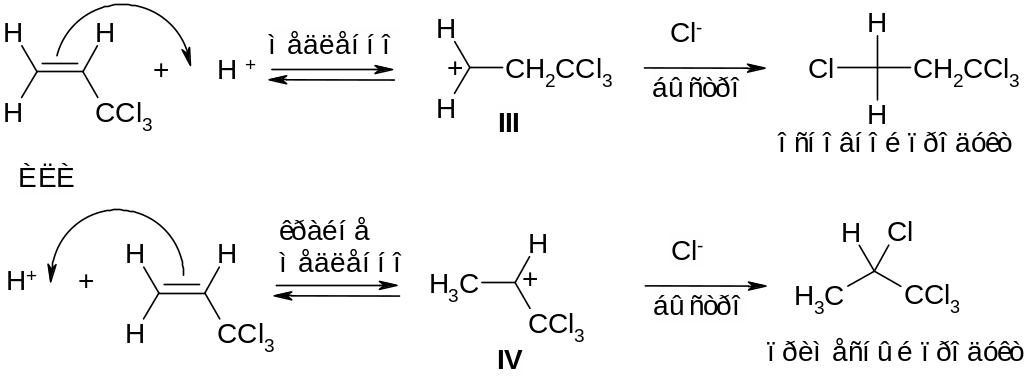
Именно поэтому галогеноводороды присоединяются по двойной углерод‑углеродной связи 3,3,3‑тригалогенпропенов против правила Марковникова: водород присоединяется преимущественно к наименее гидрогенизированному, то есть наиболее замещенному, атому углерода.
Поясним направление присоединения в данных реакциях на примере взаимодействия 3,3,3‑трихлорпропена с хлороводородом. Присоединение протона может привести к образованию двух изомерных катионов: III и IV. Однако IV существенно дестабилизирован (несмотря на то, что он вторичный!) за счет наличия при карбокатионном центре акцепторной трихлорметильной группировки. Первичный катион III в данном случае сравнительно более стабилен и поэтому образуется преимущественно. Последующее взаимодействие хлорид‑аниона с катионом III приводит к основному продукту реакции.
Реакция гидратации алкенов, роль кислотного катализатора.
Реакция взаимодействия алкенов с водой, приводящая к соответствующему спирту, катализируется минеральными кислотами. Направление гидратации алкенов определяется правилом Марковникова, поэтому предполагается, что в качестве промежуточной частицы в этой реакции выступает карбокатион, образующийся за счет взаимодействия алкена с протоном.
Рассмотрим более подробно механизм взаимодействия пропена с водой, ведущего к пропанолу‑2, в присутствии кислотного катализатора. Электрофильные свойства молекулы воды выражены слабо, поскольку она является очень слабой кислотой. Таким образом, вода не может непосредственно вступать в реакцию со слабонуклеофильной молекулой пропена. Первым по двойной углерод-углеродной связи алкена должен присоединиться электрофил, к примеру протон, катализирующий процесс. Реакция протекает по правилу Марковникова и ведет к более стабильному из двух возможных карбокатиону II (см. ранее). Последний, являясь электрофильной частицей, взаимодействует с нуклеофильной молекулой воды (за счет неподеленных электронных пар атома кислорода), что ведет к катиону V. Последний является производным иона гидроксония Н3О+, в котором один из атомов водорода заменен на изопропильный радикал. Отщепление протона от катиона V приводит к продукту реакции и регенерации катализатора (протона).

Особенности механизма взаимодействия алкенов с галогенами.
Хлор и бром активно реагируют с алкенами с образованием продуктов присоединения по кратной связи. Реакция алкенов с фтором протекает слишком бурно и приводит к продуктам деструкции углеродного скелета даже при пониженной температуре. Присоединение йода к алкенам в большинстве случаев представляет собой обратимую реакцию, равновесие которой смещено в сторону исходных реагентов.
Рассмотрим механизм взаимодействия пропена с бромом. В качестве электрофильной частицы выступает сама молекула брома. При ее взаимодействии с пропеном одновременно происходит гетеролитический разрыв π‑связи С‑С, гетеролитический разрыв связи Br‑Br и образование связи С‑Br по донорно‑акцепторному механизму (за счет двух электронов, ранее образовывавших π‑связь). По сути дела, молекула брома в этом процессе служит источником электрофильных частиц Br+, которые и присоединяются по двойной углерод‑углеродной связи. Присоединение электрофила при этом происходит так, чтобы образовался более стабильный (в данном случае вторичный) карбокатион VI.

Ранее мы рассматривали процесс присоединения протона Н+ к молекуле пропена, что приводило к изопропильному катиону II. Образование катиона VI исходя из пропена в целом происходит аналогично. В последнее время, однако, появились веские доводы в пользу того, что строение карбокатиона VI существенно отличается от строения изопропильного катиона II. Это отличие связано с тем, что протон Н+ не имеет неподеленных электронных пар, тогда как Br+ обладает тремя парами электронов. За счет одной из неподеленных электронных пар атома брома и пустой орбитали карбокатионного центра (С+) в катионе VI происходит образование по донорно‑акцепторному механизму еще одной связи С‑Br. Получающаяся при этом частица называется ионом бромония, ее строение можно отразить формулой VII:

Промежуточным образованием иона бромония принято объяснять тот факт, что при взаимодействии циклогексена с бромом получается транс‑1,2‑дибромциклогексан, то есть процесс присоединения брома по связи С=С алкенов протекает как транс‑присоединение.
При реакции между бромом и циклогексеном промежуточно образуется ион бромония VIII. На рисунке изображен случай, когда атака молекулы брома осуществлялась сверху относительно плоскости двойной углерод‑углеродной связи, хотя следует понимать, что такая атака равновероятно могла осуществляться и с нижней стороны этой плоскости. В ионе бромония VIII атом брома образует ковалентные связи с обоими атомами углерода бывшей связи С=С, что по пространственным причинам затрудняет последующую атаку бромид-иона сверху. Эта атака вынужденно происходит с обратной строны, в данном случае снизу, и ведет к транс‑дибромиду.

Сопряжение двойных связей в молекуле 1,3-бутадиена и способы его доказательства. Особенность протекания реакций электрофильного присоединения к бутадиену‑1,3.
Наличие в органическом соединении двух двойных углерод‑углеродных связей обусловливает схожесть его свойств с поведением алкенов. К примеру, химические свойства гексадиена-1,5 в основном аналогичны свойствам этена или пропена, за тем лишь исключением, что этот диен способен взаимодействовать не с одним, а с двумя молями хлороводорода, брома, воды и т.д. При использовании одного моля реагента можно получить продукт моноприсоединения, содержащий только одну связь С=С.

В молекуле гексадиена‑1,5 две двойные связи С=С отделены друг от друга двумя метиленовыми группами СН2. Это соединение относится к так называемым изолированным диенам. Однако, если между связями С=С в диене нет метиленовых групп, т.е. они отделены лишь одинарной связью С‑C, как это имеет место в бутадиене‑1,3, то такие вещества проявляют и некоторые специфические химические свойства. Это связывают с наличием в молекулах таких диенов системы сопряжения двойных углерод‑углеродных связей. Две связи С=С при этом не являются независимыми, они сопряжены и оказывают существенное влияние на свойства друг друга. Бутадиен‑1,3 в связи с этим относится к классу сопряженных диенов.
Рассмотрим строение молекулы бутадиена‑1,3 более подробно. Эту молекулу можно сравнить с двумя объединенными молекулами этена. Каждый из атомов углерода в бутадиене‑1,3 находится в состоянии sp2 гибридизации и образует за счет sp2 гибридных орбиталей три σ‑связи, лежащие в одной плоскости. За счет перекрывания двух пар р‑орбиталей (у атомов углерода С1 и С2, а также у С3 и С4) образуется две π‑связи. Таким образом, в молекуле бутадиена‑1,3 атомы С1 и С2, а также С3 и С4 связаны двойными связями, а атомы С2 и С3 только одинарной.

Описанная модель, полностью применимая к изолированным диенам, все же недостаточно удовлетворительно описывает строение и свойства бутадиена‑1,3. В частности, с ее помощью сложно объяснить некоторые наблюдаемые факты:
Длина связи С2‑С3 составляет 0.147 нм, что значительно меньше длины обычной одинарной углерод‑углеродной связи в этане (0.154 нм), но при этом больше длины двойной углерод‑углеродной связи в этене (0.133 нм).
Хотя вокруг связи С2‑С3 возможно относительно свободное вращение, большая часть молекул бутадиена‑1,3 находится в состоянии, когда все атомы углерода и водорода располагаются в одной плоскости.
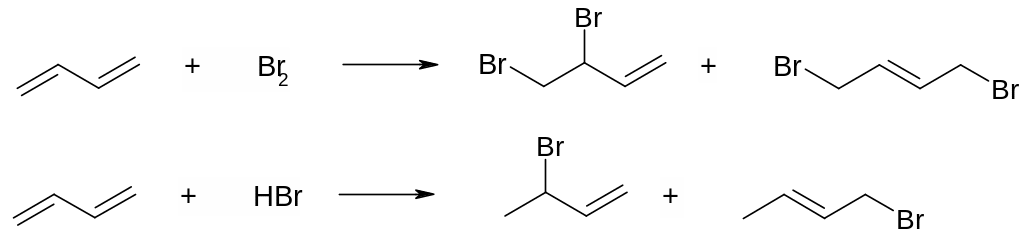
При взаимодействии 1 моль бутадиена‑1,3 с 1 моль брома (или с 1 моль галогеноводорода) образуется два структурных изомера, а не один, как в случае гексадиена‑1,5. Интересной особенностью взаимодействия бутадиена‑1,3 с бромом заключается в том, что при пониженной температуре (-40 оС) основным продуктом является 3,4‑дибромбутен‑1 (т.н. продукт 1,2‑присоединения), а при повышенной (+40 оС) – 1,4‑дибромбутен‑2 (т.н. продукт 1,4‑присоединения). Этот факт объясняется тем, что при повышении температуры между двумя изомерными продуктами устанавливается термодинамическое равновесие, поскольку они могут изомеризоваться друг в друга. При этом в смеси преобладает термодинамически более устойчивый продукт (т.н. термодинамический продукт). При пониженной температуре такое равновесие просто не успевает установиться и преобладает тот продукт, который получается быстрее (т.н. кинетический продукт). Примерно такая же картина наблюдается и при присоединении 1 моль галогеноводорода.
Все эти факты могут быть объяснены с привлечением представлений о сопряжении двойных углерод‑углеродных связей в молекуле бутадиена‑1,3. Это явление заключается в частичном перекрывании р‑орбиталей, принадлежащих атомам С2 и С3.

Такое перекрывание наиболее эффективно при копланарности (параллельности) р‑орбиталей, что и обусловливает плоскую форму молекулы. Оно также обеспечивает некоторую двоесвязанность между атомами С2 и С3, что выражается в уменьшении длины связи С2‑С3 по сравнению с одинарной. Последний факт, впрочем, имеет и другое убедительное объяснение, основанное на отличающихся атомных радиусах углеродных атомов, находящихся в различных гибридных состояниях. В качестве довода в пользу сопряжения двух двойных связей в бутадиене часто приводят данные по теплоте гидрирования бутадиена‑1,3 до бутана. Так, теплота гидрирования бутадиена составляет 57.1 ккал/моль. В то же время теплота гидрирования бутена‑1 составляет 30.3 ккал/моль, что позволяет предположить, что для бутадиена‑1,3 эта величина должна составлять 2·30.3 = 60.6 ккал/моль. Разницу между предсказываемой и наблюдаемой величиной в 3.5 ккал/моль часто называют энергией сопряжения в бутадиене‑1,3. Она свидетельствует о некоторой стабилизации молекулы бутадиена за счет сопряжения двойных связей.
Особенность реакций присоединения к алкинам.
Важнейшим химическим свойством алкинов является их вступление в реакции электрофильного присоединения. Тройная углерод‑углеродная связь менее нуклеофильна, чем двойная, что обычно выражается в более низкой скорости присоединения электрофильных частиц к алкинам в сравнении с алкенами. Считается, что в некоторой степени пониженная реакционная способность алкинов обусловлена низкой стабильностью винильных карбокатионов, образующихся при присоединении электрофила по тройной связи:
Взаимодействие алкинов с водой.
Реакция гидратации алкинов была открыта в 1881 г. М. Г. Кучеровым, получившим ацетальдегид из ацетилена. Он обнаружил, что это кислотно‑катализируемое превращение происходит особенно легко в присутствии солей ртути(II) и характерно не только для ацетилена, но и для его гомологов. Вода присоединяется к алкинам по правилу Марковникова с образованием в качестве промежуточного продукта енола – ненасыщенного спирта, содержащего гидроксильную группу при двойной связи. Енолы нестабильны и изомеризуются в карбонильные соединения. Эта изомеризация катализируется кислотой.
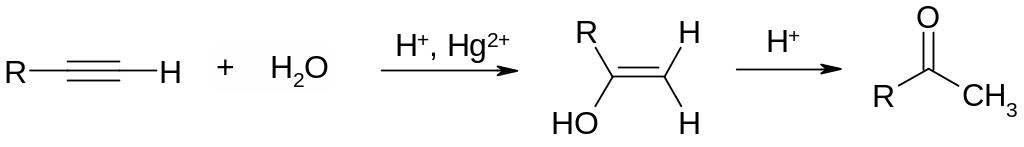
Механизм присоединения воды к тройной связи с образованием енола ясен не до конца. Предполагается, что катионы ртути выступают в качестве электрофильных частиц, присоединяющхся по тройной углерод‑углеродной связи, подобно протону при гидратации алкенов. Реакция гидратации алкинов может, хотя и с заметно более низкой скоростью, протекать в кислой среде при отсутствии солей ртути. Помимо солей ртути гидратацию алкинов катализируют соли золота(III), меди(I), серебра и рутения(III).
Взаимодействие алкинов с галогеноводородами.
Считается, что механизмы присоединения галогеноводородов к алкинам и алкенам аналогичны. Рассмотрим, к примеру, взаимодействие пропина с хлороводородом. Присоединение протона к более гидрогенизированному атому углерода тройной связи приводит к более стабильному катиону винильного типа. Последний при взаимодействии с хлорид-анионом дает 2‑хлорпропен‑2. При избытке хлороводорода этот винилхлорид способен вступать в реакцию присоединения по двойной углерод‑углеродной связи, ведущей к 2,2‑дихлорпропану:

Присоединение по связи С≡С может катализироваться солями меди(I) и ртути(II), что используется в синтезе хлоропрена из винилацетилена:
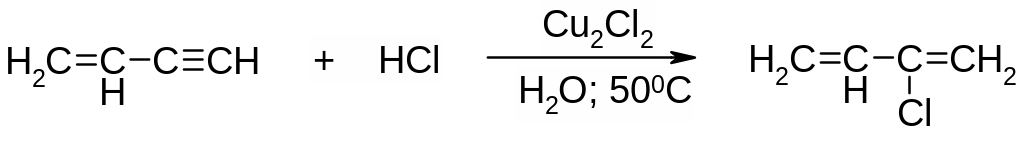
Взаимодействие алкинов с галогенами.
Реакция протекает постадийно. Вначале происходит присоединение 1 моль галогена с образованием ненасыщенного дигалогенида. В случае использование 2 моль реагента, последний также вступает в реакцию, ведущую к тетрагалогениду.

Механизмы присоединения галогенов к алкинам и алкенам в целом аналогичны. Следует отметить, что тройная углерод‑углеродная связь существенно менее реакционоспособна в сравнении с двойной связью С=С по отношению к присоединению галогенов, что зачастую позволяет проводить селективное галогенирование двойной углерод‑углеродной связи в присутствии тройной:
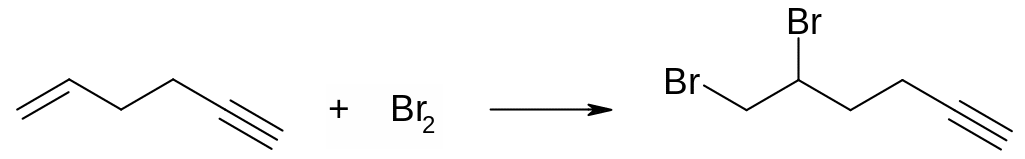
Реакции каталитического гидрирования кратных связей.
Олефины активно присоединяют водород в присутствии катализаторов. Например:
![]()
В качестве катализаторов используются тонкоизмельченные платина, палладий, рутений, родий, осмий и никель либо в чистом виде, либо нанесенные на инертные носители (уголь, карбонат кальция и др.). Все они нерастворимы в органических средах и действуют как гетерогенные катализаторы. Без применения катализаторов реакция гидрирования не идет. Не взаимодействуют алкены также и с водородом в момент выделения.
Роль катализатора заключается в адсорбции на его поверхности молекул водорода и алкена, что приводит к существенному ослаблению или даже полному разрыву как связи Н‑Н, так и π‑связи алкена. Далее происходит последовательное образование новых связей С‑Н, ведущее к получению алкана. Упрощенно протекающий при гидрировании этена процесс можно представить следующим образом:

Процесс гетерогенного гидрирования протекает стереоселективно как процесс цис‑присоединения. Так, при гидрировании 1,2‑диметилциклогексена получается цис‑1,2‑диметилциклогексан, в котором две метильные группы расположены по одну сторону от циклогексанового кольца:
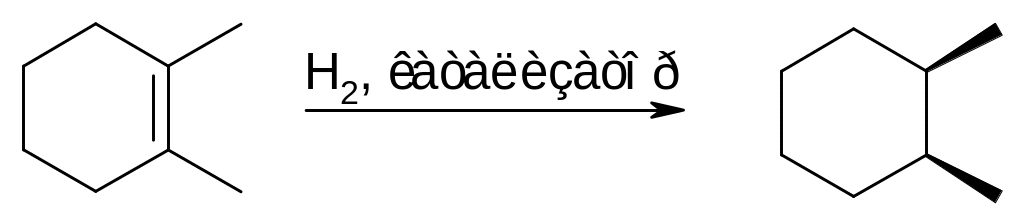
Поскольку для гидрирования необходима адсорбция молекулы олефина на катализаторе по двойной связи, олефины гидрируются тем легче, чем меньше заместителей имеется у двойной связи (правило С. В. Лебедева).
Гидрирование алкинов происходит примерно в тех же условиях и в присутствии тех же катализаторов, что и гидрирование алкенов. При необходимости восстановления алкина до алкена с целью избежания дальнейшего гидрирования до алкана используют так называемый катализатор Линдлара (палладий на карбонате кальция, дезактивированный обработкой ацетатом свинца) или его разновидности (палладий на сульфате бария, дезактивированный хинолином). При восстановлении дизамещенного ацетилена получается цис‑алкен, т.е. гидрирование протекает стереоселективно как процесс цис‑присоединения:

Для восстановления алкина до алкена в качестве катализатора можно также использовать коллоидальный никель. Такой катализатор получается в результате восстановления ацетата никеля боргидридом натрия в спирте в присутствии 1,2‑этилендиамина H2NCH2CH2NH2, который препятствует дальнейшему гидрированию алкена до алкана:

С большинством других катализаторов первоначально получившийся алкен быстро реагирует дальше с образованием конечного продукта гидрирования, т.е. алкана:
![]()
Задачи и упражения.
Предскажите основной продукт реакции:
Ответ:

а)
б)
в)
г)
2. Расположите карбокатионы в ряд по уменьшению устойчивости:
Ответ:
а)
 г > б ≈ в > а
г > б ≈ в > а
б)
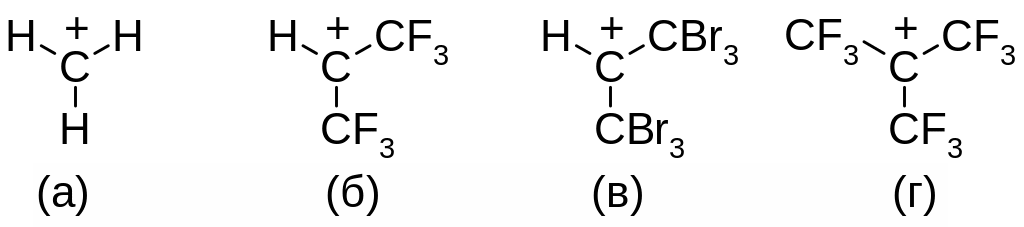 а > в ≥ б > г
а > в ≥ б > г
в)
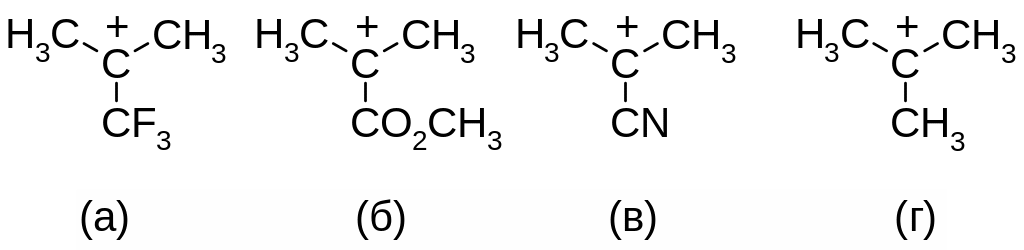 г > а ≈ б ≈ в
г > а ≈ б ≈ в
3. Предскажите структуру и пространственное строение продукта реакции, для случая (а) напишите также вероятный механизм процесса:
Ответ:
а) 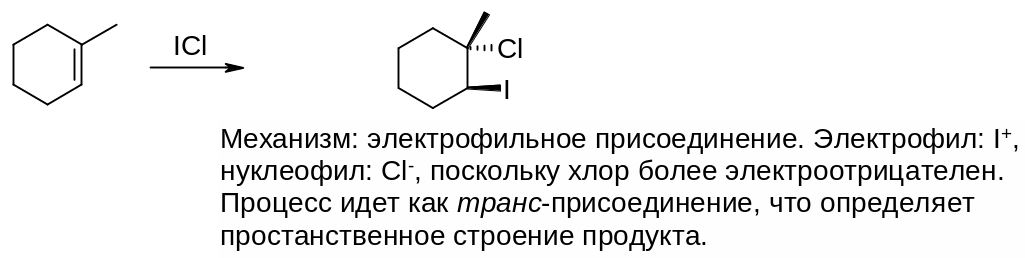
б)
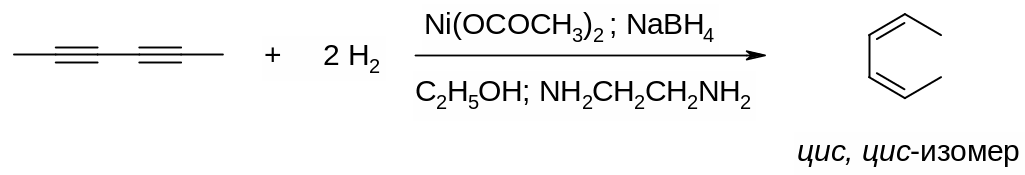
Присоединение 1 моль хлороводорода к изопрену при ‑400С приводит к продукту 1,2‑присоединения. Учитывая, что процесс электрофильного присоединения идет через образование наиболее стабильного карбокатиона, предскажите по какой из связей С=С изопрена преимущественно присоединяется хлороводород, предложите структуру основного продукта реакции:
Ответ:

