
- •П.2. Гибридизация атомов углерода в органических соединениях.
- •Электрон имеет заряд минус один!!! Во всех стабильных соединениях углерод практически всегда четырехвалентен!!!
- •Запомнить:
- •П. 3.2. Формальный и частичный заряды атомов в молекулах и ионах.
- •П. 3.3. Определение формального заряда атома в соединении или ионе.
- •П.4. Понятие об индуктивном эффекте заместителей.
- •П.5. Влияние индуктивного эффекта заместителей на стабильность карбокатионов и карбанионов.
- •П.6. Мезомерный эффект заместителей. Теория резонанса.
- •П.7. Реакции электрофильного присоединения в ряду алкенов.
- •П.8. Реакции нуклеофильного замещения.
П.5. Влияние индуктивного эффекта заместителей на стабильность карбокатионов и карбанионов.
Рассмотрим метильный катион. Напомним, что он может обозначаться одним из нижеприведенных способов. Напомним также, что метильный катион является крайне неустойчивой частицей, поскольку углерод в ней – трехвалентен.

Из первой формулы следует, что положительный заряд (+1) размыт, то есть ДЕЛОКАЛИЗОВАН по атомам водорода и углерода, хотя в основном сконцентрирован на атоме углерода.
ЗАПОМНИТЬ!!!
ЧЕМ БОЛЕЕ ДЕЛОКАЛИЗОВАН ЗАРЯД (ПОЛОЖИТЕЛЬНЫЙ В КАТИОНАХ ИЛИ ОТРИЦАТЕЛЬНЫЙ В АНИОНАХ), ТЕМ БОЛЕЕ СТАБИЛЕН ОРГАНИЧЕСКИЙ ИОН (КАРБОКАТИОН ИЛИ КАРБАНИОН).
Таким образом, для карбокатиона крайне невыгодно, если на электронодефицитном атоме углерода (С+) реальный положительный заряд (δ+) имеет большое значение, но выгодно, если заряд катиона (+1) размыт, делокализован по большому количеству атомов. Эффективность делокализации положительного заряда, в свою очередь, зависит от количества заместителей при карбокатионном центре и их электронных эффектов.
Попытаемся предсказать на основе этого какой из катионов – метильный или этильный – более стабилен. Будем рассуждать примерно так: если один из атомов водорода в метильном катионе заменить на метильную группу, то получится этильный катион (см. рисунок ниже). Метильная группа обладает +I-эффектом, то есть является донором электронов. Это обозначает, что она более эффективно поставляет электроны к электронодефицитному атому углерода, имеющему формальный заряд +1. Для наглядности поясним это на конкретных цифрах (см. рисунок ниже). Если в метильном катионе на каждом из атомов водорода имеется заряд +0.1, то электронодефицитный атом углерода имеет заряд +0.7. В этильном катионе реальный заряд, сконцентрированный на карбокатионном центре, меньше и равен +0.6, поскольку на метильной группе заряд составляет +0.2 (она ведь лучший донор, чем атом водорода), а на атомах водорода +0.1 (суммарный заряд частицы равен +1). По сути дела это обозначает, что в этильном катионе положительный заряд в меньшей степени сконцентрирован на электронодефицитном атоме углерода, более размазан, более ДЕЛОКАЛИЗОВАН, а значит этильный катион более стабилен.
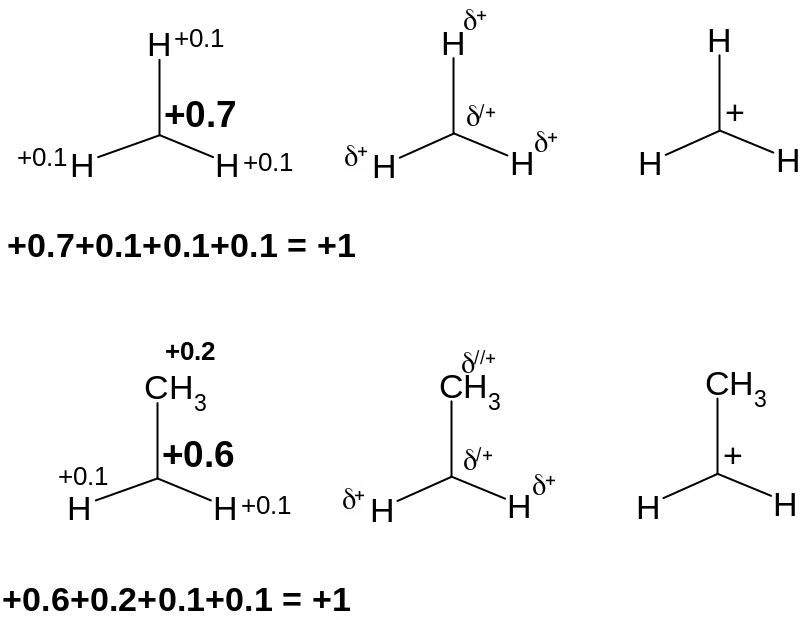
Получается, что при замене одного из атомов водорода на донорную группу стабильность катиона повышается. Нетрудно понять, что и при последующей замене оставшихся атомов водорода на метильную (или другую алкильную) группу стабильность катиона повышается.

Понятно также, что если замена атомов водорода в метильном катионе на электронодонорные (+I-эффект) заместители обеспечивает стабилизацию карбокатиона, то замена атомов водорода на электроноакцепторные (‑I‑эффект) заместители понижает стабильность катиона.
Рассмотрим это на конкретном примере. Заменим один атом водорода в метильном катионе на трифторметильную группу CF3 (‑I-эффект). Эта группа вместо того, чтобы поставлять электроны к электронодефицитному атому углерода (имеющему формальный заряд +1), наоборот, оттягивает на себя электроны. Трифторметильная группа приобретает при этом некоторый δ‑ (к примеру заряд –0.1). Примерное распределение заряда в полученном катионе показано ниже. Из рисунка видно, что в полученном катионе положительный заряд на электронодефицитном атоме углерода составляет не +0.6, как в метильном, а +0.9, то есть положительный заряд не размыт, а наоборот сконцентрирован, локализован на одном атоме углерода, то есть полученный карбокатион обладает пониженной стабильностью.

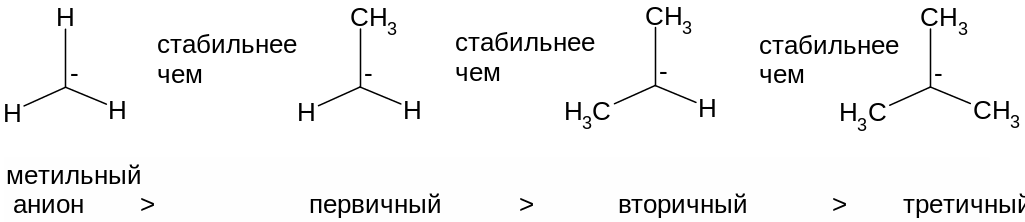
Нетрудно догадаться, что если электронодонорные заместители стабилизируют карбокатионы, а электроноакцепторный дестабилизируют, то в отношении стабильности карбанионов будет наблюдаться полностью противоположная картина. Ниже приведен ряд анионов, полученных последовательной заменой атомов водорода метильного аниона на электроноакцепторные, то есть обладающие –I-эффектом, трифторметильные группы CF3. Видно, что, чем больше групп CF3 находится при электроноизбыточном карбанионном центре, тем более размыт отрицательный заряд, иначе говоря тем больше он делокализован, а значит тем более стабилен анион.

Поскольку алкильные группы являются электронодонорными (+I-эффект), то стабильность АЛКИЛЬНЫХ карбанионов изменяется в следующем порядке:
Важно ясно понимать, что в положительно заряженном карбокатионе для повышения его стабильности необходимо понижать (за счет делокализации) положительный заряд электронодефицитного центра, что эффективно делают электронодонорные группы, обладающие +I-эффектом, способные вследствие этого приобретать некоторый δ+, что и обеспечивает размазывание, делокализацию положительного заряда.
Напротив, в карбанионе необходимо делокализовывать отрицательный заряд, а для этого подходят группы, способные приобретать частичный заряд δ‑, то есть группы, обладающие –I-эффектом.
ЗАПОМНИТЬ!!!
ЧЕМ БОЛЕЕ ДЕЛОКАЛИЗОВАН ЗАРЯД (ПОЛОЖИТЕЛЬНЫЙ В КАТИОНАХ ИЛИ ОТРИЦАТЕЛЬНЫЙ В АНИОНАХ), ТЕМ БОЛЕЕ СТАБИЛЕН ОРГАНИЧЕСКИЙ ИОН (КАРБОКАТИОН ИЛИ КАРБАНИОН).
ДОНОРНЫЕ ЗАМЕСТИТЕЛИ СТАБИЛИЗИРУЮТ КАРБОКАТИОНЫ, АКЦЕПТОРНЫЕ ЗАМЕСТИТЕЛИ СТАБИЛИЗИРУЮТ КАРБАНИОНЫ.
ПОРЯДОК ИЗМЕНЕНИЯ СТАБИЛЬНОСТИ АЛКИЛЬНЫХ КАРБОКАТИОНОВ:
ТРЕТИЧНЫЙ > ВТОРИЧНЫЙ > ПЕРВИЧНЫЙ > МЕТИЛЬНЫЙ КАТИОН
ПОРЯДОК ИЗМЕНЕНИЯ СТАБИЛЬНОСТИ АЛКИЛЬНЫХ КАРБАНИОНОВ:
МЕТИЛЬНЫЙ АНИОН > ПЕРВИЧНЫЙ > ВТОРИЧНЫЙ > ТРЕТИЧНЫЙ
Стабильность карбокатионов и карбанионов играет важную роль при протекании химических реакций. Так, важнейшим свойством алкенов является присоединение к ним различных реагентов. Рассмотрим к примеру реакцию между хлороводородом и пропеном. Она протекает путем первоначального присоединения протона (медленная, или иначе говоря лимитирующая стадия) и последующего присоединения хлорид-аниона. Поскольку протон является электрофильной частицей и именно электрофил присоединяется по двойной связи С=С первым, то механизм присоединения разнообразных реагентов по двойной углерод-углеродной связи алкенов называется «электрофильное присоединение» и обозначают AE (от английских слов addition electrofilic).
Формально протон может присоединиться к любому из двух углеродных атомов, образующих двойную связь С=С. При этом может образоваться либо катион I, либо катион II. Эти катионы являются изомерными, поскольку имеют один и тот же состав С3Н7+, однако характеризуются разной стабильностью. Так, вторичный алкильный карбокатион I более стабилен, чем первичный карбокатион II (первичный, поскольку при электронодефицитном центре имеется лишь одна связь С-С, иными словами при электронодефицитном центре находится лишь один алкильный – в данном случае этильный- заместитель).

В реальности реакция протекает через более стабильную промежуточную частицу I и КАК СЛЕДСТВИЕ основным продуктом реакции является 2-хлорпропан, а не изомерный ему 1-хлорпропан. Таким образом, знание механизма реакции и факторов, определяющих стабильность карбокатионов позволяет нам предсказывать основной продукт реакции.
К примеру, в приведенной ниже реакции основным продуктом является тот, при образовании которого реакция идет через более стабильный карбокатион – в данном случае в основном образуется соединение II (см. ниже).

Однако, при изучении реакций электрофильного присоединения к алкенам различных реагентов (например, хлороводорода HCl) оказалось, что основной продукт реакции не всегда можно предсказать на основании учения об индуктивном эффекте заместителей. Такие несовпадения имеют место для некоторых заместителей, обладающих –I‑эффектом. Ниже приведен целый ряд таких реакций, где основным продуктом является не тот, который можно было ожидать исходя из –I-эффекта заместителя:

